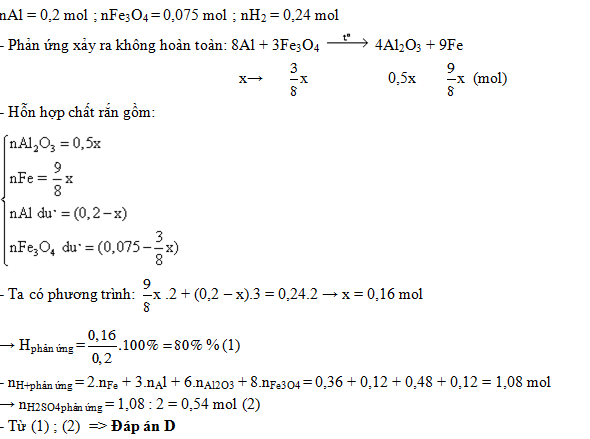20 bài tập vận dụng về phản ứng nhiệt nhôm có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Dùng m gam Al để khử hết 1,6 gam Fe2O3 (phản ứng nhiệt nhôm). Sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 0,672 lít khí (đktc). Tính m ?
Đáp án: C Phương pháp giải: Bảo toàn electron Lời giải chi tiết: Vì sản phẩm sau phản ứng tác dụng với NaOH sinh ra khí => Al dư, Fe2O3 hết Ta có nFe2O3 = 0,01mol; nH2 = 0,03 mol Fe2O3 + 2Al → 2Fe + Al2O3 0,01 → 0,02 (mol) Aldư + H2O + NaOH → NaAlO2 + 3/2 H2 0,02 ← 0,03 (mol) → nAl ban đầu = nAl pư + nAl dư = 0,02 + 0,02 = 0,04 mol → m = 0,04.27 = 1,08 gam Đáp án C Câu hỏi 2 : Nung hỗn hợp A gồm Al, Fe2O3 được hỗn hợp B (hiệu suất 100%). Hòa tan hết B bằng HCl dư được 2,24 lít khí (đktc), cũng lượng B này nếu cho phản ứng với dung dịch NaOH dư thấy còn 8,8g rắn C. Khối lượng các chất trong A là?
Đáp án: C Phương pháp giải: Bảo toàn electron Lời giải chi tiết: Hỗn hợp sau pứ gồm Al2O3, Fe và Al hoặc Fe2O3 dư Nếu Al dư thì B chứa: Al2O3, Fe và Al dư
Cho B tác dụng dd HCl thì: 1,5nAl + nFe = nH2 = 0,1 mol ⟹ nFe < 0,1 mol Khi đó chất rắn C là Fe ⟹ mFe = 8,8 gam ⟹ nFe ≈ 0,157 không thỏa mãn nFe < 0,1 mol ⟹ Al hết và Fe2O3 dư 2Al + Fe2O3 → 2Fe + Al2O3 (1) 0,1← 0,05 ← 0,1 Fe + 2HCl → H2 (2) 0,1 ← 0,1 ⟹ mAl = 27.0,1 = 2,7 gam Theo (1) → mFe203p/ư = 0,05.160 = 8 gam Chất rắn C gồm Fe (0,1 mol) và Fe2O3 dư ⟹ mFe2O3 dư = 8,8 - 56.0,1 = 3,2 gam ⟹ mFe2O3 ban đầu = 8 + 3,2 = 11,2 gam Đáp án C Câu hỏi 3 : Trộn 10,8 gam bột nhôm với 34,8g bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm thu được hỗn hợp A. Hòa tan hết A bằng HCl thu được 10,752 lít H2 (đktc). Hiệu suất phản ứng nhiệt nhôm là
Đáp án: A Phương pháp giải: viết PTHH, tính toán theo PTHH Lời giải chi tiết: nAl = 0,4 nFe3O4 = 0,15 Gọi x là số mol Al phản ứng 8Al + 3Fe3O4 → 9Fe + 4Al2O3 x → 9x/8 => nAl dư = 0,4 - x; nFe = 9x/8 Al + 3HCl → AlCl3 + 1,5H2 Fe + 2HCl → FeCl2 + H2 => nH2 = (0,4 - x).1,5 + 9x/8 = 0,48 => x = 0,32 => H = (0,32/0,4).100% = 80% Đáp án A Câu hỏi 4 : Nung hỗn hợp gồm 10,8 gam gam Al và 16,0 gam Fe2O3 (trong điều kiện không có không khí), sau khi phản ứng xảy ra hoàn toàn thu được chất rắn Y. Khối lượng kim loại trong Y là:
Đáp án: D Phương pháp giải: viết PTHH, tính toán theo PTHH Lời giải chi tiết: 2Al + Fe2O3 → Al2O3 + 2Fe 0,2 ← 0,1 → 0,2 => khối lượng kim loại trong Y = m Fe + m Al dư = 56.0,2 + 10,8 -27.0,2 = 16,6 g Đáp án D Câu hỏi 5 : Thực hiện phản ứng nhiệt nhôm 0,35 mol Al với 0,3 mol Fe2O3 thu được 0,2 mol Fe. Hiệu suất của phản ứng là :
Đáp án: B Phương pháp giải: viết PTHH, tính toán theo PTHH Công thức tính hiệu suất: \(\% H{\rm{ }} = {{luong\,phan\,ung} \over {ban\,dau}}.100\% \) Lời giải chi tiết: 2 Al + Fe2O3 → Al2O3 + 2Fe 0,35 0,35 Giả sử hiệu suất đạt 100% dựa vào hệ số của phản ứng thấy Fe2O3 dư . Vậy hiệu suất phản ứng tính theo Al. Theo phản ứng : nFe = nAl = 0,35 mol => H = 0,2.100% / 0,35 = 57,14% Đáp án B Câu hỏi 6 : Trộn 0,25 mol bột Al với 0,15 mol bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí (giả sử chỉ có phản ứng khử Fe2O3 về Fe) thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, m gam chất rắn khan Z và 0,15 mol H2. Hiệu suất phản ứng nhiệt nhôm và giá trị của m lần lượt là
Đáp án: A Phương pháp giải: Bảo toàn electron Lời giải chi tiết: n Al dư = 2nH2 / 3 = 0,1 mol => H = [(0,25 – 0,1).100%] : 0,25 = 60% 2Al + Fe2O3 → Al2O3 + 2Fe 0,15 → 0,075 → 0,075 → 0,15 => mZ= 160.(0,15 – 0,075) + 56.0,15 = 20,4 g Đáp án A Câu hỏi 7 : Thực hiện phản ứng nhiệt nhôm (trong điều kiện không có không khí, hiệu suất 100%) với 9,66 gam hỗn hợp X gồm Al và một oxit sắt, thu được hỗn hợp rắn Y. Hòa tan Y bằng dung dịch NaOH dư, sau khi các phản ứng xẩy ra hoàn toàn thu được dung dịch Z, chất không tan T và 0,03 mol khí. Sục CO2 đến dư vào dung dịch Z, lọc lấy kết tủa nung đến khối lượng không đổi được 5,1 gam một chất rắn. Công thức của oxit sắt và khối lượng của nó trong hỗn hợp X trên là
Đáp án: B Phương pháp giải: Viết PTHH dạng tổng quát, bảo toàn nguyên tố Al Lời giải chi tiết: \(Al + F{e_x}{O_y}\xrightarrow{{}}\left\{ \begin{gathered} Bảo toàn electron => nAl dư = 2/3 nH2 = 2/3 . 0,03 = 0,02 (mol) Bảo toàn nguyên tố Al => nAl bđ = 2 nAl2O3 (sau nung) = 0,1(mol) => nAl pứ = nAl bđ - nAl dư = 0,1 – 0,02 = 0,08 (mol) => nAl2O3 = ½ nAl pứ = 0,04 (mol) => nO = 3nAl2O3 = 0,12 (mol) Bảo toàn khối lượng ta có: mFexOy = 9,66 - mAlbđ = 9,66 – 0,1.27 = 6,96 (g) => mFe = 6,96 – mO = 6,96 – 0,12.16 = 5,04 (g) => nFe = 0,09 (mol) \( = > \frac{x}{y} = \frac{{{n_{Fe}}}}{{{n_O}}} = \frac{{0,09}}{{0,12}} = \frac{3}{4}\) Đáp án B Câu hỏi 8 : Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành 2 phần: Phần 1 có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng, dư, đun nóng thu được dung dịch Z và 0,165 mol NO (sản phẩm khử duy nhất). Phần 2 đem tác dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn. Công thức của oxit sắt và giá trị của m lần lượt là
Đáp án: C Phương pháp giải: Quy đổi 2 oxit sắt thành Fe, O. Dùng bảo toàn electron 2 phần không chia bằng nhau nên đặt số mol của Al, Fe, O phần 2 gấp k lần phần 1 Lời giải chi tiết:
Câu hỏi 9 : Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al, và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp rắn X. Cho X vào dung dịch NaOH dư thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2(dkc).Sục khí CO2 dư vào Y thu được 7,8 gam kết tủa. Cho Z tan hết vào dung dịch H2SO4, thu được dung dịch chứa 15,6 gam muối sunfat và 2,464 lít khí SO2 (ở đkc, là sp khử duy nhất của H2SO4). Các phản ứng xảy ra hoàn toàn. Giá trị của m là:
Đáp án: C Phương pháp giải: Bảo toàn electron, bảo toàn nguyên tố Lời giải chi tiết: X tác dụng được với dung dịch NaOH tạo H2 nên Al còn dư và nAl = 0,03.2/3 = 0,02 mol CO2 + NaAlO2 + H2O -> Al(OH)3 + NaHCO3 Số mol kết tủa Al(OH)3 = 7,8/78 = 0,1 mol Vậy số mol Al2O3 = (0,1-0,02)/2 = 0,04 mol Số mol O trong Al2O3 = 0,04.3 = 0,12 mol Khối lượng O trong hỗn hợp oxit = 0,12.16 = 1,92 gam Số mol SO2 = 0,11 mol nên Số mol SO42- = 0,11 mol Vậy khối lượng Fe trong muối = 15,6 - 0,11.96 = 5,04 gam => m = 5,04 + 1,92 = 6,96 gam. Đáp án C Câu hỏi 10 : Nung nóng m gam hỗn hợp Al và Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau: • Phần 1: Tác dụng với dung dịch H2SO4 loãng (dư) sinh ra 3,08 lít khí H2 (ở đktc). • Phần 2: Tác dụng với dung dịch NaOH (dư) sinh ra 0,84 lít khí H2 (ở đktc). Giá trị của m là:
Đáp án: A Phương pháp giải: Bảo toàn electron, bảo toàn khối lượng, bảo toàn nguyên tố Lời giải chi tiết: nH2(1) = 0,1375 mol ; nH2(2) = 0,0375 mol \(\left\{ \begin{array}{l}2{\rm{x}} + 3y = 0,275\\1,5y = 0,0375\end{array} \right. \to \left\{ \begin{array}{l}x = 0,1\\y = 0,025\end{array} \right.\) - BTNT O và Fe: nAl2O3 = nFe2O3 = nFe/2 = 0,05 mol Đáp án A Câu hỏi 11 : Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 (dư) vào dung dịch Y, thu được 39 gam kết tủa. Giá trị của m là:
Đáp án: C Phương pháp giải: Bảo toàn electron, bảo toàn khối lượng, bảo toàn nguyên tố Lời giải chi tiết: nH2 = 0,15 mol ; nAl(OH)3 = 0,5 mol - Từ đề suy ra thành phần hỗn hợp rắn X gồm: Fe, Al2O3 (x mol) và Al dư (y mol) - Các phản ứng xảy ra là: 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] CO2 + Na[Al(OH)4] → Al(OH)3 + NaHCO3 - nH2 = 0,15 mol → y = 0,1 mol -BTNT Al: 2x + y = 0,5 → x = 0,2 mol - BTNT O: nO(Fe3O4) = nO(Al2O3) → nFe3O4 = (0,2 . 3) : 4 = 0,15 mol - BTNT Fe: nFe = 3nF3O4 = 3.0,15 = 0,45 mol - BTKL: m = 0,45.56 + 0,2.102 + 0,1.27 = 48,3 gam Đáp án C Câu hỏi 12 : Trộn 5,4 gam bột Al với 17,4 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (trong điều kiện không có không khí). Giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư) thu được 5,376 lít khí H2 (ở đktc). Hiệu suất phản ứng nhiệt nhôm và số mol H2SO4 đã phản ứng là:
Đáp án: D Phương pháp giải: Viết PTHH, tính toán theo PTHH kết hợp bảo toàn electron CT: nH+ = 2n O(oxit) Lời giải chi tiết:
Câu hỏi 13 : Thực hiện phản ứng nhiệt nhôm m gam hỗn hợp X gồm Al và Fe3O4 đến khi phản ứng hoàn toàn thu được hỗn hợp Y (biết Fe3O4 chỉ bị khử về Fe). Chi Y thành hai phần: - Phần 1: cho tác dụng với dung dịch NaOH dư thu được 0,15 mol H2, dung dịch Z và phần không tan T. Cho toàn bộ phần không tan T tác dụng với dung dịch HCl dư thu được 0,45 mol H2. - Phần 2: Cho tác dụng với dung dịch HCl thu được 1,2 mol H2. Giá trị của m là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: \(\eqalign{ & P1:\left\{ \matrix{ Al\,du \hfill \cr A{l_2}{O_3} \hfill \cr Fe \hfill \cr} \right. \to \left\{ \matrix{ {n_{Al\,du}} = {2 \over 3}{n_{{H_2}}} = 0,1 \hfill \cr Fe:0,45 = > {n_{A{l_2}{O_3}}} = 0,45.{4 \over 9} = 0,2 \hfill \cr} \right. \to \left\{ \matrix{ {{{n_{Al\,du}}} \over {{n_{Fe}}}} = {{0,1} \over {0,45}} = {2 \over 9} \hfill \cr {m_{(1)}} = 48,3g \hfill \cr} \right. \cr & P2:\left\{ \matrix{ \buildrel {BT\,e} \over \longrightarrow 2{n_{{H_2}}} = 3{n_{Al\,du}} + 2{n_{Fe}} = 2,4 \hfill \cr {{{n_{Al\,du}}} \over {{n_{Fe}}}} = {2 \over 9} \hfill \cr} \right. \to \left\{ \matrix{ Al\,du:0,2 \hfill \cr Fe:0,9 \hfill \cr A{l_2}{O_3}:0,9.{4 \over 9} = 0,4 \hfill \cr} \right. \cr & = > {m_{(2)}} = 96,6g \cr & = > m = 144,9g \cr} \) Đáp án B Câu hỏi 14 : Tiến hành phản ứng nhiệt nhôm hỗn hợp rắn X gồm Al, FeO và Fe2O3 ( trong điều kiện không có không khí) thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. + Cho phần một vào dung dịch NaOH dư, thu được 0,45 mol H2 và còn m gam chất rắn không tan. + Cho phần hai vào dung dịch HNO3 dư, thu được 0,7 mol NO ( sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Đáp án: B Phương pháp giải: Phần 1: Bảo toàn e => nAl dư = 2/3nH2 = ? (mol) Phần 2: Bảo toàn e: 3nFe + 3nAl dư = 3nNO => nFe = ? (mol) => m = mFe = ? (g) Lời giải chi tiết: Các phản ứng xảy ra hoàn toàn. Hỗn hợp rắn Y + NaOH thấy có H2 thoát ra => Al dư sau phản ứng nhiệt nhôm Vậy hỗn hợp Y gồm Al2O3, Fe và Al dư Phần 1: Bảo toàn e => nAl dư = 2/3nH2 = 2/3. 0,45 = 0,3 (mol) Phần 2: Bảo toàn e: 3nFe + 3nAl dư = 3nNO => nFe = (3.0,7 – 3.0,3)/3 = 0,4 (mol) => m = mFe = 0,4. 56 = 22,4 (g) Đáp án B Câu hỏi 15 : Hỗn hợp X gồm 3,92 gam Fe, 16 gam Fe2O3 và m gam Al. Nung X ở nhiệt độ cao trong điều kiện không có không khí, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau. Phần 1 tác dụng với dung dịch H2SO4 loãng dư, thu được 4a mol khí H2. Phần 2 tác dụng với dung dịch NaOH dư, thu được a mol khí H2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 16 : Hỗn hợp X gồm Al và Fe2O3. Lấy 85,6 gam X đem nung nóng để thực hiện phản ứng nhiệt nhôm, sau một thời gian thu được m gam chất rắn Y. Chia Y làm 2 phần bằng nhau: Phần 1: Hòa tan trong dung dịch NaOH dư thấy thoát ra 3,36 lít khí (đktc) và còn lại m1 gam chất không tan. Phần 2: Hòa tan hết trong dung dịch HCl thấy thoát ra 10,08 lít khí (đktc). Phần trăm khối lượng Fe trong Y là?
Đáp án: B Phương pháp giải: Phản ứng xảy ra không hoàn toàn, ta có sơ đồ sau: Al + Fe2O3 → chất rắn Y chứa Al2O3, Fe, Al dư, Fe2O3 dư - Phần 1: Từ số mol H2 suy ra số mol Al - Phần 2: Số mol H2 do Al tạo ra ở phần 1 và phần 2 bằng nhau. Từ số mol H2 suy ra số mol Fe, từ đó tính được %mFe Lời giải chi tiết: Sơ đồ phản ứng: Al + Fe2O3 → chất rắn Y chứa Al2O3, Fe, Al dư, Fe2O3 dư - Phần 1: Y + NaOH dư → 0,15 mol H2 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ Suy ra nAl = 2/3.nH2 = 2/3.0,15 = 0,1 mol - Phần 2: Y + HCl → 0,45 mol H2 Al + 3HCl→ AlCl3+ 3/2 H2 (1) Fe + 2HCl → FeCl2+ H2 (2) Có nH2 PT 1 = 3/2.nAl = 0,15 mol→ nH2 PT 2 = 0,3 mol → nFe = 0,3 mol Suy ra khối lượng Fe trong hỗn hợp Y là nFe = 2.0,3 = 0,6 mol → %mFe = 0,6.56.100%/85,6 = 39,25% Đáp án B Câu hỏi 17 : Hỗn hợp X gồm Al và Fe3O4. Nung hỗn hợp X ở nhiệt độ cao thu được hỗn hợp Y. Chia Y thành 2 phần bằng nhau: - Phần 1 cho vào dung dịch NaOH dư, sau phản ứng thu được 1,344 lít khí (đktc). - Phần 2 hòa tan vừa hết trong 310 ml dung dịch H2SO4 1M (loãng) thu được 3,36 lít khí (đktc). Hiệu suất của phản ứng nhiệt nhôm là:
Đáp án: C Phương pháp giải: Hỗn hợp Y chứa Al dư, Fe3O4 dư, Al2O3, Fe - Phần 1: Từ số mol H2 tìm được số mol Al - Phần 2: Từ số mol H2 và số mol Al tìm được số mol Fe Từ đó tính được số mol của Al2O3, Fe3O4 trong hỗn hợp sau phản ứng. Dùng bảo toàn nguyên tố Al và Fe để tính số mol Al ban đầu và số mol Fe3O4 ban đầu. => H% Lời giải chi tiết: Hỗn hợp Y chứa Al dư, Fe3O4 dư, Al2O3, Fe - Phần 1: nH2 = 0,06 mol → nAl dư = 2/3.nH2 = 0,04 mol - Phần 2: nH2 = 0,15 mol → nH2 (do Fe tạo ra) = 0,15 - 0,06 = 0,09 mol → nFe = 0,09 mol 8Al + 3Fe3O4 \(\xrightarrow{{{t}^{o}}}\) 4Al2O3 + 9Fe Theo PTHH: nAl2O3 = 4/9. nFe = 4/9. 0,09 = 0,04 mol Ta có: nH2SO4 = 1,5.nAl + 4.nFe3O4 + 3.nAl2O3 + nFe = 0,31 mol => 1,5. 0,04 + 4.nFe3O4 + 3.0,04 + 0,09 = 0,31 mol => nFe3O4 = 0,01 mol Bảo toàn nguyên tố Al ta có: nAl ban đầu = 2.nAl2O3 + nAl dư = 2. 0,04 + 0,04 = 0,12 mol Bảo toàn nguyên tố Fe ta có: 3.nFe3O4 ban đầu = nFe + 3.nFe3O4 dư = 0,09 + 3.0,01 = 0,12 mol → nFe3O4 ban đầu = 0,04 mol Ta có: 0,12:8 > 0,04:3 nên hiệu suất phản ứng tính theo Fe3O4 Ta có: H = nFe3O4 pứ.100%/nFe3O4 ban đầu = (0,04-0,01).100%/0,04 = 75% Đáp án C Câu hỏi 18 : Thực hiện phản ứng nhiệt nhôm với 9,66 gam hỗn hợp X gồm FexOy và Al, thu được hỗn hợp rắn Y. Cho Y tác dụng với dung dịch NaOH dư thu được 0,672 lít khí (đktc), dung dịch D và chất rắn không tan Z. Sục khí CO2 đến dư vào dung dịch D, lọc kết tủa và nung đến khối lượng không đổi thu được 5,1 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Công thức của oxit sắt là:
Đáp án: C Phương pháp giải: Dùng bảo toàn nguyên tố Al để tính số mol Al ban đầu. Từ đó tính được khối lượng của FexOy. Từ số mol H2 suy ra số mol Al dư → Số mol Al phản ứng Dùng bảo toàn nguyên tố O để tìm số mol O có trong oxit sắt. Từ đó suy ra số mol Fe có trong oxit sắt. → Công thức oxit Lời giải chi tiết: Ta có sơ đồ phản ứng: FexOy, Al → Y \(\xrightarrow{+NaOH\,du}\) Khí H2 + dung dịch D (NaAlO2) + chất rắn không tan Z Dung dịch D \(\xrightarrow{+C{{O}_{2}}\,du}\) Kết tủa Al(OH)3 \(\xrightarrow{{{t}^{0}}}\) Al2O3 Bảo toàn nguyên tố Al ta có: nAl = 2.nAl2O3 = 2.0,05 = 0,1 mol → mFexOy = 9,66 - 0,1.27 = 6,96 gam. Ta có: nAl dư = 2/3.nH2 = 2/3.0,03 = 0,02 mol Ta có: nO = 3.nAl2O3 = 1,5.nAl pứ = 1,5. (0,1 - 0,02) = 0,12 mol → mFe = 6,96 - 0,12.16 = 5,04 gam → nFe = 0,09 mol Ta có: nFe : nO = 0,09 : 0,12 = 3 : 4 → Công thức oxit là Fe3O4 Đáp án C Câu hỏi 19 : Thực hiện phản ứng nhiệt nhôm giữa Al và Cr2O3 trong điều kiện không có không khí. Sau phản ứng hoàn toàn thu được hỗn hợp X có khối lượng 43,9 gam. Chia X thành 2 phần bằng nhau: - Cho phần 1 tác dung với dung dịch NaOH dư thu được 1,68 lít khí đktc - Phần 2 phản ứng vừa đủ với V lít dung dịch HCl 1M loãng nóng Giá trị của V là
Đáp án: A Phương pháp giải: Vì phần 1 tác dụng với NaOH tạo khí nên X có Al dư nên hỗn hợp tạo thành có Al2O3, Cr và Al dư Tính theo PTHH 2Al + Cr2O3 → Al2O3 + 2Cr 2NaOH +2Al +2H2O → 2NaAlO2 + 3H2 3HCl + Al → AlCl3 + 3/2 H2 Cr + 2HCl → CrCl2 + H2 Al2O3 + 6HCl → 2AlCl3 + 3H2O Lời giải chi tiết: Vì phần 1 tác dụng với NaOH tạo khí nên X có Al dư nên hỗn hợp tạo thành có Al2O3, Cr và Al dư Có 2Al + Cr2O3 → Al2O3 + 2Cr Nên trong mỗi phần đặt Al: x mol; Al2O3: y mol thì Cr : 2y mol → 2.(27x + 102y + 104y) = 43,9 gam P1: X + NaOH thì 2NaOH +2Al +2H2O → 2NaAlO2 + 3H2 → x = \(\frac{{{n_{{H_2}}}}}{{\frac{3}{2}}} = 0,05\)→ y = 0,1 mol P2 : 3HCl + Al → AlCl3 + 3/2 H2 Cr + 2HCl → CrCl2 + H2 Al2O3 + 6HCl → 2AlCl3 + 3H2O → nHCl = 3x + 2y.2 + 6y =3.0,05 + 10.0,1 =1,15 mol → V = 1,15 lít Đáp án A Câu hỏi 20 : Thực hiện phản ứng nhiệt nhôm hỗn hợp Al, Fe2O3 ( không có không khí) thu được 36,15 gam hỗn hợp X. Chia X thành 2 thành phần Phần 1 : Tác dụng với dung dịch Ba(OH)2 dư, thu được 1,68 lít H2 đktc và 5,6 gam chất rắn không tan Phần 2 : Hòa tan hoàn toàn trong 850 ml dung dịch HCl 2M được 3,36 lít NO đktc và dung dịch chỉ chứa m gam muối. Các phản ứng xảy ra hoàn toàn. Giá trị gần đúng của m là
Đáp án: A Phương pháp giải: Ta có Al + Fe2O3 → Al2O3 + 2Fe Vì hỗn hợp X có khả năng phản ứng với NaOH tạo khia H2 nên X có chứa Al → X không còn Fe2O3 Phần 1 : đặt số mol Al là x mol, số mol của Al2O3 là y mol thì số mol Fe là 2y mol X + Ba(OH)2 thì 2Al + Ba(OH)2 +2H2O → Ba(AlO2)2 + 3H2 Al2O3 + Ba(OH)2 → Ba(AlO2)2 + H2O → nH2 → x = 0,05 mol mrắn = mFe → y =0,05 mol → mphần 1 → mphần 2 →Thành phần của phần 2 Phần 2 : 4H+ + NO3- + 3e → H2O + NO 2H+ + O2- → H2O So sánh nH+ đã phản ứng với nHNO3 → Có phản ứng tạo NH4+không 10H+ + 8e + NO3- → 3H2O + NH4+ Lời giải chi tiết: Ta có Al + Fe2O3 → Al2O3 + 2Fe Vì hỗn hợp X có khả năng phản ứng với NaOH tạo khia H2 nên X có chứa Al → X không còn Fe2O3 Phần 1 : đặt số mol Al là x mol, số mol của Al2O3 là y mol thì số mol Fe là 2y mol X + Ba(OH)2 thì 2Al + Ba(OH)2 +2H2O → Ba(AlO2)2 + 3H2 Al2O3 + Ba(OH)2 → Ba(AlO2)2 + H2O → nH2 = 3/2 . x = 0,075 mol → x = 0,05 mol mrắn = mFe = 56.2y = 5,6 → y =0,05 mol → mphần 1 = 0,05.27 + 0,05.102 + 0,1.56 = 12,05 g → mphần 2 = 36,15 – 12,05 = 24,1 g → mphần 2 : mphần 1 = 2: 1 →phần 2 có 0,1 mol Al, 0,1 mol Al2O3 và 0,2 mol Fe Phần 2 : 4H+ + NO3- + 3e → H2O + NO 2H+ + O2- → H2O nNO = 0,15 mol → nH+ = 0,15.4 + 0,1.3.2 =1,2 mol < nHNO3 = 1,7 mol nên còn phản ứng tạo NH4+ 10H+ + 8e + NO3- → 3H2O + NH4+ 0,5 mol 0,4 0,05 mol Bảo toàn N có nNO3(muối) = nHNO3 – nNO – nNH4 = 1,7 – 0,15 – 0,05 = 1,5 → dung dịch thu được có Al3+: 0,3 mol; Fe2+ : z mol thì Fe3+ : 0,2 –z (mol); NO3- : 1,5 mol → mmuối = 0,3.27 + 0,2.56 + 1,5.62 = 112,3 Đáp án A Quảng cáo
|