20 bài tập vận dụng cao về phản ứng nhiệt nhôm có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm 0,03mol Cr2O3; 0,04mol FeO và a mol Al. Sau một thời gian phản ứng, trộn đều thu được hỗn hợp chất rắn Y. Chia Y thành 2 phần bằng nhau. Phần I phản ứng vừa đủ với 400ml dung dịch NaOH 0,1M (loãng). Phần II phản ứng với dung dịch HCl loãng, nóng (dư) thu được 1,12 lit H2. Giả sử trong phản ứng nhiệt nhôm, Cr2O3 chỉ bị khử thành Cr. % khối lượng Cr2O3 đã phản ứng là:
Đáp án: A Phương pháp giải: Bảo toàn electron Lời giải chi tiết: - Chất rắn thu được sau phản ứng nhiệt nhôm chỉ có Al2O3 và Al còn dư (nếu có) tham gia phản ứng với NaOH: Al2O3 + 2NaOH → 2NaAlO2 + H2O Al + NaOH + H2O → NaAlO2 + 3/2H2 nNaOH = 2nAl2O3 + nAl dư = nAl ban đầu → a = 2nNaOH = 0,08mol (vì ½ Y chỉ phản ứng với 0,04 mol NaOH). - Nhận thấy trong phản ứng nhiệt nhôm, Al nhường e cho Cr2O3 và FeO. Đặt nCr = a và nFe = b (mol) BTe => nAl pư = (3a + 2b)/3 = a + 2b/3 => nAl dư = 0,04 - a - 2b/3 Hỗn hợp rắn sau phản ứng cho tác dụng với HCl loãng nóng dư thì Cr chuyển thành Cr2+; Fe chuyển thành Fe2+; Al chuyển thành Al3+; FeO chuyển thành Fe2+; Cr2O3 chuyển thành Cr3+; Al2O3 chuyển thành Al3+. BTe ta có: 2nH2 = 3nAl + 2nCr + 2nFe => 2.0,05 = 3(0,04 - a - 2b/3) + 2a + 2b => a = 0,02 mol => nCr2O3 pư = nCr : 2 = 0,01 mol → %Cr2O3 phản ứng = (0,01.2/0,03).100% = 66,67%. Đáp án A Câu hỏi 2 : Có 3,94 gam hỗn hợp X gồm bột Al và Fe3O4 (trong đó Al chiếm 41,12% về khối lượng) thực hiện phản ứng nhiệt nhôm hoàn toàn hỗn hợp X trong chân không thu được hỗn hợp Y. Hòa tan hoàn toàn Y trong dung dịch chứa 0,314 mol HNO3 thu được dung dịch Z chỉ có các muối và 0,02 mol một khí duy nhất là NO. Cô cạn dung dịch Z, rồi thu lấy chất rắn khan nung trong chân không đến khối lượng không đổi thu được hỗn hợp khí và hơi T. Khối lượng của T gần nhất với giá trị nào sau đây?
Đáp án: B Phương pháp giải: Bảo toàn electron, bảo toàn nguyên tố. Lời giải chi tiết: Theo đề bài Al chiếm 41,12% về khối lượng hỗn hợp nên ta có: \({m_{Al}} = 3,94.\frac{{41,12}}{{100}} = 1,62(g) \to {m_{F{e_3}{O_4}}} = 3,94 - 1,62 = 2,32(g)\) ⟹ nAl = 0,06 mol và nFe3O4 = 0,01 mol Quy đổi hỗn hợp Y thành Al (0,06 mol); Fe (0,03 mol); O (0,04 mol) Giả sử dung dịch Z chứa: x mol Fe2+; y mol Fe3+; z mol NH4+ + Bảo toàn Fe ⟹ x + y = 0,03 (1) + Quá trình cho - nhận e: Al0 → Al+3 + 3e N+5 + 3e → N+2 (NO) 0,06 → 0,18 0,06 ← 0,02 Fe0 → Fe+2 + 2e N+5 + 8e → NH4+ x → 2x 8z ← z Fe0 → Fe+3 + 3e O0 + 2e → O-2 y → 3y 0,04 → 0,08 Áp dụng bảo toàn e ⟹ 0,18 + 2x + 3y = 0,06 + 8z + 0,08 (2) + Dung dịch Z chứa: Al3+ (0,06); Fe2+ (x); Fe3+ (y); NH4+ (z); NO3‑ (Bảo toàn điện tích ⟹ 2x+3y+z+0,18) Bảo toàn nguyên tố N ⟹ nHNO3 pư = nNO3-(muối) + nNH4+ + nNO ⟹ 0,314 = (2x + 3y + z + 0,18) + z + 0,02 (3) Giải hệ (1) (2) (3) được x = 0,0068; y = 0,0232; z = 0,0154 Vậy muối Z chứa: Al(NO3)3 (0,06); Fe(NO3)2 (0,0068); Fe(NO3)3 (0,0232); NH4NO3 (0,0154) Nung muối tới khối lượng không đổi: 4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2 NH4NO3 → N2O + 2H2O Muối → Chất rắn (0,03 mol Al2O3; 0,015 mol Fe2O3) + Khí và hơi T BTKL ⟹ mT = m muối - mchất rắn = 0,06.213 + 0,0068.180 + 0,0232.242 + 0,0154.80 - 0,03.102 - 0,015.160 = 15,3904 (g) Vậy khối lượng của T gần nhất với 15,35 gam Đáp án B Câu hỏi 3 : Thực hiện phản ứng nhiệt nhôm hỗn hợp X gồm Al và một oxit sắt FexOy (trong điều kiện không có không khí) thu được 92,35 gam chất rắn Y. Hòa tan Y trong dung dịch NaOH (dư) thấy có 8,4 lít khí H2 (ở đktc) thoát ra và còn lại phần không tan Z. Hòa tan 1/2 lượng Z bằng dung dịch H2SO4 đặc, nóng (dư) thấy có 13,44 lít khí SO2 (ở đktc) thoát ra. Biết các phản ứng xảy ra hoàn toàn. Khối lượng Al2O3 trong Y và công thức oxit sắt lần lượt là:
Đáp án: C Phương pháp giải: Bảo toàn electron, bảo toàn nguyên tố Lời giải chi tiết:
Câu hỏi 4 : Cho m gam hỗn hợp A gồm Al và Fe3O4. Nung A trong khí trơ, nhiệt độ cao để phản ứng xảy ra hoàn toàn thu được hỗn hợp B. Nghiền nhỏ hỗn hợp B, trộn đều, chia làm hai phần không bằng nhau: + Phần 1 (phần ít): Tác dụng với dung dịch NaOH dư thu được 1,176 lít khí H2. Tách riêng chất không tan đem hòa tan trong dung dịch HCl dư thu được 1,008 lít khí. + Phần 2 (phần nhiều): Cho tác dụng với dung dịch HCl dư thu được 6,552 lít khí. Giá trị của m và thành phần phần trăm khối lượng của một chất có trong hỗn hợp A (thể tích các khí đo ở đktc) gần giá trị nào nhất sau đây?
Đáp án: A Phương pháp giải: Bảo toàn electron Với bài toàn chia 2 phần không bằng nhau thì giả sử phần 2 gấp k lần phần 1 Lời giải chi tiết: Ở phần 1 khi cho tác dụng với NaOH có sinh ra khí H2 => nhôm dư Phần 1 nH2 = 0,0525 mol => nAl dư = 0,035 mol chất rắn không tan tác dụng với HCl => nH2 = 0,045 mol => nFe = 0,045 mol 8Al + 3Fe3O4 → 4Al2O3 + 9Fe 0,04 ← 0,015 ← 0,045 nAl bđ = 0,035 + 0,04 = 0,075 mol => m1 = mAl + mFe3O4 = 0,075.27 + 0,015.232 = 5,505 gam Phần 2 nH2 = 0,2925 mol Giả sử phần 2 = k. phần 1 Bảo toàn e ở phần 2 ta có (3 . 0,035 + 2 . 0,045) . k = 2 . 0,2925 => k = 3 => m2 = 3m1 = 16,515 gam => m = m1 + m2 = 22,02 gam %Al = 37% và %Fe3O4 = 63% Đáp án A Câu hỏi 5 : Thực hiện phản ứng nhiệt phân nhôm hỗn hợp Al và Fe2O3 ( trong điều kiện không có không khí thu được 234,75 gam chất rắn X. Chia X thành hai phần: Cho phần 1 tác dụng với dung dịch NaOH dư thu được 1,68 lít khí H2 ở đktc và m gam chất rắn. Hòa tan hết m gam chất rắn vào dung dịch H2SO4 đặc nóng thu được dung dịch chứa 82,8 gam muối và 0,6 mol SO2 là sản phẩm khử duy nhất. Hòa tan hết phần 2 trong 12,97 lít dung dịch HNO3 1M, thu được hỗn hợp khí Y (gồm 1,25 mol NO và 1,51 mol NO2) và dung dịch A chứa các chất tan đều là muối, trong đó có a mol Fe(NO3)3. Biết các phản ứng hoàn toàn. Giá trị của a gần đúng với giá trị nào sau đây?
Đáp án: D Phương pháp giải: Bảo toàn nguyên tố, bảo toàn electron Lời giải chi tiết: Phần 1: nH2 = 0,075 => nAldư = 0,05 8Al + 3Fe3O4 → 4Al2O3 + 9Fe 8x→ 3x →4x → 9x Chất rắn không tan trong NaOH là Fe (9x mol). Với H2SO4 đặc nóng => Fe3+ (u) và Fe2+ (v) Bảo toàn electron: 3u + 2v = 0,6 . 2 m muối = 400a/2 + 152b = 82,8 => u = 0,3 và v = 0,15 => 9x = u + v => x = 0,05 Vậy phần 1 chứa Al (0,05), Al2O3 (0,2) và Fe (0,45) => mPhần 1 = 46,95 => mPhần 2 = mX - mPhần 1 = 187,8 => mPhần 2 = 4mPhần 1 Vậy phần 2 chứa các chất có số mol gấp 4 phần 1. Phần 2 chứa Al (0,2), Al2O3 (0,8) và Fe (1,8) => nO = 0,8 . 3 = 2,4 nH+ = 12,97 = 4nNO + 2nNO2 + 2nO + 10nNH4+ => nNH4+ = 0,015 Dung dịch A chứa Fe3+ (a mol), Fe2+ (y mol) và các ion khác. Bảo toàn Fe => a + b = 1,8 Bảo toàn electron => 3a + 2b + 0,2 . 3 = 1,25 . 3 + 1,51 + 0,015 . 8 => a = 1,18 và b = 0,62 Đáp án D Câu hỏi 6 : Nung m gam hỗn hợp X gồm bột Al và Fe3O4 sau một thời gian thu được chất rắn Y. Để hòa tan hết Y cần Y lít dung dịch NaOH vào dung dịch Z đến dư, thu được kết tủa M. Nung M trong chân không đến khối lượng không đổi thu được 44 gam chất rắn T. Cho 50 gam hỗn hợp A gồm CO và CO2 qua ống sư được chất rắn T nung nóng. Sau khi T phản ứng hết thu được hỗn hợp khí B có khối lượng gấp 1,208 lần khối lượng của A. Gía trị của ( m – V) gần với giá trị nào sau đây nhất?
Đáp án: C Phương pháp giải: - Tăng giảm khối lượng. - Bảo toàn nguyên tố. - Bảo toàn electron. Lời giải chi tiết: \(\left\{ \begin{gathered} CO+O(trong FeO+Fe2O3) →CO2 1 1 m↑=44-28=16 g a a m↑=16a Do nA = nB => mB / mA = (50+16a) /50 = 1,208 => a = 0,65 mol. Ta có: 56x + 160y = 44 x + 3y = nCopu = 0,65 => x = 0,5; y = 0,05 (mol). BTNT Fe: 3nFe3O4 = nFeO + 2nFe2O3 => nFe3O4 = 0,2 mol f Al0 - 3e → Al+ 3 H+ + 2e → H2 Fe3 +8/3 -1e → 3Fe + 3 Fe3+8/3 + 2e→ 3Fe +2 Đặt nAl = b mol. Bảo toàn e: 3b + + 1/3nFe3+ = 2nH2 + 3/2nFe2+ => b = 91/180 mol. => m=91/180.27+0,2.232= 60,05 gam. BTNT S: nH2SO4pu = 3nAl2(SO4)3 + nFeSO4 + 3nFe2(SO4)3 = 3.91/360 + 0,5 + 3.0,05 = 169/120 mol. =>V=169/120 /0,7=169/84 lít. => m - V= 60,5 - 169/84 = 58,038 ≈ 58,04 Đáp án C Câu hỏi 7 : Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí thu được hỗn hợp Y. Nghiền nhỏ, trộng đều hỗn hợp Y rồi chia thành hai phần: - Phần 1: có khối lượng 14,49 gam được hòa tan hết trong dung dịch HNO3 loãng dư, đun nóng thu được dung dịch Z và 0,165 mol NO (sản phẩm khử duy nhất). - Phần 2: Đem tác dụng với dung dịch NaOH dư đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn. Công thức của oxit sắt và giá trị của m lần lượt là:
Đáp án: B Phương pháp giải: + \({n_{Al}} = \frac{{{n_{{H_2}}}}}{{1,5}}\) + Bảo toàn electron + Bảo toàn nguyên tố Lời giải chi tiết: \(\begin{gathered} Đáp án B Câu hỏi 8 : Nung nóng m gam hỗn hợp X gồm bột Al và FexOy trong điều kiện không có không khí đến phản ứng hoàn toàn thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành 2 phần: - Phần 1: có khối lượng 6,025 gam được hòa tan hết trong dung dịch HNO3 loãng dư, đun nóng thu được dd Z và 0,075 mol NO (sản phẩm khử duy nhất) - Phần 2 đem tác dụng với dd NaOH dư, đun nóng thu được 0,1125 mol H2 và còn lại 8,4 gam chất rắn. Công thức của oxit sắt và giá trị của m lần lượt là:
Đáp án: B Phương pháp giải: Lập luận để suy ra thành phần các chất có trong Y (Al dư, Fe, Al2O3) Dựa vào các phản ứng để tính số mol các chất có trong mỗi phần Lời giải chi tiết: Do P2 tác dụng với NaOH sinh ra H2 => Al dư sau phản ứng nhiệt nhôm => Y gồm Al dư, Fe, Al2O3 +P2: nAl dư=nH2/1,5=0,075 mol; Chất rắn là Fe: nFe=8,4/56=0,15 mol =>nAl/nFe=1/2 + P1: Giả sử số mol Al dư: x Fe: 2x BT e: 3nAl+3nFe=3nNO=>3x+3.2x=3.0,075=>x=0,025 mol =>mAl2O3=6,025-0,025.27-0,05.56=2,55 g=>nAl2O3=0,025 mol =>nO=3nAl2O3=0,075 mol =>nFe/nO=0,05/0,075=2/3 (Fe2O3) m=4mP1=6,025.4=24,1 gam Đáp án B Câu hỏi 9 : Thực hiện phản ứng nhiệt nhôm m gam hỗn hợp X gồm Al và Fe3O4 đến khi phản ứng hoàn toàn thu được hỗn hợp Y (biết Fe3O4 chỉ bị khử về Fe). ChiaY thành hai phần: - Phần 1: cho tác dụng với dung dịch NaOH dư thu được 0,15 mol H2, dung dịch Z và phần không tan T. Cho toàn bộ phần không tan T tác dụng với dung dịch HCl dư thu được 0,45 mol H2. - Phần 2: Cho tác dụng với dung dịch HCl thu được 1,2 mol H2. Giá trị của m là:
Đáp án: B Phương pháp giải: Do P1+NaOH sinh ra H2 nên trong phản ứng nhiệt nhôm Al dư. Chú ý: Chia thành 2 phần không bằng nhau. Lời giải chi tiết: \(\begin{gathered} Đáp án B Câu hỏi 10 : Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2. Sục khí CO2 dư vào Y, thu được 46,8 gam kết tủa. Cho Z tan hết vào dung dịch HNO3 , thu được dung dịch chứa 146,52 gam muối nitrat và 12,992 lít NO (là sản phẩm khử duy nhất của HNO3). Biết các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở điều kiện tiêu chuẩn. Giá trị của m là
Đáp án: D Phương pháp giải: Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết nAl(OH)3 = 46,8 : 78 = 0,6 (mol) Al + NaOH + H2O → NaAlO2 + 3/2 H2↑ Al2O3 + 2NaOH → 2NaAlO2 + H2O Từ nH2 => nAl2O3 => nO (trong oxit) = ? Z gồm Fe, xét quá trình Z tan trong HNO3 nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO =? (mol) => mFe = mmuối – mNO3- => mOXIT SẮT = mFe + mO = ? Lời giải chi tiết: Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết Al + NaOH + H2O → NaAlO2 + 3/2 H2↑ 0,02 ← 0,03 (mol) nAl(OH)3 = 46,8 : 78 = 0,6 (mol) Al2O3 + 2NaOH → 2NaAlO2 + H2O 0,29 ← ( 0,6 – 0,02) Z gồm Fe, xét quá trình Z tan trong HNO3 nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol) => mFe = 146,52 – 1,74.62 = 38,64(g) => mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g) Đáp án D Câu hỏi 11 : Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2 (đktc). Sục khí CO2 dư vào Y, thu được 7,8 gam kết tủa. Cho Z tan hết vào dung dịch H2SO4 đặc, thu được dung dịch chứa 15,6 gam muối sunfat và 2,464 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất của H2SO4). Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Đáp án: C Phương pháp giải: - X +NaOH =>H2 nên X gồm Fe, Al2O3 và Al dư. - X + NaOH => Y : NaAlO2 và NaOH dư. Chất rắn Z : Fe. Al + NaOH + H2O → NaAlO2 + 1,5 H2 0,02 0,03 NaAlO2 + CO2 + 2H2O → Al(OH)3 + NaHCO3 0,1 0,1 => nAl ban đầu = n↓ = 0,1 mol → nAl p/u = 0,08 mol. ĐLBTNT => nO trong oxit sắt= nO trong oxit nhôm Fe -3e → Fe + 1,5 SO42- SO42- + 2e → SO2 →mFe =mmuối - mSO4 => m Lời giải chi tiết: - X + NaOH =>H2 nên X gồm Fe, Al2O3 và Al dư. - X + NaOH => Y : NaAlO2 và NaOH dư. Chất rắn Z: Fe. Al + NaOH + H2O → NaAlO2 + 1,5 H2 0,02 0,03 NaAlO2 + CO2 + 2H2O → Al(OH)3 + NaHCO3 0,1 0,1 => nAl ban đầu = n↓ = 0,1 mol → nAl p/u = 0,08 mol. ĐLBTNT => nO trong oxit sắt= nO trong oxit nhôm = 3.0,08/2= 0,12 mol. Fe -3e → Fe3+ + 1,5 SO42- 0,22 0,11 SO42- + 2e → SO2 0,22 0,11 →mFe = 15,6 – 0,11.96 = 5,04 gam. => m = 5,04 + 0,12.16 = 6,96 gam. Đáp án C Câu hỏi 12 : Thực hiện phản ứng nhiệt nhôm hỗn hợp X gồm Al và một oxit của sắt trong điều kiện không có không khí, thu được hỗn hợp rắn Y. Chia Y thành 2 phần bằng nhau: - Phần 1: Tác dụng với HNO3 loãng dư, thu được dung dịch chứa 233,7 gam muối và a mol khí NO. - Phần 2: Tác dụng vừa đủ với V ml dung dịch NaOH 2M, thu được 1,5a mol H2 và 16,8 gam chất rắn không tan. Biết các phản ứng xảy ra hoàn toàn. Giá trị của V gần nhất với giá trị nào sau đây?
Đáp án: D Phương pháp giải: Phản ứng xảy ra hoàn toàn, chất rắn sau phản ứng + NaOH thu được khí H2 => chứng tỏ có Al dư sau phản ứng => phản ứng nhiệt nhôm oxit sắt hết. Chất rắn Y gồm có Al2O3, Fe và Al dư Phần 2: Fe không phản ứng với NaOH nên => nFe = 16,8 : 56 = 0,3 (mol) ; Phần 1: nNH4NO3 = ( 3nFe + 3nAl – 3nNO)/8 = ( 0,3. 3+ 3a – 3a) /8 = ?(mol) mmuối = mFe(NO3)3 + mAl(no3)3 + mNH4NO3 => mAl(NO3)3 = ? (g) => nAl(NO3)3 ≈ 0,714 (mol) nNaOH = nNaAlO2- = nAl(NO3)3 = ? (mol) ( Bảo toàn nguyên tố Al) => VNaOH = n: CM = ? (lít) = ?(ml) Lời giải chi tiết: Phản ứng xảy ra hoàn toàn, chất rắn sau phản ứng + NaOH thu được khí H2 => chứng tỏ có Al dư sau phản ứng => phản ứng nhiệt nhôm oxit sắt hết. Chất rắn Y gồm có Al2O3, Fe và Al dư Phần 2: nFe = 16,8 : 56 = 0,3 (mol) ; Bảo toàn e => 3nAl dư = 2 nH2 => nAl = 2/3. nH2 = a (mol) Phần 1: Nếu không tạo muối NH4NO3 thì ne ( Fe, Al dư) nhường = ne (NO nhận) => 0,3. 3 + 3a = 3a => vô lí Vậy phải tạo muối NH4NO3 => nNH4NO3 = ( 3nFe + 3nAl – 3nNO)/8 = ( 0,3. 3+ 3a – 3a) /8 = 0,1125 (mol) mmuối = mFe(NO3)3 + mAl(no3)3 + mNH4NO3 => mAl(NO3)3 = 233,7 – 0,3. 242 – 0,1125.80 = 152, 1(g) nAl(NO3)3 ≈ 0,714 (mol) Rắn Y phản ứng vừa đủ với dd NaOH Al2O3 + 2NaOH → 2NaAlO2 + H2O Al + NaOH → NaAlO2 + 3/2H2 => nNaOH = nNaAlO2- = nAl(NO3)3 = 0,714 (mol) ( Bảo toàn nguyên tố Al) => VNaOH = 0,714: 2 = 0,357 (lít) = 357 (ml) Gần nhất với 352 ml Đáp án D Câu hỏi 13 : Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp chất rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2 (đktc). Sục khí CO2 dư vào Y, thu được 8,58 gam kết tủa. Cho Z tan hết vào dung dịch H2SO4 (đặc, nóng), thu được dung dịch chứa 20,76 gam muối sunfat và 3,472 lít khí SO2 (đktc). Biết SO2 là sản phẩm khử duy nhất của S+6 các phản ứng xảy ra hoàn toàn. Giá trị của m là:
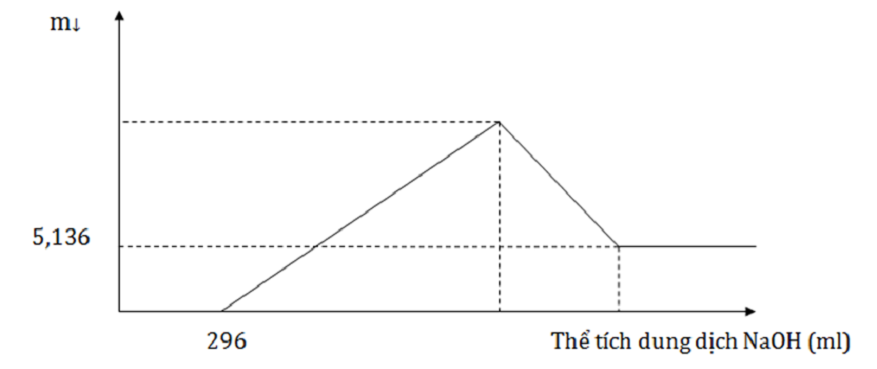
Đáp án: B Phương pháp giải: Viết phương trình hóa học xảy ra, tính toán theo phương trình Lời giải chi tiết: Phản ứng xảy ra hoàn toàn, nhưng sau phản ứng, hỗn hợp tác dụng với NaOH sinh ra khí => X chứa Al dư, oxit sắt bị khử hết. Al + NaOH + H2O → NaAlO2 + 1,5H2 0,02 → 0,02 → 0,03 (mol) nAl(OH)3 = 8,58 :78 = 0,11 (mol) Al2O3 + 2NaOH → 2NaAlO2 + 1,5 H2 0,045 ← (0,11 – 0,02) (mol) Z gồm Fe, xét quá trình Z tan trong H2SO4 đặc nSO2 = 3,472 : 22,4 = 0,155 (mol) => mFe = 20,76 – 0,155.96 = 5,88 (gam) => mOxit Fe = mFe + mO = 5,88 + 0,045.3.16 = 8,04 (gam) Đáp án B Câu hỏi 14 : Thực hiện phản ứng nhiệt nhôm hỗn hợp Al, Fe2O3, Cr2O3 sau một thời gian thu được hỗn hợp chất rắn X. Chia X thành 2 phần bằng nhau. Hòa tan hoàn toàn phần 1 trong dung dịch H2SO4 đặc nóng, dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít khí SO2 (sản phẩm khử duy nhất, đktc). Hòa tan hết phần 2 trong 400 ml dung dịch HNO3 2M, thu được dung dịch Y và khí NO (sản phẩm khử duy nhất, đktc). Cho từ từ dung dịch NaOH 1M đến dư vào Y thu được kết quả như hình vẽ sau: Khối lượng Cr2O3 trong hỗn hợp ban đầu là:
Đáp án: C Phương pháp giải: Phần 1: nSO2 = 0,09 mol Áp dụng bảo toàn electron ta tính được nAl Phần 2: nHNO3 = 0,4.2 = 0,8 mol; nH+ dư = nNaOH = 0,296 mol Áp dụng bảo toàn electron ta tính được nNO Vậy nH+ pứ = 4.nNO + 2.nO → nO Khi cho dung dịch NaOH dư vào Y thì Al(OH)3 và Cr(OH)3 bị hòa tan hoàn toàn. Khi đó còn lại 5,136 gam Fe(OH)3 → nFe2O3 Bảo toàn nguyên tố O ta tính được nCr2O3. Từ đó suy ra mCr2O3. Lời giải chi tiết: Phần 1: nSO2 = 0,09 mol Áp dụng bảo toàn electron ta có nAl = 0,06 mol Phần 2: nHNO3 = 0,4.2 = 0,8 mol; nH+ dư = nNaOH = 0,296 mol Áp dụng bảo toàn electron ta có: nNO = 0,06 mol Vậy nH+ pứ = 0,8- 0,296 = 4.nNO+ 2.nO → nO = 0,132 mol Khi cho dung dịch NaOH dư vào Y thì Al(OH)3 và Cr(OH)3 bị hòa tan hoàn toàn. Khi đó còn lại 5,136 gam Fe(OH)3 → nFe(OH)3 = 0,048 mol → nFe2O3 = 0,024 mol Bảo toàn nguyên tố O ta có: nO = 3.nFe2O3+ 3.nCr2O3 = 0,132 mol → nCr2O3 = 0,02 mol Vậy khối lượng Cr2O3 ban đầu là 0,02.152.2 = 6,08 gam Đáp án C Câu hỏi 15 : Thực hiện phản ứng nhiệt nhôm hỗn hợp X gồm Al và Fe2O3 (trong điều kiện không có không khí) thu được 36,15 gam hỗn hợp Y, nghiền nhỏ, trộn đều và chia hỗn hợp Y thành hai phần. Phần 1 tác dụng với dung dịch NaOH dư thu được 1,68 lít khí H2 (đktc) và 5,6 gam chất rắn không tan. Phần 2 tác dụng vừa đủ với 850 ml dung dịch HNO3 2M thu được 3,36 lít khí NO (đktc) và dung dịch Z chứa m gam hỗn hợp chỉ chứa muối. Các phản ứng xảy ra hoàn toàn. Giá trị m gần nhất với giá trị nào sau đây?
Đáp án: C Phương pháp giải: Phần 1: Tính số mol Al dư dựa vào số mol H2 Chất rắn không tan trong dung dịch NaOH dư là Fe → nFe. Từ đó tính được nAl2O3 Phần 2: Do tỉ lệ các chất trong hỗn hợp Y ở phần 1 và phần 2 là như nhau nên ta đặt số mol Al; Fe và Al2O3 theo tỉ lệ ở phần 1. Giả sử có sản phẩm khử là NH4NO3 y mol Từ số mol HNO3 và khối lượng của Y để tính được số mol Al; Fe và Al2O3 trong phần 2 Bảo toàn nguyên tố N ta suy ra nNO3- trong muối kim loại Vậy khối lượng muối là m =mAl3++ mFe3++ mNO3- trong muối kim loại + mNH4NO3 Lời giải chi tiết: Phần 1: nH2 = 0,075 mol → nAl dư = 0,05 mol Chất rắn không tan trong dung dịch NaOH dư là Fe Ta có: nFe = 5,6 : 56 = 0,1 mol 2Al + Fe2O3 \(\xrightarrow{{{t}^{o}}}\)Al2O3 + 2Fe Theo phương trình ta có nAl2O3 = ½.nFe = 0,05 mol Vậy khối lượng phần 1 là mphần 1 = mAl2O3+ mFe + mAl dư = 0,05.102 + 0,1.56 + 0,05.27 = 12,05 gam => m phần 2 = 36,15 – 12,05 = 24,1 gam => m phần 2 = 2 m phần 1 Phần 2: Do phần 2 gấp đôi phần 1 nên ta có: nAl = 0,1 mol nFe = 0,2 mol nAl2O3 = 0,1 mol => nO = 3nAl2O3 = 0,3 mol Giả sử phản ứng tạo NH4NO3 (x mol) Mặt khác ta có công thức giải nhanh: nHNO3 = 2nO + 4nNO + 10nNH4NO3 => 0,85.2 = 2.0,3 + 4.0,15 + 10x => x = 0,05 mol BTNT “N”: nHNO3 = nNO3- muối KL + nNO + 2nNH4NO3 => 1,7 = nNO3- muối KL + 0,15 + 2.0,05 => nNO3- muối KL = 1,45 mol => m muối = mAl + mFe + mNO3- muối KL + mNH4NO3 = 0,3.27 + 0,2.56 + 1,45.62 + 0,05.80 = 113,2 gam gần nhất với 113 gam Đáp án C Câu hỏi 16 : Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X gồm Al và FeaOb (trong điều kiện không có không khí) thu được hỗn hợp Y. Nghiền nhỏ, trộn đều hỗn hợp Y rồi chia thành hai phần: - Phần 1 có khối lượng 14,49 gam gam được hòa tan hết trong dung dịch HNO3 dư, đun nóng thu được dung dịch Z và 0,165 mol khí NO (sản phẩm khử duy nhất). - Phần 2 tác dụng với dung dịch NaOH dư, đun nóng thu được 0,015 mol khí H2 và còn lại 2,52 gam chất rắn (biết các phản ứng xảy ra hoàn toàn, thể tích các khí đo ở điều kiện tiêu chuẩn). Công thức của FeaOb và giá trị của m là:
Đáp án: C Phương pháp giải: Phần 2: nH2 → nAl dư Do Al dư nên oxit sắt bị khử hết → Chất rắn còn lại là Fe Phần 1: có cùng tỉ lệ số mol như phần 2 Áp dụng định luật bảo toàn electron để tìm số mol Al, Fe và Al2O3 có trong hỗn hợp Y. Có nAl, nFe suy ra nO trong FeaOb. Từ đó suy ra công thức của oxit sắt. Giá trị m = mphần 1 + mPhần 2 Lời giải chi tiết: Phần 2: nH2 = 0,015 mol → nAl dư = 0,01 mol Do Al dư nên oxit sắt bị khử hết → Chất rắn còn lại là Fe: 2,52 gam → nFe = 0,045 mol Phần 1: có cùng tỉ lệ số mol như phần 2 nên nAl = x mol; nFe = 4,5x mol và mAl2O3 = y mol → 27x + 56.4,5x + 102y = 14,49 gam Áp dụng định luật bảo toàn electron ta có: 3.nAl + 3.nFe = 3.nNO → 3x+ 3.4,5x = 3.0,165 Giải hệ ta có: x = 0,03 và y = 0,06 Vậy phần 1 gấp 3 lần phần 2 Suy ra m = mX = 14,49 + 14,49/3 = 19,32 gam Xét phần 1: Bảo toàn nguyên tố Al ta có: nAl = nAl dư + 2.nAl2O3 = x+ 2y = 0,15 mol Ta có: nFe = 4,5x = 0,135 mol Suy ra mO = 14,49 - mAl - mFe = 14,49- 0,15.27- 0,135.56 = 2,88 gam suy ra nO = 0,18 mol → Tỉ lệ a : b = nFe : nO = 0,135 : 0,18 = 3:4 Suy ra công thức oxit là Fe3O4 Đáp án C Câu hỏi 17 : Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp chất rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2 (đktc). Sục khí CO2 dư vào Y, thu được 8,58 gam kết tủa. Cho Z tan hết vào dung dịch H2SO4 (đặc, nóng), thu được dung dịch chứa 20,76 gam muối sunfat và 3,472 lít khí SO2 (đktc). Biết SO2 là sản phẩm khử duy nhất của S+6, các phản ứng xảy ra hoàn toàn. Giá trị của m là
Đáp án: A Phương pháp giải: Do cho X vào NaOH dư thu được khí H2 nên trong phản ứng nhiệt nhôm Al dư, oxit sắt phản ứng hết. X gồm Al dư, Fe, Al2O3. - Cho X phản ứng với NaOH dư: Từ số mol H2 suy ra số mol của Al - Sục CO2 dư vào Y tính được nAl(OH)3 BTNT “Al” tính được số mol của Al2O3 => nO (oxit) - Xét phản ứng của Z (Fe) với H2SO4 đặc nóng: Đặt nFeSO4 = x và nFe2(SO4)3 = y (mol) m muối => (*) BTe: 2nFe2+ + 3nFe3+ = 2nSO2 => (**) Giải hệ (*) và (**) được x, y => nFe(oxit) Tính được m = mFe(oxit) + mO(oxit) Lời giải chi tiết: Do cho X vào NaOH dư thu được khí H2 nên trong phản ứng nhiệt nhôm Al dư, oxit sắt phản ứng hết. X gồm Al dư, Fe, Al2O3. - Cho X phản ứng với NaOH dư: nH2 = 0,03 mol; (1) Al + NaOH + H2O → NaAlO2 + 1,5H2 0,02 ← 0,02 ← 0,03 (2) Al2O3 + 2NaOH → 2NaAlO2 + H2O - Sục CO2 dư vào Y: nAl(OH)3 = 8,58 : 78 = 0,11 mol (3) NaAlO2 + CO2 + 2H2O → Al(OH)3 + NaHCO3 0,11 ← 0,11 => nNaAlO2(2) = nNaAlO2(3) – nNaAlO2(1) = 0,11 – 0,02 = 0,09 => nAl2O3 = 0,09:2 = 0,045 mol BTNT “O”: nO(oxit) = 3nAl2O3 = 3.0,045 = 0,135 mol - Xét phản ứng của Z (Fe) với H2SO4 đặc nóng: Đặt nFeSO4 = x và nFe2(SO4)3 = y (mol) m muối = 152x + 400y = 20,76 (*) BTe: 2nFe2+ + 3nFe3+ = 2nSO2 => 2x + 3.2y = 2.0,155 (**) Giải hệ (*) và (**) được x = 0,005 và y = 0,05 => nFe(oxit) = 0,005 + 0,05.2 = 0,105 mol Vậy m = mFe(oxit) + mO(oxit) = 0,105.56 + 0,135.16 = 8,04 gam Đáp án A Câu hỏi 18 : Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm 0,03 mol Cr2O3; 0,04 mol FeO và a mol Al. Sau một thời gian phản ứng, trộn đều thu dược hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần một phản ứng vừa đủ với 400 ml dung dịch NaOH 0,1M (loãng). Phần hai phản ứng với dung dịch HCl loãng, nóng (dư), thu được 1,12 lít khí H2 (đktc). Giả sử trong phản ứng nhiệt nhôm, Cr2O3 chỉ bị khử thành Cr. Phần trăm khối lượng Cr2O3 đã phản ứng là
Đáp án: D Phương pháp giải: - Sau phản ứng chia làm hai phần bằng nhau, vậy mỗi phần tương đương với lượng phản ứng ban đầu là 0,015 mol Cr2O3, 0,02 mol FeO và a/2 = b mol Al. Số mol các chất trong mỗi phần của hỗn hợp Y là như nhau. (Al, Al2O3, Cr, Cr2O3, Fe, FeO). - Các chất phản ứng với dd NaOH loãng là Al, Al2O3. Riêng Cr2O3 chỉ phản ứng với dd NaOH đặc - Các chất phản ứng với dd HCl loãng nóng, tạo H2 là Al, Cr, Fe. - Vậy xét P1: Al + NaOH và Al2O3 + 2NaOH x x y 2y => Số mol Al ban đầu = x + 2y = nNaOH = 0,04 mol - Xét các phản ứng nhiệt nhôm 2Al + Cr2O3 → Al2O3 + 2Cr 2Al + 3FeO → Al2O3 + 3Fe - Xét phản ứng với dd HCl, ta có tỉ lệ Al → 1,5H2 ; Cr→ H2; Fe → H2 Tính toán theo các phương trình hóa học trên để tính hiệu suất phản ứng. Lời giải chi tiết: - Sau phản ứng chia làm hai phần bằng nhau, vậy mỗi phần tương đương với lượng phản ứng ban đầu là 0,015 mol Cr2O3, 0,02 mol FeO và b mol Al (với b = a/2). Số mol các chất trong mỗi phần của hỗn hợp Y là như nhau. (Al, Al2O3, Cr, Cr2O3, Fe, FeO). Chú ý: Nhiều HS giải cho rằng FeO phản ứng hết. Điều này có thể không chính xác và không khẳng định được. - Các chất phản ứng với dd NaOH loãng là Al, Al2O3. Riêng Cr2O3 chỉ phản ứng với dd NaOH đặc - Các chất phản ứng với dd HCl loãng nóng, tạo H2 là Al, Cr, Fe. - Vậy xét P1: Al + NaOH và Al2O3 + 2NaOH x x y 2y => Số mol Al ban đầu = x + 2y = nNaOH = 0,04 mol - Xét các phản ứng nhiệt nhôm 2Al + Cr2O3 → Al2O3 + 2Cr m m/2 m 2Al + 3FeO → Al2O3 + 3Fe n 1,5n - Xét phản ứng với dd HCl, ta có tỉ lệ Al → 1,5H2 ; Cr → H2; Fe → H2 => nH2 = 1,5x + m + 1,5n và x = 0,04 – m – n => 1,5 (0,04 – m – n) + m + 1,5n = 0,05 => 0,06 - 1,5m - 1,5n + m + 1,5n = 0,05 => 0,06 – 0,5m = 0,05 => m = 0,02 => Số mol Cr2O3 phản ứng = m/2 = 0,01 mol => h = 0,01/0,015*100% = 66,67%. - Đến đây ta thấy rằng lượng FeO phản ứng không ảnh hưởng tới kết quả phản ứng của Cr2O3. Gọi x là % Cr2O3 đã phản ứng 0,5a = 0,04 0,5a*3 - 0,015x*2 = 0,05*2 =>a = 0,08 và x = 0,6667 Hoặc: (0,04*3-0,05*2):2*100:0,015 = 66,667% Đáp án D Câu hỏi 19 : Thực hiện phản ứng nhiệt nhôm hỗn hợp Al và Fe2O3 (trong điều kiện không có không khí) thu được 36,15g hỗn hợp X. Nghiền nhỏ, trộn đều và chia thành 2 phần: - Cho phần 1 tác dụng với dung dịch NaOH dư thu được 1,68 lít khí H2(đktc) và 5,6g chất rắn không tan. - Hòa tan hết phần 2 trong 850 ml dung dịch HNO3 2M thu được 3,36 lít khí NO và dung dịch chỉ chứa m gam hỗn hợp muối. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây:
Đáp án: C Phương pháp giải: Bài toán hỗn hợp kim loại, oxit tan hết trong HNO3 - Quy hỗn hợp về dạng: KL, O => Công thức giải nhanh: ne = ne KL = nNO2 + 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 + 2nO nHNO3 = 2nNO2 + 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 + 2nO Lời giải chi tiết: - Phần 1: nH2 = 1,68: 22,4 = 0,075 mol Khi cho hỗn hợp + NaOH tạo khí => Al dư => ở phản ứng nhiệt nhôm, Fe2O3 hết => chất rắn sau phản ứng với NaOH là Fe Al + NaOH + H2O → NaAlO2 + 1,5H2 => nAl = 2/3 nH2 = 0,05 mol ; nFe = 0,1 mol 2Al + Fe2O3 → Al2O3 + 2Fe Mol 0,1 0,05 0,05 0,1 m1 = (0,1 + 0,05).27 + 0,05.160 = 12,05g => m1: mhh = 12,05: 36,15 = 1: 3 => khối lượng của phần 2 gấp đôi phần 1 - Phần 2: Từ số mol phần 1 => Quy hỗn hợp thành: 0,3 mol Al ; 0,2 mol Fe ; 0,3 mol O nHNO3 = 0,85.2 = 1,7 mol ; nNO = 3,36: 22,4 = 0,15 mol Ta có: nHNO3 = 4nNO + 2nO + 10nNH4NO3 => nNH4NO3 = 0,05 mol Bảo toàn nguyên tố H: nHNO3 = 4nNH4NO3 + 2nH2O => nH2O = 0,75 mol Bảo toàn khối lượng: m2 + mHNO3 = mmuối + mNO + mH2O => mmuối = 2.12,05 + 1,7.63 – 0,15.30 – 0,75.18 = 113,2g Đáp án C Câu hỏi 20 : Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và Fe2O3 (trong điều kiện không có không khí) thu được 36,15 gam hỗn hợp X. Nghiền nhỏ, trộn đều và chia thành 2 phần: - Phần 1: tác dụng với dung dịch NaOH dư thu được 1,68 lít H2 (đktc) và 5,6 gam chất rắn không tan. - Phần 2: Hòa tan hết trong 850 ml dung dịch HNO3 2M thu được 3,36 lít NO và dung dịch chỉ chứa m gam hỗn hợp muối. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Quảng cáo
|