50 câu hỏi lý thuyết mức độ vận dụng về ôn tập chương 6 có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Hòa tan hỗn hợp gồm K2O, BaO, Al2O3 và MgO vào nước dư sau phản ứng hoàn toàn thu được dung dịch X và chất rắn Y. Sục khí CO2 tới dư vào dung dịch X sau phản ứng thu được kết tủa là
Đáp án: B Phương pháp giải: Phương pháp: Al2O3 là oxit lưỡng tính nên bị hòa tan bởi dung dịch kiềm BaCO3 bị hòa tan khi CO2 dư Lời giải chi tiết: Hướng dẫn giải: Đáp án B Câu hỏi 2 : Cho các dung dịch sau: Ba(HCO3)2, NaOH, AlCl3, KHSO4 được đánh số ngẫu nhiên là X, Y, Z, T. Tiến hành các thí nghiệm sau:
Dung dịch chất Y là
Đáp án: B Phương pháp giải: Lời giải chi tiết: X là Ba(HCO3)2 Y là KHSO4 Z là NaOH T là AlCl3 Đáp án B Câu hỏi 3 : Cho các phát biểu sau : (1) Các kim loại Na, K, Ba có cấu trúc mạng tinh thể lập phương tâm khối. (2) Điện phân nóng chảy dùng để điều chế kim loại kiềm, kiềm thổ (3) Từ Be đến Ba(nhóm IIA) nhiệt độ nóng chảy tăng dần. (4) Tất cả các nguyên tố kim loại kiềm thổ đều tác dụng với nước giải phóng khí H2. (5) Các kim loại kiềm đều có nhiệt độ nóng chảy rất cao. (6) Các nguyên tử kim loại kiềm đều có cấu hình electron lớp ngoài cùng là ns1. (7) Các kim loại kiềm đều có tính khử mạnh, do đó để bảo vệ chúng người ta ngâm chúng trong dầu hỏa (8) Các kim loại kiềm đều mềm và nhẹ, có thể tự bốc cháy khi tiếp xúc với nước Số phát biểu đúng là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: (1) Đúng (2) Đúng. Các kim loại kiềm, kiềm thổ, nhôm được điều chế bằng phương pháp điện phân nóng chảy muối halogenua, oxit hoặc hidroxit của chúng (3) Sai. nhóm IIA có nhiệt độ nóng chảy không theo qui luật (4) Sai. Be không phản ứng ở mọi điều kiện, Mg phản ứng với nước nóng (5) Sai. Nhiệt độ nóng chảy thấp (6) Đúng (7) Đúng (8) Đúng Đáp án D Câu hỏi 4 : Cho các phát biểu sau (1) Na2CO3 làm mềm được tất cả các nước cứng (2) Nước cứng toàn phần là nước cứng chứa cả tính cứng tạm thời và tính cứng vĩnh cửu (3) Nếu nHCO3- < 2nCa2+ + Mg2+ thì đó là nước cứng toàn phần (4) Nguyên tắc làm mềm nước cứng là loại bỏ Mg2+ và HCO3- (5) Gốc axit SO42- có thể làm mềm nước cứng (6) Khi đun sôi ta có thể loại bỏ được độ cứng tạm thời của nước (7) Có thể dùng Ca(OH)2 với lượng vừa đủ để loại độ cứng của nước cứng tạm thời (8) Nước cứng có chứa 1 trong 2 ion Cl- và SO42- hoặc cả 2 là nước cứng tạm thời Số phát biểu sai là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: (1) đúng. Nước cứng là nước có chứa nhiều ion Ca2+ và Mg2+ => Na2CO3 làm mềm được nước cứng do: Ca2+ + CO32- → CaCO3 ↓ Mg2+ + CO32- → MgCO3↓ (2) đúng Nước cứng tạm thời là nước có chứa Ca(HCO3)2; Mg(HCO3)2 Nước cứng vĩnh cửu là nước có chứa: CaCl2, CaSO4, MgCl2, MgSO4 Nước cứng toàn phần là nước có cả tính cứng tạm thời và vĩnh cửu (3) sai, vì số mol HCO3- có thể bằng O => có thể là nước cứng vĩnh cửu (4) sai. Nguyên tắc làm mềm nước cứng là loại bỏ ion Ca2+ và Mg2+ (5) sai. Vì MgSO4 không kết tủa => vẫn coi là nước cứng vĩnh cửu (6) đúng. Vì khi đun sôi có phản ứng: Ca(HCO3)2 \(\xrightarrow{{{t^0}}}\) CaCO3↓ + H2O + CO2↑ Mg(HCO3)2 \(\xrightarrow{{{t^0}}}\) MgCO3 ↓ + H2O + CO2↑ (7) Đúng. Vì OH- + HCO3- → CO32- + H2O CO32- kết hợp với ion Ca2+ và Mg2+ => kết tủa => làm mất được tính cứng tạm thời. (8) sai, vì đây phải gọi là nước cứng vĩnh cửu hoặc toàn phần => có 4 đáp án sai Đáp án D Câu hỏi 5 : Trong các thí nghiệm sau, có bao nhiêu thí nghiệm không thu được Al(OH)3 sau phản ứng? 1. Cho từ từ đến dư dung dịch Ba(OH)2vào dung dịchAl2(SO4)3 2. Cho từ từ đến dư dung dịch HCl vào dung dịch Na[Al(OH)4] (hayNaAlO2) 3. Cho từ từ đến dư dung dịch NH3 vào dung dịchAlCl3 4. Sục khí CO2 vào dung dịch Na[Al(OH)4] (hayNaAlO2) 5. Hòa tan phèn chua vào nước 6. Điện phân dung dịchAlCl3 7. Hòa tan 0,23 gam Na vào ống nghiệm chứa 100ml dung dịch Al2(SO4)30,01 M rồi lắc đều
Đáp án: C Phương pháp giải: Lời giải chi tiết: 1. Ba(OH)2 dư sẽ hòa tan được Al(OH)3: Ba(OH)2 + 2Al(OH)3→ Ba(AlO2)2 + H2O 2. HCl dư sẽ hòa tan được Al(OH)3 theo PTHH: 6HCl + 2Al(OH)3 → 2AlCl3 + 3H2O 3. Al(OH)3 không tan trong NH3 dư => thu được Al(OH)3 4. Al(OH)3 không tan trong CO2 dư => thu được Al(OH)3 5. có kết tủa Al(OH)3 6. Không thu được Al(OH)3 7. nNa = 0,01 (mol) => nOH- = 0,01 (mol) ; nAl3+ = 0,002 (mol) nOH-/ nAl3+ = 5 lần => không thu được kết tủa Al(OH)3 => Chỉ có 4 trường hợp không thu đươc Al(OH)3 Đáp án C Câu hỏi 6 : Hoà tan hoàn toàn một lượng Ba vào dung dịch chứa a mol HCl thu được dung dịch X và a mol H2. Trong các chất sau: Na2SO4, Na2CO3,Al, Al2O3, AlCl3, Mg, NaOH và NaHCO3. Số chất tác dụng được với dung dịch X là
Đáp án: B Phương pháp giải: Lời giải chi tiết: - Dung dịch X gồm BaCl2 (0,5a mol) và Ba(OH)2 (0,5a mol) - Có 6 chất tác dụng được với dung dịch X là Na2SO4, Na2CO3,Al, Al2O3, AlCl3 và NaHCO3. Ba2+ + SO42- → BaSO4↓ Ba2+ + CO32- → BaCO3↓ Ba(OH)2 + Al + H2O → Ba(AlO2)2 + H2↑ Ba(OH)2 + Al2O3 → Ba(AlO2)2 + H2O 3Ba(OH)2 + 2AlCl3 → 3BaCl2 + 2Al(OH)3↓ Ba(OH)2 + NaHCO3 → BaCO3↓ + H2O Đáp án B Câu hỏi 7 : Cho hỗn hợp X gồm Ba và Al (đều có a mol) tan hoàn toàn trong nước dư thu được dung dịch Y và khí Z. Nhỏ tiếp a mol H2SO4 vào dung dịch Y thu được kết tủa T. Nung T ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn G. Thành phần của chất rắn G là
Đáp án: A Phương pháp giải: Lời giải chi tiết: Ba + H2O → Ba(OH)2 + H2↑ Al + Ba(OH)2 + H2O → Ba(AlO2)2 + H2↑ Dd Y gồm Ba(OH)2 dư: 0,5a (mol); Ba(AlO2)2 : 0,5a (mol) H+ + OH- → H2O a → a (mol) H+ + AlO2- + H2O → Al(OH)3↓ a → a → a (mol) Ba2+ + SO42- → BaSO4 a → a → a (mol) Vậy rắn T gồm Al(OH)3 và BaSO4 => nung thu được rắn G là: Al2O3 và BaSO4 Đáp án A Câu hỏi 8 : Thực hiện các thí nghiệm sau: (a) Cho mẩu Al vào dung dịch Ba(OH)2. (b) Thêm từ từ dung dịch Na2CO3 đến dư vào dung dịch HCl. (c) Đun nóng NaHCO3. (d) Cho dung dịch NaOH vào lượng dư dung dịch AlCl3. (e) Cho nước vôi vào dung dịch chứa Ca(HCO3)2. (g) Cho mẩu Na vào dung dịch CuSO4. Số thí nghiệm thu được chất khí sau phản ứng là
Đáp án: A Phương pháp giải: Lời giải chi tiết: \(\begin{gathered} Đáp án A Câu hỏi 9 : Thực hiện các thí nghiệm sau: (1) Dung dịch Al(NO3)3 + dung dịch NaOH dư. (2) Dung dịch HCl dư + dung dịch Na2CO3. (3) Dung dịch NH4Cl + dung dịch NaOH đun nóng nhẹ. (4) Dung dịch NaHCO3 + dung dịch HCl. Số thí nghiệm tạo thành chất khí là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Gồm: (2) $2HCl + N{a_2}C{O_3}\xrightarrow{{}}2NaCl + C{O_2} + {H_2}O$ (3) $N{H_3}Cl + NaOH\xrightarrow{{}}NaCl + N{H_3} + {H_2}O$ (4) $NaHC{O_3} + HCl\xrightarrow{{}}NaCl + C{O_2} + {H_2}O$ Đáp án A Câu hỏi 10 : Cho các thí nghiệm sau: (1) Thêm vài giọt Na2CO3 vào dung dịch AlCl3. (2) Nhúng thanh Cu vào dung dịch HCl dư. (3) Thêm từ từ tới dư dung dịch Ba(OH)2 vào dung dịch Al2(SO4)3. (4) Thêm từ từ tới dư dung dịch NH3 vào dung dịch CuSO4. (5) Hấp thụ CO2 vào dung dịch Ca(OH)2 dư. (6) Thêm BaCl2 vào dung dịch NaHSO4. Số thí nghiệm xảy ra mà thu được chất rắn sau phản ứng là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 11 : Cho các thí nghiệm sau: (1) Thêm Si vào dung dịch NaOH. (2) Thêm Al2O3 vào dung dịch Ba(OH)2. (3) Thêm Na2CO3 vào dung dịch Fe(NO3)3. (4) Thêm KHCO3 vào dung dịch KHSO4. (5) Thêm CuS vào dung dịch HCl. (6) Thêm HCl từ từ vào lượng dư dung dịch Na2CO3. Số thí nghiệm xảy ra mà thu được chất khí sau phản ứng là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 12 : Cho các phát biểu sau: (1) Các kim loại Ba, Al, Cr đều bị thụ động trong dung dịch HNO3 đặc nguội. (2) Khi điện phân dung dịch KCl với các điện cực trơ thu được kim loại K ở catot. (3) Dung dịch Na3PO4 làm mềm được nước cứng toàn phần. (4) Nhôm bền trong môi trường không khí và nước là do có màng oxit Al2O3 bền vững bảo vệ. (5) Cho dung dịch KOH vào dung dịch K2Cr2O7 thì dung dịch chuyển từ màu da cam sang màu vàng. (6) NaHCO3 được dùng để sản xuất thuộc dau dạ dày và làm bột nở. Số phát biểu đúng là
Đáp án: C Phương pháp giải: Xem lại kiến thức tổng hợp vô cơ Lời giải chi tiết: (1) sai, Ba không bị thụ động (2) sai, K là kim loại kiềm, có tính khử mạnh nên không bị điện phân, thay vào đó H2O bị điện phân ở catot (3) đúng, vì Na3PO4 kết tủa được ion Mg2+ và Ca2+ thành Mg3(PO4)2 và Ca3(PO4)2 (4) đúng (5) đúng, 2KOH + K2Cr2O7 (màu da cam) → 2K2CrO4 (màu vàng) + H2O (6) đúng → có 4 phát biểu đúng Đáp án C Câu hỏi 13 : Thực hiện các thí nghiệm sau: (a) Đun sôi nước cứng tạm thời. (b) Cho phèn chua vào lượng dư dung dịch Ba(OH)2. (c) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3 dư. (d) Cho hỗn hợp bột Cu và Fe3O4 (tỉ lệ mol 1 : 1) vào dung dịch HCl dư. (e) Cho NaOH dư vào dung dịch Ca(HCO3)2. (g) Cho Zn vào dung dịch FeCl3 (dư). Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là
Đáp án: D Phương pháp giải: Viết các phản ứng hóa học xảy ra, xác định các chất kết tủa thu được Lời giải chi tiết: (a) thu được kết tủa MgCO3, CaCO3 (b) thu được kết tủa BaSO4 (c) thu được kết tủa Ag: Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓ (d) không thu được kết tủa: Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O Cu + 2FeCl3 → CuCl2 + 2FeCl2 (e) thu được kết tủa CaCO3: 2NaOH dư + Ca(HCO3)2 → CaCO3↓ + Na2CO3 + 2H2O (g) không thu được kết tủa: Zn + 2FeCl3 (dư) → ZnCl2 + 2FeCl2 → Có 4 thí nghiệm thu được kết tủa Đáp án D Câu hỏi 14 : Thực hiện các thí nghiệm sau: (a) Cho dung dịch BaCl2 vào dung dịch KHSO4. (b) Cho dung dịch NaOH vào dung dịch Ca(HCO3)2. (c) Cho dung dịch NH3 tới dư vào dung dịch Al(NO3)3. (d) Cho dung dịch HCl tới dư vào dung dịch NaAlO2. (e) Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2. Sau khi các phản ứng kết thúc, số thí nghiệm thu được kết tủa là
Đáp án: A Phương pháp giải: Viết các PTHH xảy ra, chọn các phản ứng thu được kết tủa Lời giải chi tiết: (a) BaCl2 + 2KHSO4 → BaSO4↓ + KCl + HCl (b) 2NaOH + Ca(HCO3)2 → CaCO3↓ + Na2CO3 + 2H2O (c) 3NH3 + 3H2O + Al(NO3)3 → Al(OH)3↓ + 3NH4NO3 (d) 4HCl dư + NaAlO2 → NaCl + AlCl3 + 2H2O (e) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓ → Có 4 thí nghiệm sau phản ứng thu được kết tủa. Đáp án A Câu hỏi 15 : Cho sơ đồ các phản ứng theo đúng tỉ lệ mol (a) X \(\buildrel {{t^o}} \over\longrightarrow \) Y + CO2 (b) Y + H2O → Z (c) T + Z → R + X + H2O (d) 2T + Z → Q + X + 2H2O Các chất R, Q thỏa mãn sơ đồ trên lần lượt là
Đáp án: C Phương pháp giải: Suy luận X là CaCO3. Từ đó tìm được các chất còn lại Lời giải chi tiết: (a) CaCO3(X) \(\buildrel {{t^o}} \over\longrightarrow \) CaO (Y) + CO2 (b) CaO(Y) + H2O → Ca(OH)2 (Z) (c) NaHCO3(T) + Ca(OH)2 (Z) → NaOH(R) + CaCO3↓(X) + H2O (d) 2NaHCO3(T) + Ca(OH)2 (Z) → Na2CO3 (Q) + CaCO3↓(X) + 2H2O Vậy R và Q là NaOH và Na2CO3 Đáp án C Câu hỏi 16 : Cho sơ đồ các phản ứng sau: (a) X1 + H2O \(\mathrel{\mathop{\kern0pt\longrightarrow}\limits_{co\,mang\,ngan}^{dien\,phan\,dung\,dich}} \) X2 + X3↑ + H2↑ (b) X2 + X4 → CaCO3 + Na2CO3 + H2O (c) X2 + X3 → X1 + X5 + H2O. (d) X4 + X6 → CaSO4 + Na2SO4 + CO2 + H2O. Các chất X5, X6 thỏa mãn sơ đồ trên lần lượt là
Đáp án: D Phương pháp giải: Suy luận được X1 là NaCl. Từ đó xác định được các chất còn lại Lời giải chi tiết: (a) NaCl + H2O \(\buildrel {dp{\rm{dd}}\,cmn} \over\longrightarrow \) NaOH + Cl2↑ + H2↑ (X1) (X2) (X3) (b) NaOH + Ca(HCO3)2 → CaCO3 + Na2CO3 + H2O (X2) (X4) (c) NaOH + Cl2 → NaCl + NaClO + H2O (X2) (X3) (X1) (X5) (d) Ca(HCO3)2 + NaHSO4 → CaSO4 + Na2SO4 + CO2 + H2O (X4) (X6) Vậy X5 là NaClO, X6 là NaHSO4 Đáp án D Câu hỏi 17 : Thực hiện các thí nghiệm sau: (a) Cho dung dịch KHSO4 vào dung dịch Ba(HCO3)2. (b) Cho dung dịch NH4Cl vào dung dịch NaOH đun nóng. (c) Cho dung dịch NaHCO3 vào dung dịch CaCl2 đun nóng. (d) Cho dung dịch AlCl3 vào lượng dư dung dịch Ba(OH)2. (e) Cho kim loại Na vào dung dịch CuCl2. Sau khi các phản ứng kết thúc, số thí nghiệm sinh ra chất khí là
Đáp án: C Phương pháp giải: Viết PTHH từ đó xác định được các thí nghiệm sinh ra chất khí. Lời giải chi tiết: (a) 2KHSO4 + Ba(HCO3)2 → K2SO4 + BaSO4 ↓ + 2H2O + 2CO2 ↑ (b) NH4Cl + NaOH \(\xrightarrow{{{t^o}}}\) NaCl + NH3 ↑ + H2O (c) 2NaHCO3 + CaCl2 \(\xrightarrow{{{t^o}}}\) CaCO3 ↓ + H2O + CO2 ↑ + NaCl (Chú ý: Ca(HCO3)2 bị nhiệt phân khi đun nóng) (d) 2AlCl3 + 3Ba(OH)2 → 2Al(OH)3 + 3BaCl2 (e) Na + H2O → NaOH + H2 ↑ 2NaOH + CuCl2 → Cu(OH)2 ↓ + 2NaCl Vậy có 4 thí nghiệm thu được khí là: (a) (b) (c) (e) Đáp án C Câu hỏi 18 : Cho các sơ đồ phản ứng sau theo đúng tỉ lệ mol: (a) X \(\xrightarrow{{{t^o}}}\) Y + CO2 (b) Y + H2O → Z (c) T + Z → R + X + H2O (d) 2T + Z → Q + X + 2H2O Các chất R, Q thỏa mãn sơ đồ trên lần lượt là
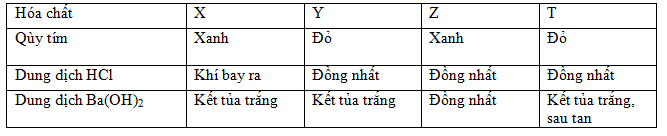
Đáp án: A Phương pháp giải: Lời giải chi tiết: (a) BaCO3 → BaO + CO2 (b) BaO + H2O → Ba(OH)2 (c) KHCO3 + Ba(OH)2 → KOH + BaCO3 + H2O (d) 2 KHCO3 + Ba(OH)2 → K2CO3 + BaCO3 + 2H2O => R, Q lần lượt là KOH, K2CO3. Đáp án A Câu hỏi 19 : Cho sơ đồ các phản ứng sau: (a) X1 + H2O \(\xrightarrow[{co\,mang\,ngan}]{{dien\,phan\,dung\,dich}}\) X2 + X3↑ + H2↑ (b) X2 + X4 → BaCO3 + K2CO3 + H2O (c) X2 + X3 → X1 + X5 + H2O (d) X4 + X6 → BaSO4 + K2SO4 + CO2 + H2O Các chất X5 và X6 thỏa mãn sơ đồ trên lần lượt là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: (a) 2KCl (X1) + 2H2O \(\xrightarrow[{co\,mang\,ngan}]{{dien\,phan\,dung\,dich}}\) 2KOH (X2) + Cl2 (X3)↑ + H2↑ (b) 2KOH (X2) + Ba(HCO3)2 (X4) → BaCO3 + K2CO3 + 2H2O (c) 2KOH (X2) + Cl2 (X3) → KCl (X1) + KClO (X5) + H2O (d) Ba(HCO3)2 (X4) + 2KHSO4 (X6) → BaSO4 + K2SO4 + 2CO2 + 2H2O Vậy X5 là KClO và X6 là KHSO4. Đáp án B Câu hỏi 20 : Cho 3 dung dịch riêng biệt X, Y, Z mỗi dung dịch chứa một chất tan. Thực hiện các thí nghiệm, thu được kết quả như sau:
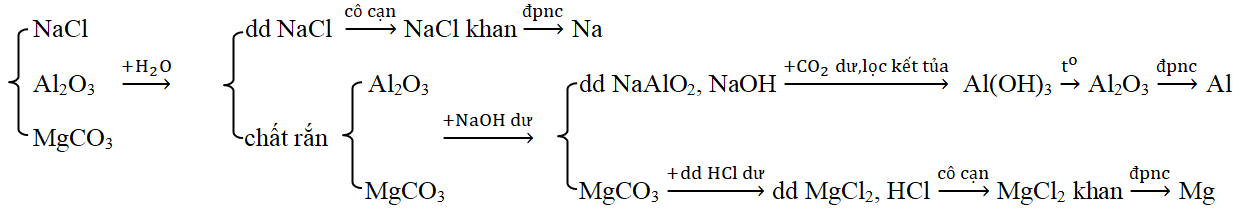
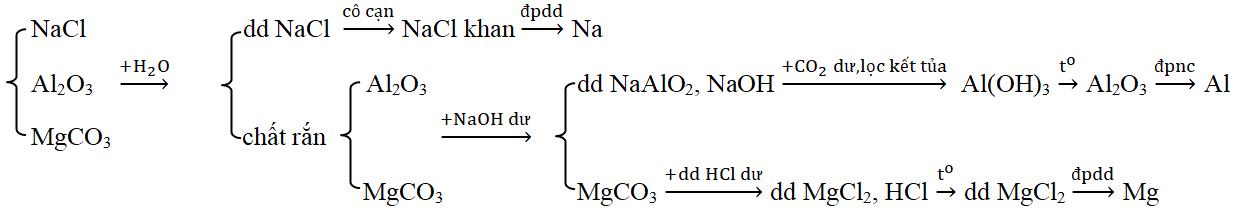
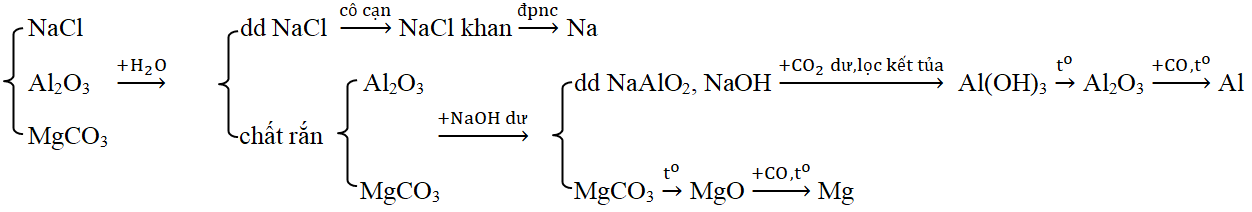
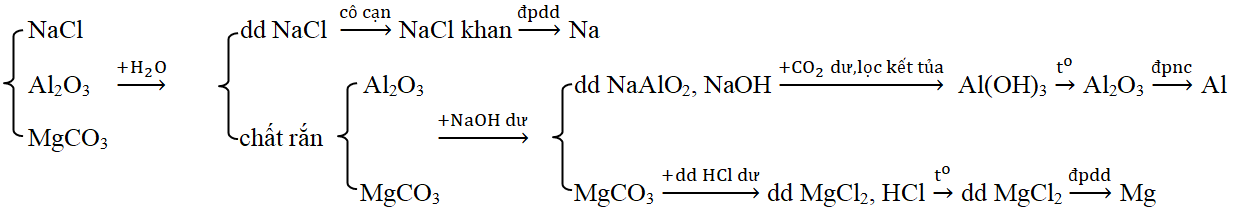
Đáp án: C Phương pháp giải: Xét từng đáp án và loại dần Lời giải chi tiết: A. Loại vì thấy luôn X + Z (H2SO4 + Na2SO4) không có khí thoát ra B. Loại vì thấy luôn X + Y ( Ca(HCO3)2 + Na2CO3) không có khí thoát ra C. Thỏa mãn – X tác dụng với Y có kết tủa và khí thoát ra. KHSO4 + Ba(HCO3)2 → BaSO4↓ + K2SO4 + CO2↑ + H2O – X tác dụng với Z có khí thoát ra. KHSO4 + K2CO3 → K2SO4 + CO2↑ + H2O – Y tác dụng với Z có kết tủa. Ba(HCO3)2 + K2CO3 → BaCO3↓ + KHCO3 D. Loại luôn vì thấy luôn X +Y (NaHCO3 + Ba(NO3)2) không có kết tủa và khí thoát ra Đáp án C Câu hỏi 21 : Dãy chuyển hóa theo sơ đồ \(X\xrightarrow{{ + Ba{{(OH)}_2}}}{\text{Y}}\xrightarrow{{ + T}}{\text{Z}}\xrightarrow{{ + CO2du + {H_2}O}}{\text{X}} + T\). Các chất X, Y, Z, T thỏa mãn sơ đồ trên tương ứng là:
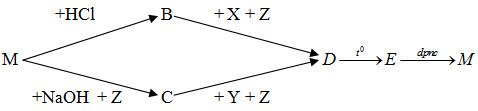
Đáp án: B Phương pháp giải: Dựa vào tính chất hóa học các hợp chất của kim loại kiềm, kiềm thổ và nhôm. Lời giải chi tiết: Ta có: NaHCO3 + Ba(OH)2 → NaOH + BaCO3 + H2O NaOH + Al(OH)3 → NaAlO2 + 2H2O NaAlO2 + CO2 dư + H2O → NaHCO3 + Al(OH)3 Vậy các chất các chất X, Y, Z, T thỏa mãn sơ đồ trên tương ứng là NaHCO3, NaOH, NaAlO2, Al(OH)3. Đáp án B Câu hỏi 22 : Phương pháp phù hợp điều chế từng kim loại riêng biệt từ hỗn hợp những chất NaCl, Al2O3, MgCO3 là
Đáp án: A Phương pháp giải: Dựa vào lý thuyết phần điều chế các kim loại kiềm, kiềm thổ, nhôm để chọn phương pháp phù hợp. Lời giải chi tiết: Sơ đồ A phù hợp: Các PTHH: (1) 2NaCl khan \(\xrightarrow{{dpnc}}\) 2Na + Cl2 (2) Al2O3 + 2NaOH → 2NaAlO2 + H2O (3) NaAlO2 + CO2 + H2O → NaHCO3 + Al(OH)3 ↓ (4) Al(OH)3 \(\xrightarrow{{{t^o}}}\) Al2O3 + H2O (5) 2Al2O3 \(\xrightarrow{{dpnc}}\) 4Al + 3O2 (6) MgCO3 + HCl → MgCl2 + H2O + CO2 (7) MgCl2 khan \(\xrightarrow{{dpnc}}\) Mg + Cl2 Chú ý: Loại B, D vì Na, Mg không điều chế được bằng phương pháp điện phân dung dịch. Loại C vì các oxit Al2O3, MgO không bị khử bởi CO. Đáp án A Câu hỏi 23 : Xác định những chất cần lấy cho sơ đồ phản ứng sau:
Biết M, B, C, D, E, M là các chất có chứa nguyên tố Al. Công thức hóa học của B, C, E lần lượt là
Đáp án: D Phương pháp giải: Dựa vào lý thuyết về nhôm và hợp chất của nhôm. Lời giải chi tiết:
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2 AlCl3 + 3NH3 + 3H2O → Al(OH)3 ↓ + 3NH4Cl 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 NaAlO2 + CO2 + H2O → Al(OH)3 ↓ + NaHCO3 2Al(OH)3 \(\xrightarrow{{{t^o}}}\) Al2O3 + 3H2O 2Al2O3 \(\xrightarrow{{dpnc}}\) 4Al + 3O2 Vậy B, C, E lần lượt là AlCl3, NaAlO2, Al2O3. Đáp án D Câu hỏi 24 : Thực hiện các thí nghiệm sau: 1) Sục khí CO2 dư vào dung dịch NaAlO2. 2) Sục khí CO2 dư vào dung dịch Ca(OH)2. 3) Sục khí NH3 dư vào dung dịc AlCl3. 4) Cho H2S vào dung dịc AgNO3. 5) Cho Na2S vào dung dịch FeCl3. 6) Cho AlCl3 vào dung dịch KAlO2. Số thí nghiệm thu được chất kết tủa là
Đáp án: B Phương pháp giải: - Viết PTHH - Xác định các phản ứng sinh ra kết tủa Lời giải chi tiết: 1) CO2 + NaAlO2 + H2O → Al(OH)3 ↓ + NaHCO3 → thu được kết tủa Al(OH)3 2) 2CO2 + Ca(OH)2 → Ca(HCO3)2 → không thu được kết tủa 3) 3NH3 + AlCl3 + 3H2O → Al(OH)3 ↓ + 3NH4Cl → thu được kết tủa Al(OH)3 4) H2S + 2AgNO3 → Ag2S ↓ + 2HNO3 → thu được kết tủa Ag2S 5) 3Na2S + 2FeCl3 → Fe2S3 + 6NaCl; Fe2S3 + 6H2O → 2Fe(OH)3 ↓ + 3H2S → thu được kết tủa Fe(OH)3 6) AlCl3 + 6H2O + 3KAlO2 → 4Al(OH)3 ↓ + 3KCl → thu được kết tủa Al(OH)3 Vậy có 5 thí nghiệm thu được kết tủa là 1) 3) 4) 5) 6). Đáp án B Câu hỏi 25 : Cho các phát biểu sau: (a) Muối Al2(SO4)3 khan hòa tan trong nước tỏa nhiệt làm dung dịch nóng lên do bị hidro hóa. (b) Các nguyên tố thuộc nhóm IA đều là kim loại kiềm. (c) Phương pháp trao đổi ion trong làm mềm nước cứng thường dùng các vật liệu polime là zeolit. (d) Điện phân dung dịch NaCl bằng điện cực trơ, màng ngăn xốp thu được nước Giaven. (e) Khi đun nóng, hoặc áp suất CO2 giảm đi thì Ca(HCO3)2 bị phân hủy tạo ra kết tủa. (g) Hồng ngọc là loại đá quý có thành phần hóa học là Al2O3 tinh thể với một phần nhỏ Cr2O3. Số các phát biểu đúng là
Đáp án: C Phương pháp giải: Dựa vào kiến thức tổng hợp học trong chương 6 sgk hóa 12. Lời giải chi tiết: (a) sai, bị hiđrat hóa chứ không phải bị hiđro hóa. (b) sai, trừ H không phải kim loại kiềm (c) đúng (d) sai, điện phân không màng ngăn mới thu được dd nước Giaven (e) đúng, Ca(HCO3)2 \(\xrightarrow{{{t^0}}}\) CaCO3↓ + CO2↑ + H2O (g) đúng → có 3 phát biểu đúng Đáp án C Câu hỏi 26 : Cho các phát biểu sau: (a) Hỗn hợp Al và BaO (tỉ lệ mol tương ứng là 1:1) tan hoàn toàn trong nước dư. (b) Canxi cacbonat có nhiệt độ nóng chảy cao, không bị phân hủy bởi nhiệt. (c) Phản ứng giữa canxi cacbonat với nước có hòa tan khí CO2 giải thích sự xâm thực của nước mưa (có chứa CO2) đối với đá vôi diễn ra trong tự nhiên. (d) Cho bột Cu vào lượng dư dung dịch FeCl3, thu được dung dịch chứa ba muối. (e) Thạch cao khan được dùng để nặn tượng, đúc khuôn và bó bột khi gãy xương, … Số phát biểu đúng là
Đáp án: D Phương pháp giải: Lý thuyết tổng hợp về kim loại kiềm, kim loại kiềm thổ, nhôm Lời giải chi tiết: (a) đúng vì, nBaO : nAl = 1 : 1 → nOH- : nAl = 2 : 1 = 2 > 1 nên tan hoàn toàn trong nước dư (b) sai, CaCO3 → CaO + CO2 (nhiệt độ) (c) đúng, CaCO3 + CO2 + H2O ⇄ Ca(HCO3)2 (d) đúng, Cu + 2FeCl3 dư → 2FeCl2 + CuCl2 ⟹ thu được 3 muối: FeCl2, CuCl2, FeCl3 dư (e) sai, thạch cao nung (CaSO4.H2O) được dùng để nặn tượng, đúc khuôn, bó bột, … → 3 phát biểu đúng Đáp án D Câu hỏi 27 : Nghiên cứu một dung dịch chứa chất tan X trong lọ không dán nhãn và thu được kết quả sau: - X đều có phản ứng với cả 3 dung dịch: NaHSO4, Na2CO3 và AgNO3. - X không phản ứng với cả 3 dung dịch: NaOH, Ba(NO3)2, HNO3. Vậy dung dịch X là dung dịch nào sau đây?
Đáp án: C Phương pháp giải: Lời giải chi tiết: X không phản ứng với NaOH => chỉ có BaCl2 thỏa mãn Đáp án C Câu hỏi 28 : Có các phát biểu sau : (a) Tất cả các kim loại kiềm thổ đều tan trong nước. (b) Các kim loại kiềm có thể đẩy các kim loại yếu hơn ra khỏi dung dịch muối của chúng. (c) Các ion Na+,Mg2+, Al3+ có cùng cấu hình electron ở trạng thái cơ bản và đều có tính oxi hóa yếu. (d) Các kim loại kiềm K, Rb, Cs có thể tự bốc cháy khi tiếp xúc với nước. (e) Cho dung dịch NaOH dư vào dung dich AlCl3, sau phản ứng thu được dung dịch trong suốt. Trong các phát biểu trên số phát biểu đúng là :
Đáp án: B Phương pháp giải: Lời giải chi tiết: (a) Sai .Mg , Be không tan trong nước (b) Sai. Các kim loại kiềm không thể đẩy kim loại khác ra khỏi muối Đáp án B Câu hỏi 29 : Thực hiện các thí nghiệm sau: (1) Sục khí CO2 dư vào dung dịch Ca(OH)2. (2) Sục khí NH3 dư vào dung dịch AlCl3. (3) Sục khí CO2 dư vào dung dịch NaAlO2. (4) Cho dung dịch AgNO3 vào dung dịch FeCl3. (5) Cho dung dịch HCl vào dung dịch K2SiO3. (6) Cho ure vào dung dịch Ca(OH)2. Sau khi kết thúc thí nghiệm, số trường hợp thu được kết tủa là
Đáp án: B Phương pháp giải: Lời giải chi tiết: (1) Sục khí CO2 dư vào dung dịch Ca(OH)2: 2CO2 + Ca(OH)2 → Ca(HCO3)2 => không thu được kết tủa (2) Sục khí NH3 dư vào dung dịch AlCl3: AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl Do NH3 là bazo yếu không hòa tan được Al(OH)3 => thu được kết tủa Al(OH)3 (3) Sục khí CO2 dư vào dung dịch NaAlO2: NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3 CO2 + H2O có tính axit yếu nên không hòa tan được Al(OH)3 => thu được kết tủa Al(OH)3 (4) Cho dung dịch AgNO3 vào dung dịch FeCl3: 3AgNO3 + FeCl3 → Fe(NO3)3 + 3AgCl↓ => thu được kết tủa AgCl (5) Cho dung dịch HCl vào dung dịch K2SiO3: 2HCl + K2SiO3 → 2KCl + H2SiO3↓ => thu được kết tủa H2SiO3 (6) Cho ure vào dung dịch Ca(OH)2: (NH2)2CO + 2H2O → (NH4)2CO3 (NH4)2CO3 + Ca(OH)2 → CaCO3↓ + 2NH3 + 2H2O => thu được kết tủa CaCO3 Vậy có 5 thí nghiệm thu được kết tủa. Đáp án B Câu hỏi 30 : Cho sơ đồ phản ứng sau: (a) X1 + H2O (b) X2 + X4 → BaCO3 ↓ + Na2CO3 + H2O (c) X2 + X3 → X1 + X5 + H2O (d) X4 + X6 → BaSO4 ↓ + K2SO4 + CO2↑ + H2O Các chất X2, X5, X6 theo thứ tự là
Đáp án: A Phương pháp giải: Lời giải chi tiết: Ta có 2NaCl (X1) + 2H2O → 2NaOH (X2) + H2 + Cl2(X3) NaOH + Ba(HCO3)2 (X4) → BaCO3 + Na2CO3 + H2O 2NaOH + Cl2 → NaCl + NaClO(X5) + H2O Ba(HCO3)2 +2 KHSO4(X6) → BaSO4 + K2SO4 + 2H2O + 2CO2 Đáp án A Câu hỏi 31 : Thực hiện các thí nghiệm sau: (1) Nung NaHCO3 rắn. (2). Cho CaOCl2 vào dung dịch HCl đặc (3) Sục khí CO2 vào dung dịch Ba(OH)2 dư (4) Sục khí SO2 vào dung dịch KMnO4 (5). Cho dung dịch KHSO4 vào dung dịch NaHCO3. (6). Sục khí Cl2 vào dung dịch KI. Số thí nghiệm sinh ra chất khí là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Các thí nghiệm cho ra chất khí là: (1), (2), (5) Đáp án D Câu hỏi 32 : Cho các phản ứng theo sơ đồ sau: CO2 + NaAlO2 + H2O → (A) ↓ + (B) CaCO3 \(\xrightarrow{{{t^o}}}\) (X) + (Y) ↑ (X) + H2O → (Z) Nếu cho (B) tác dụng với (Z) dư thì tổng hệ số của tất cả các chất trong phương trình phản ứng là
Đáp án: C Phương pháp giải: - Từ sơ đồ các phản ứng đề bài cho xác định các chất A, B, X, Y, Z - Viết PTHH (B) tác dụng với (Z) dư → tổng hệ số Lời giải chi tiết: CO2 + NaAlO2 + 2H2O → Al(OH)3 (A) + NaHCO3 (B) CaCO3 \(\xrightarrow{{{t^o}}}\) CaO (X) + CO2 (Y) CaO (X) + H2O → Ca(OH)2 (Z) Nếu cho (B) tác dụng với (Z) dư: NaHCO3 + Ca(OH)2 dư → CaCO3 + NaOH + H2O → tổng hệ số các chất là 5 Đáp án C Câu hỏi 33 : Cho các phát biểu sau: (a) Cho dung dịch NH3 vào dung dịch AlCl3 có xuất hiện kết tủa. (b) Nhiệt phân hoàn toàn Cu(NO3)2 tạo thành Cu. (c) Hỗn hợp Na2O và Al (tỉ lệ mol 1 : 1) tan hết trong nước dư. (d) Trong công nghiệp dược phẩm, NaHCO3 được dùng để điều chế thuốc đau dạ dày. (e) Trong công nghiệp, Al được sản xuất bằng phương pháp điện phân nóng chảy AlCl3. Số phát biểu đúng là
Đáp án: A Phương pháp giải: Dựa vào kiến thức học trong chương 6 “Kim loại kiềm, kiềm thổ và nhôm” để chọn được phát biểu đúng hay sai. Lời giải chi tiết: (a) Đúng, PTHH: 3NH3 + 3H2O + AlCl3 → Al(OH)3↓ + 3NH4Cl (b) Sai, nhiệt phân hoàn toàn Cu(NO3)2 thu được CuO PTHH: 2Cu(NO3)2 \(\xrightarrow{{{t^0}}}\)2CuO + 4NO2 + O2 (c) Đúng PTHH: Na2O + H2O → 2NaOH (mol) 1 → 2 2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2 (mol) 1 ← 1 Hỗn hợp tan hoàn toàn, dd sau pư thu được NaAlO2 và NaOH dư: 1 mol (d) Đúng (e) Sai, trong công nghiệp, Al được sản xuất bằng cách điện phân nóng chảy Al2O3 PTHH: 2Al2O3 \(\xrightarrow{{{t^0}}}\)4Al + 3O2 → có 3 phát biểu đúng Đáp án A Câu hỏi 34 : Chọn hóa chất để phân biệt chất trong các dãy sau: Câu 1: Các kim loại: Al, Mg, Ba, Na.
Đáp án: C Phương pháp giải: - Dùng H2O để xếp các kim loại vào 2 nhóm: tan và không tan - Nhóm kim loại tan phân biệt bằng ion CO32- - Nhóm kim loại không tan phân biệt bằng dung dịch NaOH Lời giải chi tiết: Chọn hóa chất: H2O, dung dịch NaOH, dung dịch Na2CO3. - Cho các kim loại vào H2O: + Kim loại tan tạo khí ⟹ Ba, Na Ba + 2H2O → Ba(OH)2 + H2 2Na + 2H2O → 2NaOH + H2 + Kim loại không tan ⟹ Al, Mg - Cho 2 kim loại Al, Mg vào dung dịch NaOH: + Kim loại tan tạo khí ⟹ Al 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 + Kim loại không tan ⟹ Mg - Sục khí vào 2 dung dịch Ba(OH)2, NaOHthu được: + Có vẩn đục trắng ⟹ Ba(OH)2 CO2 + Ba(OH)2 → BaCO3 ↓ + H2O + Không hiện tượng ⟹ NaOH Đáp án C Câu 2: Các dung dịch muối: NaCl, Ba(NO3)2, Al2(SO4)3.
Đáp án: A Phương pháp giải: - Dùng dung dịch kiềm nhận biết Al3+ - Dùng muối CO32- hoặc SO42- để nhận biết ion Ba2+ Lời giải chi tiết: Chọn hóa chất: Dung dịch NaOH, dung dịch Na2CO3. - Nhỏ từ từ đến dư NaOH vào các dung dịch: + Xuất hiện kết tủa sau đó kết tủa tan ⟹ Al2(SO4)3 Al2(SO4)3 + 6NaOH → 2Al(OH)3 ↓ + 3Na2SO4 Al(OH)3 + NaOH → NaAlO2 + 2H2O + Không hiện tượng ⟹ NaCl, Ba(NO3)2 - Nhỏ dd Na2CO3 vào 2 dung dịch còn lại: + Xuất hiện kết tủa trắng ⟹ Ba(NO3)2 Ba(NO3)2 + Na2CO3 → BaCO3 ↓ + 2NaNO3 + Không hiện tượng ⟹ NaCl Đáp án A Câu 3: Các oxit: CaO, FeO, Al2O3.
Đáp án: A Phương pháp giải: Lời giải chi tiết: Chọn hóa chất: H2O, dung dịch NaOH - Cho các chất rắn vào H2O: + Có sự tỏa nhiệt, sau một thời gian có chất rắn màu trắng lắng xuống ⟹ CaO CaO + H2O → Ca(OH)2 (ít tan, màu trắng) + Không có hiện tượng ⟹ FeO, Al2O3 - Cho các chất rắn còn lại vào dung dịch NaOH dư: + Chất rắn tan hết ⟹ Al2O3 Al2O3 + 2NaOH → NaAlO2 + H2O + Không hiện tượng ⟹ FeO Đáp án A Câu 4: Các dung dịch: NaNO3, Ca(NO3)2, Al(NO3)3.
Đáp án: C Phương pháp giải: - Dùng dung dịch kiềm nhận biết Al3+ - Dùng muối CO32- để nhận biết ion Ca2+ Lời giải chi tiết: Chọn hóa chất: Dung dịch KOH, dung dịch Na2CO3. - Nhỏ từ từ đến dư KOH vào các dung dịch: + Xuất hiện kết tủa sau đó kết tủa tan ⟹ Al(NO3)3 Al(NO3)3 + 3KOH → Al(OH)3 ↓ + 3KNO3 Al(OH)3 + KOH → KAlO2 + 2H2O + Không hiện tượng ⟹ NaNO3, Ca(NO3)2 - Nhỏ dd Na2CO3 vào 2 dung dịch còn lại: + Xuất hiện kết tủa trắng ⟹ Ca(NO3)2 Ca(NO3)2 + Na2CO3 → CaCO3 ↓ + 2NaNO3 + Không hiện tượng ⟹ NaNO3 Đáp án C Câu hỏi 35 : Cho các chất: MgCO3, MgO, Mg(OH)2, MgCl2, MgSO4 và sơ đồ: A ⟶ B ⟶ C ⟶ D ⟶ E. Chuỗi phản ứng phù hợp với sơ đồ trên là
Đáp án: A Phương pháp giải: Dựa vào mối quan hệ của các hợp chất của Magie để chọn ra chuỗi phản ứng phù hợp với sơ đồ đề bài cho. Lời giải chi tiết: A thỏa mãn Sơ đồ: MgCO3 ⟶ MgO ⟶ MgSO4 ⟶ MgCl2 ⟶ Mg(OH)2 Các PTHH: (1) MgCO3 \(\xrightarrow{{{t^o}}}\) MgO + CO2 (2) MgO + H2SO4 → MgSO4 + H2O (3) MgSO4 + BaCl2 → MgCl2 + BaSO4 ↓ (4) MgCl2 + 2NaOH → Mg(OH)2 ↓ + 2NaCl B không thỏa mãn do từ MgSO4 không điều chế trực tiếp được MgO. C không thỏa mãn do từ MgSO4 không điều chế trực tiếp được MgO. D không thỏa mãn do từ MgCl2 không điều chế trực tiếp được MgO. Đáp án A Câu hỏi 36 : Xác định các chất trong chuỗi phản ứng sau: A + B → C + H2O B \(\xrightarrow{{{t^o}}}\) C + H2O + D ↑ D + A → B hoặc C Biết D là hợp chất của cacbon. A, B, C là hợp chất của một kim loại, khi đốt nóng cho ngọn lửa màu vàng. A, B, C, D lần lượt là
Đáp án: B Phương pháp giải: Dựa vào các phản ứng đặc trưng của các kim loại kiềm, kiềm thổ và hợp chất. Lời giải chi tiết: A: NaOH B: NaHCO3 C: Na2CO3 D: CO2 Các PTHH: NaOH + NaHCO3 → Na2CO3 + H2O NaHCO3 \(\xrightarrow{{{t^o}}}\) Na2CO3 + H2O + CO2 ↑ CO2 + NaOH → NaHCO3 hoặc CO2 + 2NaOH → Na2CO3 + H2O Đáp án B Câu hỏi 37 : Có 4 lọ đựng dung dịch sau: KHSO4, KOH, Ba(HCO3)2, BaCl2 được đánh dấu ngẫu nhiên không theo thứ tự là A, B, C, D. Để xác định hóa chất trong mỗi lọ người ta tiến hành thí nghiệm và thấy hiện tượng như sau: + Cho dung dịch A tác dụng với dung dịch C thấy xuất hiện kết tủa không thấy xuất hiện khí. + Cho dung dịch B tác dụng với dung dịch C không thấy xuất hiện hiện tượng gì. + Cho dung dịch A tác dụng với dung dịch D vừa thấy xuất hiện kết tủa vừa thấy xuất hiện khí. Các chất A, B, C, D lần lượt là:
Đáp án: C Phương pháp giải: + Cho dung dịch A tác dụng với dung dịch D vừa thấy xuất hiện kết tủa vừa thấy xuất hiện khí. → {A; D} = {KHSO4; Ba(HCO3)2} → {B; C} = {KOH; BaCl2} + Cho dung dịch A tác dụng với dung dịch C thấy xuất hiện kết tủa không thấy xuất hiện khí. Xét các phương án để chọn được đáp án đúng. Lời giải chi tiết: + Cho dung dịch A tác dụng với dung dịch D vừa thấy xuất hiện kết tủa vừa thấy xuất hiện khí. → {A; D} = {KHSO4; Ba(HCO3)2} → {B; C} = {KOH; BaCl2} + Cho dung dịch A tác dụng với dung dịch C thấy xuất hiện kết tủa không thấy xuất hiện khí. Trong các đáp án ta thấy C thỏa mãn. Các PTHH: Ba(HCO3)2 + 2KHSO4 → BaSO4 ↓ + K2SO4 + 2CO2 ↑ + 2H2O Ba(HCO3)2 + KOH → BaCO3 ↓ + KHCO3 + H2O Hoặc Ba(HCO3)2 + 2KOH → BaCO3 ↓ + K2CO3 + 2H2O Đáp án C Câu hỏi 38 : Cho các nhận định sau: (1) Các kim loại kiềm thổ đều có cấu trúc mạng tinh thể lập phương tâm khối. (2) Na, K, Ca và Be đều tan trong nước ở điều kiện thường. (3) Các kim loại kiềm được ứng dụng trong ngành công nghiệp hàng không. (4) Số electron lớp ngoài cùng của kim loại kiềm thổ có dạng chung là ns1np1. Số nhận định chính xác là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Câu hỏi 39 : Cho các phát biểu sau: (a) NaHCO3 được dùng làm thuốc chữa đau dạ dày do nguyên nhân thừa axit trong dạ dày. (b) Trong phản ứng của Al với dung dịch NaOH, chất oxi hóa là NaOH. (c) Các hợp kim nhẹ, bền, chịu được nhiệt độ cao và áp suất cao được dùng chế tạo tên lửa. (d) Thạch cao nung (CaSO4.2H2O) được dùng để bó bột, đúc tượng. (e) Cho kim loại Mg dư vào dung dịch FeCl3 sau phản ứng thu được dung dịch chứa 2 muối tan. Số phát biểu đúng là
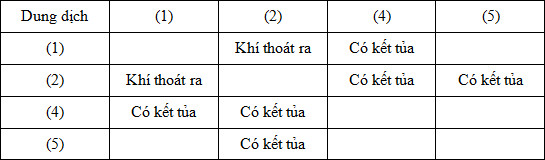
Đáp án: B Phương pháp giải: Dựa vào kiến thức tổng hợp về các chất vô cơ Lời giải chi tiết: (a) đúng, do NaHCO3 trung hòa bớt axit trong dạ dày (b) sai, chất oxi hóa là H2O (c) đúng (d) sai, thạch cao nung là CaSO4.H2O (e) sai, chỉ thu được 1 muối MgCl2 3Mg dư + 2FeCl3 → 3MgCl2 + 2Fe → 2 phát biểu đúng Đáp án B Câu hỏi 40 : Các dung dịch riêng biệt: Na2CO3, BaCl2, MgCl2, H2SO4, NaOH được đánh số ngẫu nhiên (1), (2), (3), (4), (5). Tiến hành một số thí nghiệm, kết quả được ghi trong bảng sau:
Các dung dịch (1), (3), (5) lần lượt là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Câu hỏi 41 : Một học sinh tiến hành nghiên cứu dung dịch T đựng trong lọ không dán nhãn thì thu được kết quả sau: - T phản ứng với dung dịch NaOH và dung dịch Na2CO3. - T phản ứng với dung dịch HCl. Vậy dung dịch T là dung dịch nào sau đây?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Ta thấy X phản ứng được với cả axit và bazo => X có tính lưỡng tính => Ba(HCO3)2 Đáp án D
Câu hỏi 42 : Thực hiện các thí nghiệm sau: (a) Nhiệt phân tinh thể KNO3. (b) Đun nóng nước cứng vĩnh cửu. (c) Cho kim loại K vào dung dịch AlCl3. (d) Hòa tan hỗn hợp gồm Na2O và Al vào nước. (e) Nhỏ dung dịch NaHSO4 vào dung dịch NaHS. Số thí nghiệm có tạo ra chất khí là
Đáp án: C Phương pháp giải: Viết các phản ứng hóa học xảy ra Lời giải chi tiết: (a) KNO3 \(\xrightarrow{{{t^0}}}\) KNO2 + 1/2O2↑ (b) không có khí thoát ra (c) K + H2O → KOH + 1/2H2↑ 3KOH + AlCl3 → Al(OH)3↓ + KCl có thể xảy ra thêm phản ứng: KOH + Al(OH)3 → KAlO2 + 2H2O (d) Na2O + H2O → 2NaOH Al + NaOH + H2O → NaAlO2 + 3/2H2↑ (e) NaHSO4 + NaHS → Na2SO4 + H2S↑ → Có 4 thí nghiệm có khí thoát ra Đáp án C Câu hỏi 43 : Cho các phát biểu sau: (a) Điện phân dung dịch NaCl (điện cực trơ), thu được Na tại catot. (b) Có thể dùng Ca(OH)2 làm mất tính cứng của nước cứng tạm thời. (c) Thạch cao nung có công thức là CaSO4.2H2O. (d) Trong công nghiệp, Al được sản xuất bằng cách điện phân nóng chảy Al2O3. (e) Điều chế Al(OH)3 bằng các cho dung dịch AlCl3 tác dụng với dung dịch NH3. Số phát biểu đúng là
Đáp án: A Phương pháp giải: Lời giải chi tiết: Câu hỏi 44 : Cho các phát biểu sau: (1) Trong nhóm IIA, theo chiều tăng điện tích hạt nhân, khối lượng riêng của các kim loại giảm dần (2) Tất cả các nguyên tố thuộc nhóm IA đều là kim loại kiềm (3) CaSO4.2H2O là thạch cao sống còn CaSO4.H2O hoặc CaSO4.0,5H2O là thạch cao nung (4) Trong công nghiệp, người ta điều chế NaOH bằng cách điện phân dung dịch NaCl bão hòa với điện cực trơ có màng ngăn (5) Các kim loại kiềm đều có cấu trúc mạng tinh thể lập phương tâm khối (6) Nhôm và hợp kim của nhôm có màu trắng bạc, đẹp, được dùng làm khung cửa và trang trí nội thất Số phát biểu sai là
Đáp án: C Phương pháp giải: Xem lại bài kim loại kiềm, kim loại kiềm thổ và các hợp chất của Ca Lời giải chi tiết: (1) sai vì nhóm IIA chứa cả mạng lục phương, lập phương tâm diện, lập phương tâm khối → không xác định được chiều của khối lượng riêng (2) sai vì nguyên tố H thuộc nhóm IA không phải là kim loại kiềm (3) đúng (4) đúng (5) đúng (6) đúng Vậy có 2 phát biểu sai. Đáp án C Câu hỏi 45 : Tiến hành các thí nghiệm sau: (1) Cho dung dịch AgNO3 vào dung dịch HCl (2) Cho Al2O3 vào dung dịch HCl loãng dư (3) Cho Cu vào dung dịch HCl đặc, nóng dư (4) Cho Ba(OH)2 vào dung dịch KHCO3 (5) Cho hỗn hợp Cu, Fe3O4 tỷ lệ mol 2 : 1 vào dung dịch HCl loãng dư (6) Cho Ba vào dung dịch chứa Ca(HCO3)2 (7) Cho 1 mol Na và dung dịch chứa 0,1 mol Al2(SO4)3 (8) Cho Cr vào dung dịch HNO3 loãng nguội dư (9) Cho Ba(OH)2 dư vào dung dịch Al2(SO4)3 Sau khi kết thúc các thí nghiệm, số thí nghiệm thu được chất rắn là:
Đáp án: A Phương pháp giải: Lý thuyết các chất vô cơ Lời giải chi tiết: (1) AgNO3 + HCl → AgCl ↓ + HNO3 (3) Cu không phản ứng với HCl (4) Ba(OH)2 + 2NaHCO3 → BaCO3 ↓ + Na2CO3 + 2H2O (5) Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O x→2x 2FeCl3 + Cu → CuCl2 + 2FeCl2 2x → x => còn dư x mol Cu (6) Ba + 2H2O → Ba(OH)2 + H2 Ba(OH)2 + Ca(HCO3)2 → CaCO3 + BaCO3 + 2H2O (9) 4Ba(OH)2 + Al2(SO4)3 → 3BaSO4 + Ba(AlO2)2 + 4H2O => có 6 thí nghiệm thỏa mãn Đáp án A Câu hỏi 46 : Thực hiện các thí nghiệm sau: (a) Đun sôi nước cứng tạm thời (b) Cho phèn chua vào lượng dư dung dịch Ba(OH)2 (c) Cho dung dịch NaOH dư vào dung dịch AlCl3 (d) Sục khí CO2 đến dư vào dung dịch Ca(OH)2 (e) Cho dung dịch HCl dư vào dung dịch NaAlO2 (f) Sục khí CO2 dư vào dung dịch NaAlO2 Sau khi kết thúc phản ứng, số thí nghiệm thu được kết tủa là:
Đáp án: A Phương pháp giải: Lý thuyết tính chất hóa học vô cơ Lời giải chi tiết: (a) Ca(HCO3)2 \(\buildrel {{t^o}} \over\longrightarrow \) CaCO3 ↓ + H2O + CO2; Mg(HCO3)2 \(\buildrel {{t^o}} \over\longrightarrow \) MgCO3 ↓ + H2O + CO2 => Thu được kết tủa CaCO3, MgCO3 (b) Phèn chua là K2SO4.Al2(SO4)3.24H2O. Ban đầu tạo kết tủa BaSO4 và Al(OH)3, khi Ba(OH)2 dư thì Al(OH)3 bị hòa tan còn lại BaSO4 => Thu được kết tủa BaSO4 (c) 3NaOH + AlCl3 → Al(OH)3 + 3NaCl ; Al(OH)3 + NaOH → NaAlO2 + 2H2O => Không thu được kết tủa (d) Ca(OH)2 + 2CO2 → Ca(HCO3)2 => Không thu được kết tủa (e) NaAlO2 + HCl + H2O → Al(OH)3 + NaCl ; Al(OH)3 + 3HCl → AlCl3 + 3H2O => Không thu được kết tủa (f) CO2 + 2H2O + NaAlO2 → NaHCO3 + Al(OH)3 ↓ => Thu được kết tủa Al(OH)3 Vậy có 3 thí nghiệm thu được kết tủa sau phản ứng là (a), (b), (f) Đáp án A Câu hỏi 47 : Cho các phát biểu sau: (a) Điện phân dung dịch NaCl (điện cực trơ), thu được Na tại catot. (b) Có thể dùng Ca(OH)2 làm mất tính cứng của nước cứng tạm thời. (c) Thạch cao nung có công thức là CaSO4.2H2O. (d) Trong công nghiệp, Al được sản xuất bằng cách điện phân nóng chảy Al2O3. (e) Điều chế Al(OH)3 bằng các cho dung dịch AlCl3 tác dụng với dung dịch NH3. Số phát biểu đúng là
Đáp án: A Phương pháp giải: Lời giải chi tiết: (a) sai, PTHH: 2NaCl bh + 2H2O \(\xrightarrow{{dpmn}}\) 2NaOH + H2 + Cl2 (b) đúng (c) sai, CaSO4.2H2O là công thức của thạch cao sống; thạch cao nung có công thức là CaSO4.H2O hoặc CaSO4.0,5H2O. (d) đúng (e) đúng, vì NH3 có môi trường bazo cung cấp OH- để tạo Al(OH)3, bên cạnh đó NH3 có môi trường kiềm yếu nên không hòa tan được Al(OH)3 Vậy có 3 phát biểu đúng Đáp án A Câu hỏi 48 : Cho các phát biểu sau: (1) Công thức hóa học của phèn chua là K2SO4.Al2(SO4)3.24H2O. (2) Các kim loại Na, K, Ba đều phản ứng mạnh với nước ở nhiệt độ thường. (3) Quặng boxit có thành phần chính là Al2O3.2H2O. (4) Nhôm là kim loại màu trắng, nhẹ, có nhiều ứng dụng quan trọng. (5) Nước cứng là nước có chứa nhiều ion Ca2+, Mg2+. (6) Có thể điều chế kim loại Na bằng phương pháp điện phân dung dịch NaCl. Số phát biểu đúng là
Đáp án: C Phương pháp giải: Lời giải chi tiết: (6) sai, để điều chế kim loại Na chỉ có cách là điện phân nóng chảy hợp chất của nó Các phát biểu còn lại đúng Đáp án C Câu hỏi 49 : Hòa tan hoàn toàn 2 chất rắn X, Y (có số mol bằng nhau) vào nước thì thu được dung dịch Z. Sau đó tiếp tục tiến hành các thí nghiệm sau Thí nghiệm 1: Cho dung dịch NaOH dư vào V ml dung dịch Z, thu được n1 mol kết tủa. Thí nghiệm 2: Cho dung dịch NH3 dư vào V ml dung dịch Z, thu được n2 mol kết tủa. Thí nghiệm 3: Cho dung dịch AgNO3 dư vào V ml dung dịch Z, thu được n3 mol kết tủa. Biết các phản ứng xảy ra hoàn toàn và n2< n1< n3. Hai chất X, Y lần lượt là
Đáp án: C Phương pháp giải: Vì n1 > n2 nên 1 trong 2 chất X,Y tạo kết tủa với NaOH nhiều hơn NH3 → biện luận theo đáp án Lời giải chi tiết: Vì n1 > n2 nên 1 trong 2 chất X,Y tạo kết tủa với NaOH nhiều hơn NH3 A sai vì TN 1 tạo kết tủa Cu(OH)2 còn TN 2 chỉ tạo kết tủa Al(OH)3 → n1 = n2 D sai vì TN1 tạo kết tủa Cu(OH)2 còn TN 2 chỉ tạo kết tủa Al(OH)3 → n1 = n2 B có n1 = nCu(OH)2 = nCuCl2 và n2 = 0 → không thỏa mãn C có n1 = nCuCl2 + nFe(NO3)2 > n2 = nFe(NO3)2 và n3 = nAgCl + nAg = 2nCuCl2 + nFe(NO3)2 > n2 Đáp án C Câu hỏi 50 : Cho các phát biểu sau (1) Thành phần chính của supephotphat kép gồm hai muối Ca(H2PO4)2 và CaSO4 (2) Al là kim loại có tính lưỡng tính (3) Để xử lý thủy ngân rơi vãi, người ta có thể dùng bột lưu huỳnh (4) Khí thoát vào khí quyển, Freon phá hủy tầng ozon (5) Trong khí quyển, nồng độ NO2 và SO2 vượt quá tiêu chuẩn cho phép gây ra hiện tượng mưa axit (6) Đám cháy Mg có thể dập tắt bằng CO2 (7) Phèn chua được dùng để làm trong nước đục (8) Trong tự nhiên, các kim loại kiềm chỉ tồn tại dạng đơn chất Số phát biểu đúng là
Đáp án: B Phương pháp giải: Dựa vào kiến thức tổng hợp lí thuyết vô cơ Lời giải chi tiết: (1) sai vì thành phần chính của supephotphat kép là Ca(H2PO4)2 (2) sai vì không có khái niệm kim loại lưỡng tính (3) đúng vì S phản ứng với Hg ở đk thường tạo thành HgS là chất rắn an toàn (4) đúng (5) đúng vì hai chất này là nguyên nhân gây mưa axit (6) sai vì 2Mg + CO2 \(\xrightarrow{{{t^0}}}\) 2MgO + C làm phản ứng cháy tiếp tục (7) đúng, phèn chua có công thức là K2SO4.Al2(SO4)3.24H2O có ứng dụng làm trong nước (8) sai vì trong tự nhiên kim loại kiềm tồn tại dạng hợp chất => có 4 phát biểu đúng Đáp án B Quảng cáo
|














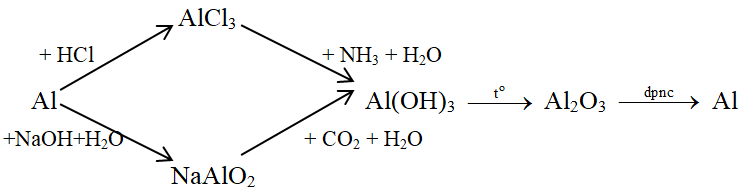
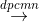 X2 + X3 ↑ + H2 (đpcmn: điện phân có màng ngăn)
X2 + X3 ↑ + H2 (đpcmn: điện phân có màng ngăn)