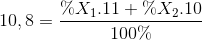20 bài tập vận dụng về đồng vị, nguyên tử khối trung bình có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Trong tự nhiên clo (Cl) có hai đồng vị là 35Cl và 37Cl. Biết % mỗi đồng vị lần lượt là 75% và 25%. Nguyên tử khối trung bình của clo là:
Đáp án: A Phương pháp giải: Dựa vào công thức tính nguyên tử khối trung bình. Lời giải chi tiết: \({M_{Cl}} = \frac{{\% {}^{35}Cl.35 + \% {}^{37}Cl.37}}{{100\% }} = \frac{{35.75\% + 37.25\% }}{{100\% }} = 35,5\) Đáp án A Câu hỏi 2 : Trong tự nhiên đồng (Cu) có hai đồng vị bền là 63Cu và 65Cu. Tỉ lệ phần trăm của đồng vị 65Cu trong hỗn hợp là: (biết nguyên tử khối trung bình của Cu là 63,546)
Đáp án: A Phương pháp giải: Áp dụng công thức số khối trung bình Lời giải chi tiết: Xét 1 mol Cu có x mol 65Cu và (1 – x) mol 63Cu => MCu = 65x + 63.(1 – x) = 63,546 => x = 27,3% =>A Câu hỏi 3 : Nguyên tử khối trung bình của Sb là 121,76. Sb có 2 đồng vị biết 121Sb chiếm 62% . Số khối của đồng vị thứ 2 là:
Đáp án: B Phương pháp giải: Áp dụng công thức tính số khối trung bình Lời giải chi tiết:
Câu hỏi 4 : Nguyên tố Bo có 2 đồng vị 10B ( x1 %) và 11B ( x2 %) nguyên tử khối trung bình của B là 10,8. x1 là
Đáp án: B Phương pháp giải: Áp dụng công thức tính số khối trung bình Lời giải chi tiết:
Câu hỏi 5 : Đồng có 2 đồng vị 63Cu và 65Cu, biết tỉ lệ số nguyên tử của chúng lần lượt là 105 : 245. Tính nguyên tử khối trung bình của Cu ? Phương pháp giải: Lời giải chi tiết:
Câu hỏi 6 : Bo có 2 đồng vị 10B và 11B. Nguyên tử khối trung bình của Bo là 10,812. Mỗi khi có 94 nguyên tử 10Bo thì sẽ có
Đáp án: C Phương pháp giải: Áp dụng công thức tính số khối trung bình Lời giải chi tiết:
Câu hỏi 7 : Trong tự nhiên nguyên tố clo có hai đồng vị 35Cl và 37Cl, nguyên tử khối trung bình của Cl là 35,48. Số nguyên tử đồng vị 35Cl có trong 200 nguyên tử clo là ?
Đáp án: D Phương pháp giải: Lời giải chi tiết:
Câu hỏi 8 : Khối lượng Nguyên tử trung bình của Brom là 79,91. Brom có 2 đồng vị trong đó đồng vị 79Br chiểm 54,5%. Số khối của đồng vị thứ 2 sẽ là
Đáp án: D Phương pháp giải: Áp dụng công thức tính NTK trung bình. Lời giải chi tiết: Gọi A2 là số khối của nguyên tử dồng vị thứ 2. Ta có: \(\begin{gathered} Đáp án D Câu hỏi 9 : Trong tự nhiên nguyên tố brom có 2 đồng vị, trong đó đồng vị
Đáp án: A Phương pháp giải: Phương pháp :Đặt số khối của đồng vị còn lại là x. Giải x theo phương trình về đồng vị Lời giải chi tiết:
Lời giải : Ta có nguyên tử khối trung bình của brom là
Đáp án A Câu hỏi 10 : Cabon trong tự nhiên là hỗn hợp của hai đồng vị 12C và 13C, trong đó đồng vị 12C chiếm 98,89%. Biết rằng đồng vị cacbon 13C có nguyên tử khối bằng 12,991. Nguyên tử khối trung bình của cacbon là
Đáp án: C Phương pháp giải: Dựa vào công thức tính nguyên tử khối trung bình: \(\overline A = \frac{{aX + bY}}{{100}}\) Trong đó: + X, Y là nguyên tử khối của các đồng vị + a, b là phần trăm số nguyên tử của đồng vị X, Y Lời giải chi tiết: \({\overline M _C} = \frac{{12.98,89 + 12,991.(100 - 98,89)}}{{100}} = 12,011\) Đáp án C Câu hỏi 11 : Trong tự nhiên brom có hai đồng vị là \({}_{35}^{79}{\text{Br}}\) và \({}_{35}^{81}{\text{Br}}\), nguyên tử khối trung bình của brom là 79,986. Nếu nguyên tử khối mỗi đồng vị có giá trị bằng số khối thì tỉ lệ % số nguyên tử đồng vị \({}_{35}^{79}{\text{Br}}\) là
Đáp án: B Phương pháp giải: Dựa vào công thức tính số khối trung bình. Lời giải chi tiết: Gọi phần trăm số nguyên tử của là x % và là y% Ta có hệ phương trình:
\(\left\{ \begin{gathered} Đáp án B Câu hỏi 12 : Nguyên tố Mg có 3 loại đồng vị có số khối lần lượt là: 24, 25 và 26. Trong 5000 nguyên tử Mg thì có 3930 đồng vị 24, 505 đồng vị 25, còn lại là đồng vị 26. Hãy tính khối lượng nguyên tử trung bình của Mg.
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D % Mg ( 24 ) = 3930 : 5000 . 100% = 78,6 % % Mg ( 25 ) = 505 : 5000 . 100% = 10,1 % % Mg ( 26 ) = 100 – 78,6 – 10,1 = 11,3 %
Câu hỏi 13 : Nguyên tố Bo có 2 đồng vị bền là 11B (x1 %) và 10B (x2 %), nguyên tử khối trung bình của Bo là 10,8. Giá trị của x1 % là:
Đáp án: A Phương pháp giải: Phương pháp : áp dụng công thức tính %X1 + %X2= 100 % Lời giải chi tiết:
Hướng dẫn Giải : %X1 + %X2= 100 % => %X1 = 80% ; %X2 = 20% Đáp án A Câu hỏi 14 : Trong tự nhiên Li có 2 đồng vị là 6Li và 7Li và có nguyên tử khối trung bình là 6,94. Phần trăm khối lượng 7Li trong LiNO3 là (cho N = 14; O = 16)
Đáp án: D Phương pháp giải: Dựa vào công thức tính số khối trung bình. Lời giải chi tiết: Gọi phần trăm số nguyên tử của 6Li là x % và 7Li là y% Ta có hệ phương trình:
\(\left\{ \begin{gathered} Trong 1 mol LiNO3 có chứa: 0,94 mol 7Li \(\% {m_{^7Li}} = \frac{{0,94.7}}{{6,94 + 14 + 16.3}}.100\% = 9,545\% \) Đáp án D Câu hỏi 15 : Trong tự nhiên oxi có 3 đồng vị là 16O, 17O, 18O; clo có 2 đồng vị là 35Cl, 37Cl và H có 3 đồng vị bền là 1H, 2H, 3H. Khẳng định nào sau đây không đúng?
Đáp án: A Phương pháp giải: Ghép các đồng vị của các nguyên tố để tạo thành các phân tử HClO, HCl, HClO3 và H2O. Từ đó tìm được khẳng định không đúng. Lời giải chi tiết: -Xét phân tử HClO: Phân tử khối của HClO nằm trong khoảng: 1+35+16 ≤ MHClO ≤ 3 + 37 + 18 → 52 ≤ MHClO ≤ 58 Vậy có 7 giá trị phân tử khối của HClO là 52; 53; 54; 55; 56; 57; 58. Vậy khẳng định A không đúng. -Xét phân tử HCl: H có 3 cách chọn, Cl có 2 cách chọn. Vậy có 6 phân tử dạng HCl. Vậy khẳng định B đúng. - Xét phân tử HClO3: H có 3 cách chọn, Cl có 2 cách chọn, OOO có 10 cách chọn. Vậy có 60 phân tử dạng HClO3. Vậy khẳng định C đúng. - Xét phân tử H2O: Phân tử khối của H2O nằm trong khoảng: 1+1+16 ≤ MH2O ≤ 3 + 3 + 18 → 18 ≤ MH2O ≤ 24 Vậy MH2O max= 24. Vậy khẳng định D đúng. Đáp án A Câu hỏi 16 : Trong tự nhiên magie có 3 đồng vị bền 24Mg chiếm 78,99%, 25Mg chiếm 10,00% và 26Mg. Nguyên tử khối trung bình của Mg là:
Đáp án: C Phương pháp giải: Áp dụng công thức tính nguyên tử khối trung bình của Mg. Lời giải chi tiết: %số nguyên tử 26Mg là 100%- 78,99%- 10,00%= 11,01% Nguyên tử khối trung bình của Mg bằng: \(\overline {{A_{Mg}}} = {{24.78,99 + 25.10,00 + 26.11,01} \over {100}} = 24,32\) Đáp án C Câu hỏi 17 : Một nguyên tố X gồm 2 đồng vị X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng phần trăm các đồng vị trong X bằng nhau và các loại hạt trong X1 cũng bằng nhau. Nguyên tử khối trung bình của X là:
Đáp án: C Phương pháp giải: Dựa vào định nghĩa đồng vị, công thức tính số khối và công thức tính nguyên tử khối trung bình để tính nguyên tử khối trung bình của X. Lời giải chi tiết: Gọi số hạt proton trong đồng vị X1 là Z, số notron trong đồng vị X1 là N. Tổng số hạt trong đồng vị X1 là 2Z + N= 18 (1) Các loại hạt trong X1 bằng nhau nên Z= N (2) Giải hệ (1) và (2) ta có Z= N= 6 Số khối của đồng vị X1 là A1= Z+N= 12 Số khối của đồng vị X2 là A2= 6 + 6+2= 14 Biết rằng phần trăm các đồng vị trong X bằng nhau . Do đó nguyên tử khối trung bình của X là: (12+14)/2= 13 Đáp án C Câu hỏi 18 : Nguyên tố clo có nguyên tử khối trung bình là 35,5. Biết clo có 2 đồng vị là X và Y, tổng số khối của X và Y là 72. Số nguyên tử đồng vị X bằng 3 lần số nguyên tử đồng vị Y. Vậy số nơtron của đồng vị Y nhiều hơn số nơtron của đồng vị X là:
Đáp án: C Phương pháp giải: Từ % số đồng vị X và Y kết hợp với công thức tính nguyên tử khối trung bình của clo để tính số khối của đồng vị X và đồng vị Y. Từ đó tính được số nơtron của đồng vị Y nhiều hơn số nơtron của đồng vị X bằng số khối của đồng vị Y – số khối của đồng vị X. Lời giải chi tiết: Gọi số khối của đồng vị X là X, số khối của đồng vị Y là Y. Gọi % số nguyên tử của đồng vị Y là a% thì % số nguyên tử của đồng vị X là 3a% Nguyên tử khối trung bình của nguyên tố clo là: \({A_{Cl}} = \frac{{X.3a + Y.a}}{{3a + a}}.100 = 35,5\) → 3X + Y = 35,5.4 = 142 Theo đề bài X + Y = 72 Giải hệ trên ta có X= 35 và Y = 37 Số khối của đồng vị X bằng X = Z + NX = 35 Số khối của đồng vị Y bằng Y = Z + NY= 37 Suy ra NY – NX= 37 – 35 = 2 Đáp án C Câu hỏi 19 : Nguyên tố X có 2 đồng vị là A và B. Đồng vị A có tổng số hạt cơ bản là 54, trong đó số hạt không mang điện nhiều hơn số hạt mang điện âm là 3 hạt. Tổng số hạt cơ bản trong đồng vị B ít hơn trong A là 2 hạt. a) Tính số khối của mỗi đồng vị. b) Tìm nguyên tử khối trung bình của X. Biết tỉ lệ số nguyên tử của đồng vị A và B là 1 : 3. c) Tính thành phần phần trăm theo khối lượng của đồng vị A có trong CaX2 biết Ca = 40. Phương pháp giải: a) Trong đồng vị A: + Tổng hạt là p + e + n = 2p + n + Số hạt không mang điện (n) nhiều hơn hạt mang điện âm (e) là n - e = n - p Lập hệ phương trình giải tìm được p, n → Số khối của mỗi đồng vị. b) Nếu đồng vị A1 có n1 nguyên tử và đồng vị A2 có n2 nguyên tử thì NTK trung bình được tính bằng công thức: \(\bar A = \frac{{{n_1}.{A_1} + {n_2}.{A_2}}}{{{n_1} + {n_2}}}\) c) Giả sử xét 1 mol CaCl2 → số mol Cl → Số mol 37Cl → Khối lượng 37Cl → Phần trăm khối lượng của 37Cl trong CaCl2 Lời giải chi tiết: a) Trong đồng vị A: + Tổng hạt p + e + n = 2p + n = 54 (1) + Số hạt không mang điện (n) nhiều hơn hạt mang điện âm (e) là n - e = n - p = 3 (2) Giải hệ (1) và (2) được p = 17 và n = 20 → Số khối của A = p + n = 17 + 20 = 37 → Số khối của B = 37 - 2 = 35 (do đồng vị B có tổng hạt nhỏ hơn đồng vị A là 2 hạt) b) Nguyên tử khối trung bình của X là AX = \(\frac{{37.1 + 35.3}}{{1 + 3}}\) = 35,5 c) Giả sử xét 1 mol CaCl2 → nCl = 2 mol → Số mol 37Cl = 25%.2 = 0,5 mol → Khối lượng 37Cl = 18,5 gam → Phần trăm khối lượng của 37Cl trong CaCl2 là: \(\frac{{18,5}}{{111}}.100\% \) = 16,67% Câu hỏi 20 : Bo có hai đồng vị, mỗi đồng vị đều có 5 proton. Đồng vị thứ nhất có số proton bằng số notron. Đồng vị thứ 2 có số notron bằng 1,2 lần số proton. Biết nguyên tử khối trung bình của Bo là 10,812. Khi đồng vị 1 có 94 nguyên tử thì số nguyên tử của đồng vị 2 là:
Đáp án: B Phương pháp giải: Dựa vào nguyên tử khối trung bình của Bo tìm được phần trăm mỗi đồng vị của Bo Tìm số nguyên tử đồng vị thứ hai khi biết số nguyên tử đồng vị thứ nhất theo công thức: \(so\,ngtu\,2\,dvi2 = so\,nguyen\,tu\,dvi1 \times {{\% dvi\,2} \over {\% dvi\,1}}\) Lời giải chi tiết: Số notron của đồng vị thứ nhất là: n1 = p = 5 (hạt) → số khối A1 = p + n1 = 10 Số notron của đồng vị thứ hai là: n2 = 1,2p = 1,2×5 = 6 (hạt) → số khối A2 = p + n2 = 11 Đặt phần trăm số đồng vị thứ nhất là x% Phần trăm số đồng vị thứ hai là (100 - x)% Theo bài ta có: \(\eqalign{ → Phần trăm đồng vị Bo thứ nhất là 18,8% ; phần trăm đồng vị Bo thứ hai là (100-18,8)=81,2% Khi đồng vị 1 có 94 nguyên tử thì đồng vị 2 có số nguyên tử là: \(94 \times {{81,2\% } \over {18,8\% }} = 406\) (nguyên tử) Đáp án B Quảng cáo
|














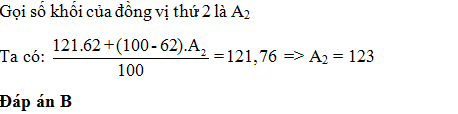
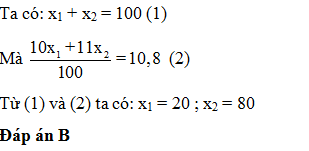

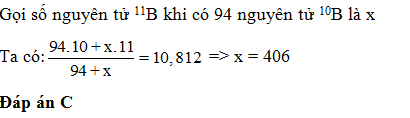
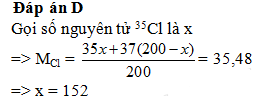
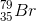 chiếm 54,5% về khối lượng biết nguyên tử khối trung bình của brom là 79,91. Số khối của đồng vị còn lại là:
chiếm 54,5% về khối lượng biết nguyên tử khối trung bình của brom là 79,91. Số khối của đồng vị còn lại là: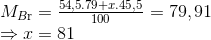
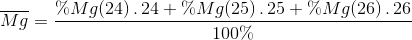 =
= 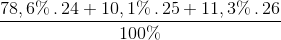 = 24,327
= 24,327