20 bài tập vận dụng về cấu hình electron có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Nguyên tử nguyên tố X có tổng số hạt cơ bản là 34 hạt, số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Số electron lớp ngoài cùng của X là
Đáp án: A Phương pháp giải: Trong nguyên tử có 3 loại hạt cơ bản là: p, n, e Trong đó: + Số p = số e = Z (mang điện) + Số n = N (không mang điện) Lời giải chi tiết: Đặt số p = số e = Z; số n = N - Tổng số hạt cơ bản p, n, e là 34 hạt → 2Z + N = 34 (1) - Số hạt mang điện (p, e) nhiều hơn số hạt không mang điện (n) là 10 hạt → 2Z - N = 10 (2) Giải (1) và (2) ⟹ Z = 11, N = 12 → Cấu hình e của X: 1s22s22p63s1 → Số e lớp ngoài cùng là 1 Đáp án A Câu hỏi 2 : Nguyên tử nguyên tố Y có số khối là 16. Trong hạt nhân của Y, số hạt mang điện bằng số hạt không mang điện. Cấu hình electron của Y là
Đáp án: A Phương pháp giải: - Số khối: A = Z + N - Hạt nhân chứa p (mang điện) và n (không mang điện) Lời giải chi tiết: - Nguyên tử nguyên tố Y có số khối là 16 → Z + N = 16 (1) - Trong hạt nhân của Y, số hạt mang điện bằng số hạt không mang điện → Z = N (2) Giải (1) và (2) ⟹ Z = N = 8 → Cấu hình e của Y: 1s22s22p4 Đáp án A Câu hỏi 3 : Tổng số hạt trong nguyên tử của nguyên tố X là 40. Nguyên tử X có 3 electron ở lớp ngoài cùng. Số hiệu nguyên tử của X là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Tổng số hạt : p + n + e = 40 => 2p + n = 40 Lại có : p ≤ n ≤ 1,5p => p ≤ (40 – 2p) ≤ 1,5p => 11,4 ≤ p ≤ 13,3 => p = 12 hoặc p = 13 +) Nếu p = 12 => Cấu hình e : 1s22s22p63s2 +) Nếu p = 13 => Cấu hình e : 1s22s22p63s23p1 X có 3 electron ở lớp ngoài cùng => p = 13 Câu hỏi 4 : Tổng số hạt p, n, e trong nguyên tử nguyên tố A là 22. Vậy cấu hình electron của A là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Tổng số hạt : p + n + e = 22 => 2p + n = 22 Lại có : p ≤ n ≤ 1,5p => p ≤ (22 – 2p) ≤ 1,5p => 6,2 ≤ p ≤ 7,3 => p = 7 = e => Cấu hình e : 1s22s22p3 Câu hỏi 5 : Một nguyên tử có kí hiệu là \({}_{21}^{45}X\) ,cấu hình electron của nguyên tử X là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: 1s2 2s2 2p6 3s2 3p6 3d1 4s2. Câu hỏi 6 : Cation R+ có cấu hình e lớp ngoài cùng là 3p6. Cấu hình electron đầy đủ của R là
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D R+ có cấu hình e lớp ngoài cùng là 3p6 => R có : 4s1 Cấu hình e đầy đủ : 1s22s22p63s23p64s1 Câu hỏi 7 : Cho số điện tích hạt nhân của nguyên tử là: X (Z = 6); Y (Z = 7); M (Z = 13); T (Z= 18); Q (Z = 19). Số nguyên tố có tính kim loại là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C X (Z = 6) : 1s22s22p2 Y (Z = 7) : 1s22s22p3 M (Z = 13) : 1s22s22p63s23p1 T (Z = 18) : 1s22s22p63s23p6 Q (Z = 19) : 1s22s22p63s23p64s1 Kim loại khi tổng số e lớp ngoài cùng ≤ 3 => Chỉ có M và Q Câu hỏi 8 : Cho số hiệu nguyên tử của các nguyên tố O, K, Ca, Fe lần lượt là 8, 19, 20, 26. Cấu hình electron của ion nào sau đây không giống cấu hình của khí hiếm:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C O (Z = 8) : 1s22s22p4 K (Z = 19) : 1s22s22p63s23p64s1 Ca (Z = 20) : 1s22s22p63s23p64s2 Fe (Z = 26) : 1s22s22p63s23p63d64s2 Câu hỏi 9 : Phân lớp có mức năng lượng cao nhất của ion X2+ là 3d, chứa 6e. Cấu hình electron của X là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: X có cấu hình e là 1s22s22p63s23p63d64s2 Đáp án A Câu hỏi 10 : Nguyên tử của nguyên tố X có e cuối cùng điền vào phân lớp 3p1. Nguyên tử nguyên tố Y có e cuối cùng điền vào phân lớp 3p3. Số proton của X,Y lần lượt là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A X : 1s22s22p63s23p1 : có 13 electron Y : 1s22s22p63s23p3 : có 15 electron Câu hỏi 11 : Nguyên tử X có tổng số hạt p, n, e là 52 và số khối là 35. Cấu hình electron của X là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Z = số E và A = số P + số N = Số E + số N => Z = 17 : 1s22s22p63s23p5 Câu hỏi 12 : Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np5. Trong hợp chất khí của nguyên tố X với hidro, X chiếm 98,765% khối lượng. Nguyên tố X tạo với kim loại M hợp chất có công thức MX2, trong đó M chiếm 28,89% về khối lượng. Tìm tên kim loại M. (cho biết: Cu = 64 ; Mg = 24 ; Zn = 65 ; Fe = 56)
Đáp án: C Phương pháp giải: X có cấu hình electron lớp ngoài cùng là ns2np5 => Trong hợp chất oxit cao nhất X có hóa trị VII => Trong hợp chất khí với H, X có hóa trị I => Công thức hóa học của hợp chất khí với H: HX Trong HX, phần trăm khối lượng của X: \(\% {m_X} = \frac{{{M_X}}}{{1 + {M_X}}}.100\% = 98,765\% \to {M_X} = ?\) Trong MX2: \(\% {m_M} = \frac{{{M_M}}}{{{M_M} + 2.{M_X}}}.100\% = 28,89\% \to {M_M} = ?\) Lời giải chi tiết: X có cấu hình electron lớp ngoài cùng là ns2np5 => Trong hợp chất oxit cao nhất X có hóa trị VII => Trong hợp chất khí với H, X có hóa trị I => Công thức hóa học của hợp chất khí với H: HX Trong HX, phần trăm khối lượng của X: \(\% {m_X} = \frac{{{M_X}}}{{1 + {M_X}}}.100\% = 98,765\% \to {M_X} = 80\) => X là Br Trong MBr2: \(\% {m_M} = \frac{{{M_M}}}{{{M_M} + 2.80}}.100\% = 28,89\% \to {M_M} = 65\) => M là Zn Đáp án C Câu hỏi 13 : Cho các nguyên tố có số hiệu nguyên tử lần lượt là Y (Z=3) ; Z(Z=7) ; E(Z=12);T(Z=18); R(Z=19). Dãy gồm các nguyên tố kim loại là?
Đáp án: D Phương pháp giải: Viết cấu hình e của các nguyên tử ra, các nguyên tử có số e lớp ngoài cùng là 1,2,3 e → đó là nguyên tố kim loại. Lời giải chi tiết: Cấu hình e của các nguyên tố: Y (Z=3): 1s22s1→ có 1e lớp ngoài cùng Z (Z = 7): 1s22s22p3→ có 5e lớp ngoài cùng E (Z=12): 1s22s22p63s2 → có 2e lớp ngoài cùng T (Z=18): 1s22s22p63s23p6 → có 8e lớp ngoài cùng R (Z = 19): 1s22s22p63s23p64s1→ có 1e lớp ngoài cùng → 3 nguyên tử Y, E, R có 1-3 electron lớp ngoài cùng nên là nguyên tố kim loại Đáp án D Câu hỏi 14 : Nguyên tử X có tổng số hạt là 40, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. Khẳng định nào sau đây là đúng?
Đáp án: B Phương pháp giải: Gọi số hạt trong X là: p, n, e. Ta có hệ phương trình \(\left\{ \matrix{ Có số p → Viết được cấu hình e của X. Từ đó suy ra các kết luận nào đúng, sai Lời giải chi tiết: Gọi số hạt trong X là: p, n, e. Ta có hệ phương trình \(\left\{ \matrix{ X (Z = 13): 1s22s22p63s23p1 Điện tích hạt nhân của X: +13.1,602.10-19 = .+ 2,0826.10-18 C → B đúng X là kim loại do có 3e ở lớp ngoài cùng → A sai X là nguyên tố p do electron cuối cùng điền vào phân lớp p, X có 7 electron p → C,D sai Đáp án B Câu hỏi 15 : Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8. Cấu hình electron lớp ngoài cùng của Y là
Đáp án: A Phương pháp giải: X có 7 electron p → viết được cấu hình e của X → pX = ? Dựa vào dữ kiện bài toán suy ra pY = ?. Từ đó viết được cấu hình e của Y Lời giải chi tiết: X có 7 electron p → X: 1s22s22p63s23p1 → X có số p = 13 Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8 nên: 2py = 13.2 + 8 → py = 17 → Y: 1s22s22p63s23p5 Đáp án A Câu hỏi 16 : Tổng các hạt trong nguyên tử Y là 13. Số hạt mang điện dương ít hơn số hạt không mang điện là 1. Nhận xét nào sau đây không đúng?
Đáp án: A Phương pháp giải: Giải hệ phương trình với dữ kiện đề bài cho, tìm được số p, n, e của Y Từ đó viết được cấu hình của Y và nhận xét được nhận định đúng, sai Lời giải chi tiết: Gọi số hạt trong Y là: p, n, e. Có \(\left\{ \matrix{ → Cấu hình Y: 1s22s2. Y có số p, n, e lần lượt là: 4, 5, 4. → B đúng Y là kim loại vì có 2e lớp ngoài cùng → C đúng, A sai Điện tích hạt nhân của Y: +4.1,602.10-19 = +6,408.10-19C → D đúng Đáp án A Câu hỏi 17 : Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Tính chất của nguyên tố X, Y lần lượt là
Đáp án: B Phương pháp giải: Viết các cấu hình electron, dựa vào số electron lớp ngoài cùng để kiểm tra tính kim loại, phi kim. Lời giải chi tiết: X: 1s22s22p63s23px (x ε [1, 6]) Y: Y có 1 electron lớp ngoài cùng → electron này phải thuộc phân lớp s; Y cũng có electron thuộc 3p => Y có nhiều electron hơn X 2 electron => EY = 19 và EX = 17 => ZY = 19 và ZX = 17 X: 1s22s22p63s23p5 (có 7e lớp ngoài cùng → phi kim); Y: 1s22s22p63s23p64s1 (có 1e lớp ngoài cùng → kim loại) Đáp án B Câu hỏi 18 : Một ion M3+ có tổng số hạt proton, notron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Viết cấu hình electron của nguyên tử M?
Đáp án: B Phương pháp giải: Ta có: M → M3+ + 3e Lập 2 phương trình về mối quan hệ giữa các hạt trong ion M3+ để tìm số e của nguyên tử M, từ đó viết được cấu hình e của nguyên tử M. Lời giải chi tiết: Một ion M3+ có tổng số hạt proton, notron và electron là 79 → 2Z + N – 3 = 79 Số hạt mang điện nhiều hơn số hạt không mang điện là 19 → 2Z – 3- N= 19 Giải hệ trên ta có Z= 26 và N = 30 Với Z= 26 ta có cấu hình electron nguyên tử là 1s22s22p63s23p63d64s2 hay [Ar]3d64s2 Đáp án B Câu hỏi 19 : Nguyên tử nguyên tố T có cấu hình electron lớp ngoài cùng là 4s2. Số lượng nguyên tố T là
Đáp án: D Phương pháp giải: Cấu hình e của T có dạng: 1s22s22p63s23p63dx4s2 Xác định các giá trị có thể có của x (lưu ý hiện tượng nhảy e để đạt cấu hình bán bão hòa và cấu hình bão hòa) Lời giải chi tiết: Cấu hình e của T có dạng: 1s22s22p63s23p63dx4s2 Các giá trị có thể có của x là: x = 0 ; 1 ; 2 ; 3 ; 5 ; 6 ; 7 ; 8 ; 10 (x không thể nhận giá trị 4 và 9 vì có hiện tượng nhảy e để đạt cấu hình bán bão hòa và cấu hình bão hòa) Đáp án D Câu hỏi 20 : Trong ion R+, tổng số hạt cơ bản là 57 hạt. Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 17 hạt. Số electron độc thân của R là
Đáp án: A Phương pháp giải: Trong R có: số p = số e = Z; số n = N ⟹ Trong R+ có: số p = Z; số e = Z - 1; số n = N - Dựa vào dữ kiện lập hệ 2 phương trình. Giải tìm được Z, N - Viết cấu hình e nguyên tử - Xác định số e độc thân Lời giải chi tiết: Trong R có: số p = số e = Z; số n = N ⟹ Trong R+ có: số p = Z; số e = Z - 1; số n = N +) Tổng hạt trong ion R+ là 57 ⟹ (2Z - 1) + N = 57 ⇔ 2Z + N = 58 (1) +) Số hạt mang điện (p, e) nhiều hơn số hạt không mang điện là 17 ⟹ (2Z - 1) - N = 17 ⇔ 2Z - N = 18 (2) Giải (1) (2) được Z = 19 và N = 29 ⟹ Cấu hình e: 1s22s22p63s23p64s1 ⟹ Chỉ có duy nhất phân lớp 4s chưa bão hòa nên số e độc thân là 1. Đáp án A Quảng cáo
|














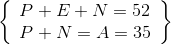 => số E = 17
=> số E = 17 





