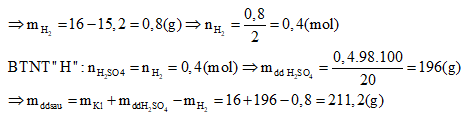10 câu hỏi vận dụng cao về axit sunfuric và muối sunfat có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Chia 2,29 gam hỗn hợp X gồm 3 kim loại Zn, Mg, Al thành 2 phần bằng nhau. Phần 1 hoà tan hoàn toàn trong dung dịch H2SO4 loãng giải phóng 1,456 lít H2(đktc). Phần 2 oxi hoá hoàn toàn bằng oxi dư, thu được tối đa m gam hỗn hợp 3 oxit. Giá trị của m là
Đáp án: C Phương pháp giải: - Nhận xét: + moxit = mKL + mO + 3 kim loại đều có hóa trị không đổi trong các hợp chất → áp dụng BT e tìm được số mol O trong oxit → tìm m Lời giải chi tiết: Có: m1 = m2 = 1,145 (g) * Phần 1:
BT e: 2x + 2y + 3z = 4k (II) Từ (I) và (II) → 4k = 0,13 → nO(oxit) = 2k = 0,065 (mol) → moxit = mKL + mO = 1,145 + 0,65.16 = 2,185 (g) Đáp án C Câu hỏi 2 : Hoà tan hoàn toàn 16 gam hỗn hợp Mg và Fe bằng dung dịch H2SO4 loãng 20% (vừa đủ). Sau phản ứng thấy khối lượng dung dịch tăng thêm 15,2 gam. Nồng độ % của MgSO4 có trong dung dịch sau phản ứng là
Đáp án: B Phương pháp giải: Nhận xét: mdd tăng = mKL – mH2 → tìm được m và n của H2 Giải hệ phương trình với ẩn là số mol của Mg và Fe ta được số mol từng kim loại → tìm số mol MgSO4 - Tính số mol H2SO4 → mdd ban đầu → mdd sau → C% Lời giải chi tiết: mdd tăng = mKL – mH2
Đặt nMg = x và nFe = y, ta có: \(\left\{ \begin{array}{l}{m_{hh}} = 24x + 56y = 16\\x + y = {n_{{H_2}}} = 0,4\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,2 = {n_{MgS{O_4}}}\\y = 0,2\end{array} \right.\) \(C{\% _{MgS{O_4}}} = \frac{{{m_{MgS{O_4}}}}}{{{m_{dd\,sau}}}}.100\% = \frac{{0,2.120}}{{211,2}}.100\% = 11,36\% \) Đáp án B Câu hỏi 3 : Đốt cháy hoàn toàn 4,04 gam một hỗn hợp bột kim loại gồm Al, Fe, Cu trong không khí thu được 5,96 gam hỗn hợp 3 oxit. Hòa tan hết hỗn hợp 3 oxit bằng dung dịch H2SO4 1M. Tính thể tích dung dịch H2SO4 cần dùng.
Đáp án: C Phương pháp giải: Nhận xét: \({n_{O(oxit)}} = {\rm{ }}{n_{{H_2}O}} = {n_{{H_2}S{O_4}}}\) - Áp dụng bảo toàn khối lượng cho phản ứng cháy tìm được số mol O trong oxit → tìm số mol O → số mol H2SO4 Lời giải chi tiết: PTTQ: KL + O2 → Oxit - Áp dụng BTKL cho phản ứng cháy: \(\begin{array}{l}{m_{KL}} + {m_{{O_2}}} = {m_{oxit}} \Rightarrow {m_{{O_2}}} = 5,96 - 4,04 = 1,92(g)\\ \Rightarrow {n_{O(oxit)}} = 2{n_{{O_2}}} = 2.\frac{{1,92}}{{32}} = 0,12(mol) = {n_{{H_2}S{O_4}}}\end{array}\) Đặt công thức chung của các oxi là M2On M2On + nH2SO4 → M2(SO4)n + nH2O Theo PTHH ta thấy: nH2SO4 = nO(oxit) = 0,12 (mol) \( \to {V_{{H_2}S{O_4}}} = \frac{{{n_{{H_2}S{O_4}}}}}{{{V_{{H_2}S{O_4}}}}} = \frac{{0,12}}{1} = 0,12(l)\) Đáp án C Câu hỏi 4 : Cho hỗn hợp A gồm Al, Zn, Mg. Đem oxi hoá hoàn toàn 28,6 gam A bằng oxi dư thu được 44,6 gam hỗn hợp oxit B. Hoà tan hết B trong dung dịch H2SO4 thu được dung dịch D. Cô cạn dung dịch D được hỗn hợp muối khan là
Đáp án: A Phương pháp giải: Nhận xét: \({n_{O(oxit)}} = {\rm{ }}{n_{{H_2}O}} = {n_{{H_2}S{O_4}}}\) - Áp dụng bảo toàn khối lượng cho phản ứng cháy tìm được số mol O trong oxit → tìm số mol O → số mol H2SO4 - Áp dụng BTKL cho phản ứng của oxit với H2SO4 tìm được mmuối Lời giải chi tiết: PTTQ: KL + O2 → Oxit - Áp dụng BTKL cho phản ứng cháy: \(\begin{array}{l}{m_{KL}} + {m_{{O_2}}} = {m_{oxit}} \Rightarrow {m_{{O_2}}} = 44,6 - 28,6 = 16(g)\\ \Rightarrow {n_{O(oxit)}} = 2{n_{{O_2}}} = 2.\frac{{16}}{{32}} = 1(mol) = {n_{{H_2}S{O_4}}} = {n_{{H_2}O}}\end{array}\) Đặt công thức chung của các oxi là M2On M2On + nH2SO4 → M2(SO4)n + nH2O - Áp dụng BTKL cho phản ứng của oxit với H2SO4 moxit + maxit = mmuối + mnước → 44,6 + 1.98 = mmuối + 1.18 → mmuối = 124,6(g) Đáp án A Câu hỏi 5 : Cho 17,6g hỗn hợp gồm Fe và kim loại R vào dung dịch H2SO4 loãng dư. Sau phản ứng thu được 4,48lit khí (đktc). Phần không tan cho vào dung dịch H2SO4 đặc, nóng thì thoát ra 2,24 lít khí (đktc). R là kim loại nào sau đây?
Đáp án: D Phương pháp giải: - Do H2SO4 dư nên phần không tan là R. - Fe tác dụng với H2SO4 loãng sinh ra H2, từ số mol khí tìm được số mol và khối lượng của Fe → tìm được khối lượng của R. - Gọi hóa trị của R là n, áp dụng bảo toàn e, tìm mối quan hệ giữa MR và n. Biện luận giá trị của n để tìm M Lời giải chi tiết: Fe + H2SO4 → FeSO4 + H2 (mol) 0,2 ← 0,2 → mR = 17,6 – 56.0,2 = 6,4 (gam) Gọi hóa trị của R là n, ta có : R0 → R+n + ne S+6 + 2e → S+4 (mol) x → nx (mol) 0,2 ← 0,1 BT e : nx = 0,2 \( \Rightarrow n.\frac{{6,4}}{{{M_R}}} = 0,2\)→ MR = 34n Chạy giá trị n = 1,2,3 ta thấy tại n = 2 thì MR = 64 (Cu) thỏa mãn Đáp án D Câu hỏi 6 : Hòa tan hoàn toàn 17,4 gam hỗn hợp kim loại X gồm Mg, Al, Cu bằng dung dịch H2SO4 đặc nóng thu được dung dịch Y và thoát ra 12,32 lít khí SO2(đktc), sản phẩm khử duy nhất. Cô cạn cẩn thận dung dịch Y thu được m gam muối sunfat khan. Giá trị của m là
Đáp án: B Phương pháp giải: Cách 1 : - Coi hỗn hợp ban đầu chỉ gồm 2 kim loại bất kì trong ba kim loại trên - Lập hệ phương trình là số mol của hai kim loại → tìm được khối lượng muối Cách 2 : CT nhanh : nSO42- (muối) = nSO2 = ? (mol) → mmuối = mKL + mSO4 = ? Lời giải chi tiết: Cách 1 : Giả sử hỗn hợp ban đầu gồm Mg và Cu, gọi nMg = x ; nCu = y Ta có : \(\left\{ \begin{array}{l}mhh = mMg + m24x + 64y = 17,4\\BT{\rm{ }}e:2x + 2y = 0,55.2\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,445\\y = 0,105\end{array} \right.\) Muối gồm: MgSO4: 0,445 mol và CuSO4: 0,105 mol → m = mMgSO4 + mCuSO4 = 0,445.120 + 0,105.160 = 70,2 (gam) Cách 2: CT nhanh : nSO42- (muối) = nSO2 = 0,55 (mol) → mmuối = mKL + mSO4 = 17,4 + 0,55.96 = 70,2 (g) Đáp án B Câu hỏi 7 : Cho 33,2g hỗn hợp X gồm Cu, Mg, Al tác dụng vừa đủ với dung dịch HCl thu được 22,4 lít khí ở đktc và chất rắn không tan B. Cho B hoà tan hoàn toàn vào dung dịch H2SO4 đặc, nóng dư thu được 4,48 lít khí SO2(đktc). Khối lượng mỗi kim loại trong hỗn hợp X lần lượt là:
Đáp án: C Phương pháp giải: - Cu không tác dụng với HCl nên B là Cu - Lập hệ phương trình 3 ẩn là số mol của 3 kim loại Lời giải chi tiết: Vì Cu không tác dụng với HCl nên B là Cu Mg + 2HCl → MgCl2 + H2 (mol) x → x 2Al + 6HCl → 2AlCl3 + 3H2 (mol) y → 1,5y Cu + 2H2SO4 → CuSO4 + SO2 + H2O (mol) z → z \(\left\{ \begin{array}{l}24x + 27y + 64z = 33,2\\{n_{{H_2}}} = x + 1,5y = 1\\{n_{S{O_2}}} = z = 0,2\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,4\\y = 0,4\\z = 0,2\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{m_{Cu}} = 12,8\,(g)\\{m_{Mg}} = 9,6\,(g)\\{m_{Al}} = 10,8\,(g)\end{array} \right.\) Đáp án C Câu hỏi 8 : Đem nung hỗn hợp G, gồm hai kim loại: x mol Fe và 0,15 mol Cu, trong không khí một thời gian, thu được 63,2 gam hỗn hợp H, gồm hai kim loại trên và hỗn hợp các oxit của chúng. Đem hòa tan hết lượng hỗn hợp H trên bằng dung dịch H2SO4 đậm đặc thu được 0,3 mol SO2. Trị số của x là
Đáp án: D Phương pháp giải: - Tổng quát: \(G\left\{ \begin{gathered} - Xét cả quá trình ta thấy chỉ có Fe, Cu, O2 và S+6 thay đổi số oxi hóa - Áp dụng bảo toàn e và lập hệ phương trình với ẩn là số mol của Fe và O2. Lời giải chi tiết: Sơ đồ tổng quát \(G\left\{ \begin{gathered} Đặt: \({n_{{O_2}}} = y\) Áp dụng BTKL cho quá trình 1: \({m_{KL}} + {m_{{O_2}}} = {m_H} \Rightarrow 56x + 64.0,15 + 32y = 63,2 \Rightarrow 56x + 32y = 53,6{\rm{ (*)}}\) Fe0 → Fe+3 + 3e S+6 + 2e → S+4 (mol) x → 3x (mol) 0,6 ← 0,3 Cu0 → Cu+2 + 2e O2 + 4e → 2O-2 (mol) 0,15 → 0,3 (mol) y → 4y BT e: 3x + 0,3 = 0,6 + 4y (**) Giải (*) và (**) ta được: x = 0,7; y = 0,45 Đáp án D Câu hỏi 9 : Nung 20 gam hỗn hợp X gồm Mg, Al, MgO, Mg(OH)2, Al2O3, Al(OH)3 trong điều kiện không có không khí đến khi phản ứng xảy xa hoàn toàn thu được 16,04 gam chất rắn (biết chỉ xảy ra phản ứng nhiệt phân hiđroxit kim loại). Mặt khác cho 20 gam hỗn hợp X trên tác dụng vừa đủ với 470 ml dung dịch H2SO4 1M (loãng) thu được dung dịch Y và 1,344 lít khí H2 (đktc). Cô cạn dung dịch Y được m gam muối khan. Giá trị của m là
Đáp án: D Phương pháp giải: - Bảo toàn nguyên tố, bảo toàn khối lượng - Quy đổi Lời giải chi tiết: - Xét phản ứng nung X: X \(\xrightarrow{{{t^o}}}\) Y + H2O BTKL: mH2O = mX - mY = 20 - 16,04 = 3,96 gam => nH2O = 3,96 : 18 = 0,22 mol BTNT "H": nOH = 2nH2O = 0,44 mol - Xét phản ứng cho X tác dụng với H2SO4: nH2SO4 = 0,47 mol; nH2 = 1,344 : 22,4 = 0,06 mol Quy đổi hỗn hợp X thành KL, O, OH Sơ đồ phản ứng: \(X\left\{ \begin{gathered} BTNT "H": nOH + 2nH2SO4 = 2nH2 + 2nH2O => 0,44 + 2.0,47 = 2.0,06 + 2nH2O => nH2O = 0,63 mol BTNT "O": nO + nOH + 4nH2SO4 = 4nSO4(muối) + nH2O => nO + 0,44 + 4.0,47 = 4.0,47 + 0,63 => nO = 0,19 mol Mặt khác: mX = mKL + mO + mOH => nKL = mX - mO - mOH = 20 - 0,19.16 - 0,44.17 = 9,48 gam Muối được tạo bởi KL và gốc SO4 nên ta có: m muối = mKL + mSO4 = 9,48 + 0,47.96 = 54,6 gam Đáp án D Câu hỏi 10 : X là hỗn hợp rắn gồm Mg, NaNO3 và FeO (trong đó oxi chiếm 26,4% về khối lượng). Hòa tan hết m gam X trong 2107 gam dung dịch H2SO4 loãng, nồng độ 10% thu được dung dịch Y chỉ chứa muối sunfat trung hòa và 11,2 lít (đktc) hỗn hợp NO, H2 có tỉ khối so với H2 là 6,6. Cô cạn dung dịch sau phản ứng được rắn khan Z và 1922,4 gam H2O. Phần trăm khối lượng FeO trong X gần nhất với giá trị nào nhất dưới đây?
Đáp án: C Phương pháp giải: Lời giải chi tiết: Ta tính được: nH2SO4 = 2,15 mol Khi cô cạn dung dịch sau phản ứng thu được 1922,4 gam H2O gồm 1896,3 gam H2O trong dung dịch H2SO4 ban đầu. Suy ra mH2O sinh ra = 1922,4 - 1896,3 = 26,1 (gam) → nH2O sinh ra = 1,45 mol - Ta có 11,2 lít (đktc) hỗn hợp NO (x mol), H2(y mol) có tỉ khối so với H2 là 6,6 + nhỗn hợp = x + y = 11,2 : 22,4 = 0,5 mol + mhỗn hợp = mNO + mH2 = 30x + 2y = 6,6.2.0,5 = 6,6 (g) Giải hệ trên ta được x = 0,2 và y = 0,3 - Sơ đồ phản ứng: Do phản ứng sinh ra H2 nên NO3- đã phản ứng hết => Dung dịch Y không chứa ion NO3- \(\left\{ \begin{array}{l}Mg\\NaN{O_3}\\{\rm{ }}FeO\end{array} \right\} + {\rm{ }}{H_2}S{O_4}:2,15 \to \left\{ \begin{array}{l}M{g^{2 + }}\\N{a^ + }\\{\rm{ }}F{e^{x + }}\\{\rm{ }}N{H_4}^ + \\{\rm{ }}S{O_4}^{2 - }\end{array} \right\} + \left\{ \begin{array}{l}NO:0,2\\{H_2}:0,3\end{array} \right. + {H_2}O:1,45\) Bảo toàn nguyên tố H: nNH4+ = (2nH2SO4 - 2nH2 - 2nH2O)/4 = 0,2 mol Bảo toàn nguyên tố N: nNaNO3 = nNH4+ + nNO = 0,4 mol Bảo toàn nguyên tố O: nFeO = 4nSO42- + nNO + nH2O - 4nH2SO4 - 3nNaNO3 = 0,45 mol => nO (X) = 3nNaNO3 + nFeO = 1,65 mol => m = 100 gam Mà mMg trong X = m hh - mNaNO3 - mFeO = 33,6 gam Vậy %mMg = 33,6% gần nhất với giá trị 33%. Đáp án C Quảng cáo
|