Câu hỏi:
Trong phản ứng oxi hóa khử sau:
H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O
Hệ số của các chất tham gia phản ứng lần lượt là
- A 5, 2, 4.
- B 5, 2, 3.
- C 2, 2, 5.
- D 3, 2, 5.
Phương pháp giải:
Cân bằng phản ứng bằng phương pháp thăng bằng electron
Lời giải chi tiết:
Bước 1: Xác định sự thay đổi của các nguyên tố trước và sau pư:
\({H_2}\mathop S\limits^{ - 2} + K\mathop {Mn}\limits^{ + 7} {O_4} + {H_2}S{O_4} \to \mathop S\limits^0 + \mathop {Mn}\limits^{ + 2} S{O_4} + {K_2}S{O_4} + {H_2}O\)
Bước 2,3: Viết quá trình nhường nhận e và đặt hệ số trước các chất khử và chất oxi hóa thích hợp sao cho tổng số electron nhường bằng số electron nhận.
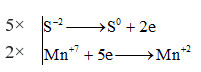
Bước 4: Đặt vào phương trình từ đó tìm được hệ số của chất tham gia phản ứng
\(5{H_2}\mathop S\limits^{ - 2} + 2K\mathop {Mn}\limits^{ + 7} {O_4} + 3{H_2}S{O_4} \to 5\mathop S\limits^0 + \mathop {2Mn}\limits^{ + 2} S{O_4} + {K_2}S{O_4} + 8{H_2}O\)
=> Hệ số của các chất tham gia phản ứng lần lượt là: 5, 2, 3
Đáp án B


















