Câu hỏi:
Cho phương trình hóa học sau:
aAl + bH2SO4 → cAl2(SO4)3 + dS + eH2O
Tổng hệ số (b + c) là
- A 8.
- B 7.
- C 6.
- D 5.
Phương pháp giải:
Dựa vào phương pháp cân bằng pư oxi hóa khử để cân bằng phương trình. Từ đó tìm được hệ số (b+c)
Lời giải chi tiết:
Bước 1: Xác định số oxi hóa của các chất
\(\mathop {Al}\limits^0 + {H_2}\mathop S\limits^{ + 6} {O_4}\xrightarrow{{}}{\mathop {Al}\limits^{ + 3} _2}{(S{O_4})_3} + \mathop S\limits^0 + {H_2}O\)
Bước 2: Viết các quá trình nhường, nhận e, sau đó đặt hệ số trước mỗi quá trình sao cho tổng số electron nhường = tổng số electron nhận
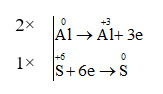
Bước 3: Đặt hệ số tương ứng vào các chất trong phương trình ta được
\(\mathop {2Al}\limits^0 + 4{H_2}\mathop S\limits^{ + 6} {O_4}\xrightarrow{{}}{\mathop {Al}\limits^{ + 3} _2}{(S{O_4})_3} + \mathop S\limits^0 + 4{H_2}O\)
→ (b+c) = 4 + 1 = 5
Đáp án D


















