Phương pháp giải bài tập về sự biến đổi tuần hoàn tính chất các nguyên tố hóa họcPhương pháp giải bài tập về sự biến đổi tuần hoàn tính chất các nguyên tố hóa học đầy đủ, ngắn gọn, dễ hiểu. Quảng cáo
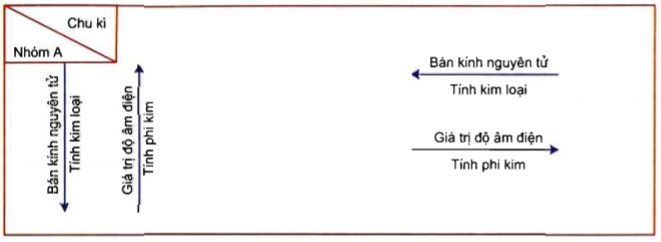
Dạng 1: Dựa vào vị trí trong BTH, so sánh tính chất (tính kim loại, tính phi kim, bán kính nguyên tử, độ âm điện) các nguyên tố hóa học. * Một số lưu ý cần nhớ:
* Khi so sánh tính chất của 2 hay nhiều nguyên tố, ta nên đưa chúng về cùng 1 nhóm, hay cùng 1 chu kì để dễ dàng so sánh. * Một số ví dụ cụ thể: Ví dụ 1: Chọn thứ tự tăng dần bán kính nguyên tử của các kim loại kiềm : A. Li < Na < K < Rb < Cs. B. Cs < Rb < K < Na < Li. C. Li < K < Na < Rb < Cs. D. Li < Na < K< Cs < Rb. Hướng dẫn giải chi tiết: Các kim loại kiềm cùng thuộc 1 nhóm A. Trong cùng 1 nhóm, theo chiều tăng điện tích hạt nhân bán kính nguyên tử tăng dần. => Thứ tự tăng dần của bán kính nguyên tử : Li < Na < K < Rb < Cs. Đáp án A Ví dụ 2: Độ âm điện của dãy nguyên tố Na (Z = 11), Mg (Z = 12), Al (13), P (Z = 15), Cl (Z = 17), biến đổi theo chiều nào sau đây ? A. Tăng. B. Giảm. C. Không thay đổi. D. Vừa giảm vừa tăng. Hướng dẫn giải chi tiết : Na : 1s22s22p63s1 Mg : 1s22s22p63s2 Al : 1s22s22p63s23p1 P : 1s22s22p63s23p3 Cl : 1s22s22p63s23p5 => Các nguyên tố hóa học này thuộc cùng 1 chu kì 3. Trong cùng 1 chu kì, theo chiều tăng điện tích hạt nhân, độ âm điện tăng dần. => Dãy Na, Mg, Al, P, Cl gồm các chất có độ âm điện tăng dần. Đáp án A Ví dụ 3 : Cấu hình electron nguyên tử của ba nguyên tố X, Y, Z lần lượt là : 1s22s22p63s1 1s22s22p63s23p64s1 1s22s1. Nếu xếp theo chiều tăng dần tính kim loại thì cách sắp xếp nào sau đây đúng ? A. Z < X < Y. B. Y < Z < X. C. Z < Y < X. D. X=Y=Z. Hướng dẫn giải chi tiết : - X, Y, Z là 3 nguyên tố hóa học thuộc cùng 1 nhóm. Trong cùng 1 nhóm, theo chiều tăng của điện tích hạt nhân, tính kim loại tăng dần => Tính kim loại Z < X < Y Đáp án A. Ví dụ 4 : Bán kính nguyên tử của các nguyên tố: 3Li, 8O, 9F, 11Na được xếp theo thứ tự tăng dần từ trái sang phải là : A. F, Li, O, Na. B. F, Na, O, Li. C. Li, Na, O, F. D. F, O, Li, Na. Hướng dẫn giải chi tiết: Ta có cấu hình electron của các nguyên tố lần lượt là: Li: 1s22s1 O: 1s22s22p4 F: 1s22s22p5 Na: 1s22s22p63s1 Li, O, F thuộc cùng 1 chu kì (chu kì 2) Trong cùng 1 chu kì, theo chiều tăng điện tích hạt nhân, bán kính nguyên tử giảm dần => Ta có bán kính F < O < Li (I) Li, Na thuộc cùng 1 nhóm (nhóm IA) Trong cùng 1 nhóm, theo chiều tăng điện tích hạt nhân, bán kính nguyên tử tăng dần => Ta có bán kính Li < Na (II) Từ (I) và (II) => F < O < Li < Na Đáp án D Dạng 2 : So sánh tính axit, bazo của axit, hidroxit tương ứng của các nguyên tố hóa học * Một số lưu ý cần nhớ - + Trong một chu kì: theo chiều tăng của điện tích hạt nhân, tính bazơ của các oxit và hiđroxit tương ứng giảm dần, đồng thời tính axit của chúng tăng dần. + Trong một nhóm A, theo chiều tăng của điện tích hạt nhân, tính bazơ của các oxit và hiđroxit tương ứng tăng dần, đồng thời tính axit của chúng giảm dần. * Một số ví dụ cụ thể: Ví dụ 1: Trong các hiđroxit sau, chất nào có tính chất bazơ mạnh nhất ? A. Be(OH)2. B. Ba(OH)2. C. Mg(OH)2. D. Ca(OH)2. * Hướng dẫn giải chi tiết: Trong cùng 1 nhóm, theo chiều tăng điện tích hạt nhân, tính bazo của các hidroxit tương ứng tăng dần Đáp án B Ví dụ 2: Tính axit của các oxit axit thuộc phân nhóm chính V (VA) theo trật tự giảm dần là : A. H3SbO4, H3AsO4, H3PO4, HNO3. B. HNO3, H3PO4, H3SbO4, H3AsO4. C. HNO3, H3PO4, H3AsO4,H3SbO4. D. H3AsO4, H3PO4,H3SbO4, HNO3. Hướng dẫn giải chi tiết Trong cùng 1 nhóm, theo chiều tăng điện tích hạt nhân, tính axit của các nguyên tố tương ứng giảm dần Đáp án B Ví dụ 3: Tính khử và tính axit của các HX (X: F, Cl, Br, I) tăng dần theo dãy nào sau đây ? A. HF < HCl < HBr < HI. B. HCl < HF < HBr < HI. C. HF < HI < HBr < HF. D. HI < HBr < HCl < HF. Hướng dẫn giải chi tiết: F, Cl, Br, I là các nguyên tố thuộc cùng 1 nhóm (nhóm VIIA) Trong cùng 1 nhóm, theo chiều tăng của điện tích hạt nhân, tính axit (tính khử) tăng dần Đáp án A. Dạng 3: Xác định nguyên tố phi kim dựa vào hóa trị cao nhất trong hợp chất với O và hóa trị trong hợp chất với H * Một số lưu ý cần nhớ: Một nguyên tố phi kim R tạo hợp chất oxit cao nhất là R2On và hợp chất với H là RHm thì n + m = 8. Hóa trị cao nhất của một nguyên tố = số thứ tự của nhóm = số electron ngoài cùng (đối với nguyên tố s, p). * Một số ví dụ minh họa Ví dụ 1: Nguyên tố R có hóa trị cao nhất trong oxit gấp 3 lần hóa trị trong hợp chất với hiđro. 1. Hãy cho biết hóa trị cao nhất của R trong oxit. 2. Trong hợp chất của R với hiđro có tỉ lệ khối lượng: \(\frac{{{{\rm{m}}_{\rm{R}}}}}{{{{\rm{m}}_{\rm{H}}}}}{\rm{ }} = {\rm{ }}\frac{{{\rm{16}}}}{{\rm{1}}}\). Không dùng bảng tuần hoàn, cho biết kí hiệu của nguyên tử R. Hướng dẫn giải chi tiết: 1. Gọi hóa trị cao nhất của R trong oxit là a, hóa trị trong hợp chất với hiđro là b. Ta có: a + b = 8. Theo giả thiết : a = 3b. Suy ra : a =6; b = 2. 2. Công thức hợp chất R với hiđro là H2R. Theo bài: mR: mH = 16 : 1 nên R = 32. Gọi tổng số hạt proton, nơtron của R là p, n. Ta có p + n = 32. Ta có : \(1\le \frac{n}{p}\le 1,5\Rightarrow 1\le \frac{32-p}{p}\le 1,5\Rightarrow 12,8\le p\le 16\). Mặt khác, R thuộc nhóm VI (hóa trị cao nhất trong oxit bằng VI) nên dựa vào cấu hình electron khi p = 13, 14, 15, 16 ta thấy p = 16 thỏa mãn (vì có 6 electron ở lớp ngoài cùng). Vậy kí hiệu của nguyên tử R là: \({}_{16}^{32}R\) Ví dụ 2: Hợp chất khí với hiđro của nguyên tố M là MH3. Công thức oxit cao nhất của M là : A. M2O. B. M2O5. C. MO3. D. M2O3. Hướng dẫn giải chi tiết Hợp chất khí với hidro của nguyên tố M là MH3 thì hóa trị của M trong hợp chất oxi cao nhất là: 8 – 3 = 5 => Công thức oxit cao nhất của M là: M2O5 Đáp án B Ví dụ 3: Hợp chất với hiđro của nguyên tố có công thức XH3. Biết % về khối lượng của oxi trong oxit cao nhất của X là 56,34%. Nguyên tử khối của X là : A.14. B. 31. C. 32. D. 52. Hướng dẫn giải chi tiết Hợp chất khí với hidro của nguyên tố M là MH3 thì hóa trị của M trong hợp chất oxi cao nhất là: 8 – 3 = 5 => Công thức oxit cao nhất của M là: M2O5 Biết % về khối lượng của oxi trong oxit cao nhất của X là 56,34% Ta có phương trình: \(\frac{{16*5}}{{2{M_X} + 16*5}} = 56,34\% \) => MX = 31 => Nguyên tử khối của X là 31 Đáp án B Loigiaihay.com
|




















Danh sách bình luận