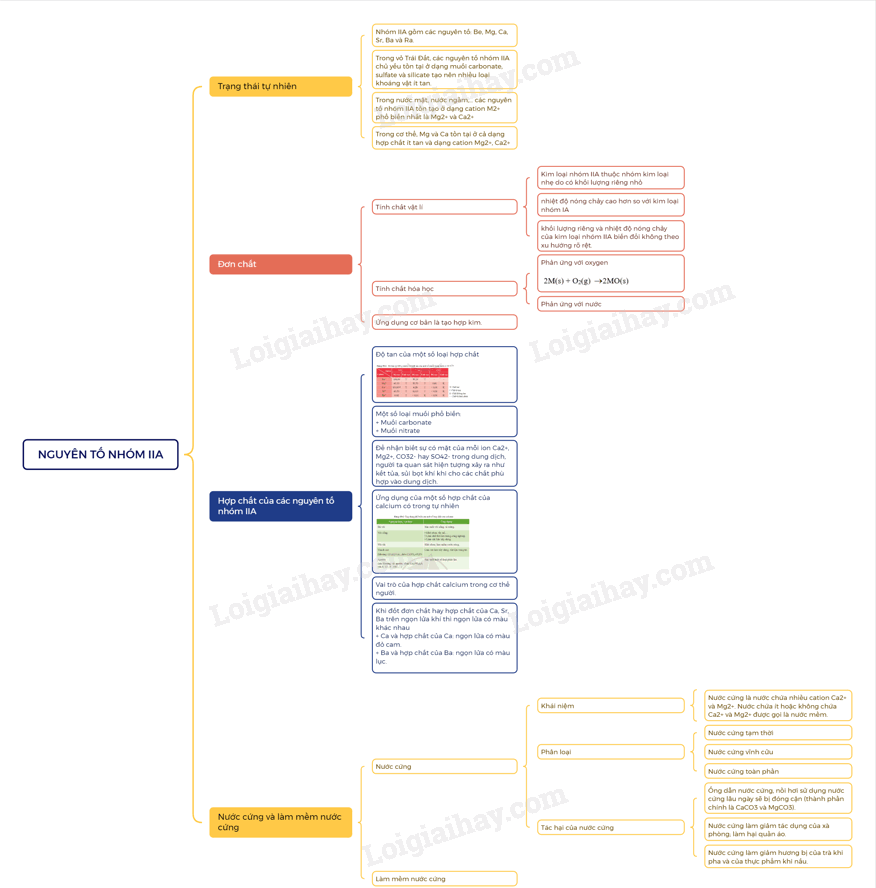
Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Chân trời sáng tạoNhóm IIA gồm các nguyên tố: Be, Mg, Ca, Sr, Ba và Ra. Quảng cáo
A. Đơn chất 1. Vị trí, cấu tạo và trạng thái tự nhiên - Nhóm IIA gồm các nguyên tố: Be, Mg, Ca, Sr, Ba và Ra. - Cấu hình electron lớp ngoài cùng của kim loại nhóm IIA là ns2 - Kim loại nhóm IIA tồn tại trong tự nhiên ở dạng hợp chất. 2. Tính chất vật lí - Nhiệt độ nóng chảy, khối lượng riêng và độ cứng của kim loại nhóm IIA cao hơn so với kim loại nhóm IA cùng chu kì. Kim loại nhóm IIA là những kim loại nhẹ (D < 5g/cm3) 3. Tính chất hóa học a) Phản ứng với oxygen - Khi đốt nóng trong oxygen hoặc trong không khí, các kim loại nhóm IIA đều bốc cháy, tạo ra oxide theo phương trình hóa học tổng quát sau: 2M(s) + O2(g) \( \to \)2MO(s) - Khi cháy, các kim loại nhóm IIA cho ngọn lửa có màu đặc trưng. b) Phản ứng với nước Be không tan trong nước, Mg phản ứng với nước rất chậm ở nhiệt độ thường, phản ứng mạnh hơn khi đun nóng. Ca, Sr, Ba phản ứng mạnh với nước ở nhiệt độ thường B. Hợp chất 1. Tính chất của muối carbonate, nitrate a) Muối carbonate - Muối carbonate của các nguyên tố Mg, Ca, Sr, Ba phản ứng với dung dịch acid, với nước có carbon dioxide hòa tan. Ví dụ: CaCO3(s) + 2HCl(aq) \( \to \)CaCl2(aq) + H2O(l) + CO2(g) CaCO3(s) + H2O(l) + CO2(aq) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) Ca(HCO3)2(aq) - Các muối carbonate bị nhiệt phân, tạo thành oxide kim loại và khí carbon dioxide:
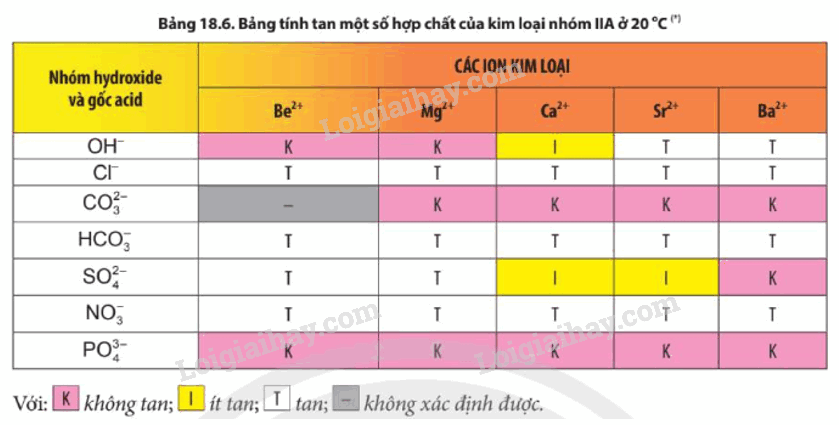
b) Muối nitrate - Các muối nitrate của nguyên tố nhóm IIA bị nhiệt phân tạo oxide kim loại, khí nitrogen dioxide và oxygen. - Độ bền nhiệt của các muối nitrate có xu hướng tăng từ Mg(NO3)2 đến Ba(NO3)2. 2. Tính tan của các muối carbonate, sulfate, nitrate - Các muối nitrate đều tan - Trừ BeCO3, các muối carbonate khác không tan trong nước. - Các muối BeSO4, MgSO4 tan; SrSO4 và CaSO4 ít tan; BaSO4 không tan 3. Ứng dụng - Magnesium nhẹ hơn so với Al, vì vậy hợp kim của Mg được sử dụng trong chế tạo máy bay, ô tô. - Đá vôi là thành phần chính là calcium carbonate, được dùng để sản xuất vôi, xi măng, làm vật liệu xây dựng,… - Vôi sống làm vật liệu xây dựng, tẩy uế, sát trùng. - Nước vôi được dùng xử lí nước, giảm tính cứng của nước. - Thạch cao có thành phần chính là calcium sulfate được sử dụng làm vách, trần thạch cao để tăng tính thẩm mĩ trong xây dựng. - Khoáng vật apatite chứa calcium, được dùng chế tạo phân bón cho nông nghiệp, làm nguyên liệu sản xuất phân lân. - Vai trò một số hợp chất của calcium trong cơ thể con người: calcium là thành phần chính của xương và răng; ion calcium có trong muối phosphate phức tạp, hydroxyapatide, ion Ca2+ trong cơ thể người có chức năng kích hoạt quá trình trao đổi chất, đóng vai trò quan trọng trong hoạt động của tim, đông máu, co cơ và truyền xung thần kinh. 4. Nước cứng và cách làm mềm nước cứng Phân loại nước cứng - Nước cứng là loại nước chứa ion Ca2+ và Mg2+ với hàm lượng vượt quá mức cho phép. - Nước cứng tạm thời được gây nên bởi các muối Ca(HCO3)2 và Mg(HCO3)2. - Nước cứng vĩnh cửu được gây nên bởi các muối sulfate, chloride của calcium và magnesium. - Nước cứng toàn phần bao gồm nước cứng tạm thời và nước cứng vĩnh cửu. - Tác hại của nước cứng + Trong đời sống hằng ngày: nước cứng làm giảm khả năng tạo bọt của xà phòng, giảm tác dụng giặt rửa, làm các dụng cụ đun nấu dễ bị đóng cặn, tiêu hao năng lượng. Nếu sử dụng nước cứng để nấu ăn sẽ làm thực phẩm lâu chín và giảm mùi vị. + Trong bảo vệ sức khỏe: dùng nước cứng tắm gội hằng ngày sẽ gây khô da, khô tóc hay mẩn ngứa, gây hại sức khỏe. + Trong công nghiệp: trong các nồi áp suất của tua bin hơi nước ở nhiều nhà máy, nước cứng tạo cặn là CaCO3, cản trở quá trình dẫn nhiệt. - Các phương pháp làm mềm nước cứng: 1. Phương pháp kết tủa Cơ sở của phương pháp này là chuyển cation Ca2+, Mg2+ trong nước về dạng chất không tan, có thể dễ dàng tách ra khỏi nước bằng cách lắng, lọc. + Khi đun sôi nước cứng, muối Ca(HCO3)2 và Mg(HCO3)2 bị phân hủy tạo ra muối không tan, làm mất tính cứng tạm thời của nước. + Dùng Ca(OH)2 với lượng vừa đủ để phản ứng với muối Ca(HCO3)2 và Mg(HCO3)2 tạo ra hợp chất không tan, làm mất tính cứng tạm thời của nước. + Dùng Na2CO3 hoặc Na3PO4 để làm mất tính cứng tạm thời và tính cứng vĩnh cửa của nước. 2. Phương pháp trao đổi ion - Thực hiện bằng cách cho nước cứng đi qua lớp vật liệu hay màng vật liệu trao đổi ion. Các vật liệu này có chứa cation kim loại như Na+. Khi cho nước cứng đi qua vật liệu, các cation Ca2+ và Mg2+ đẩy cation Na+ ra khỏi vật liệu. Các cation Ca2+, Mg2+ bị giữ lại trên vật liệu. - Phương pháp trao đổi ion làm giảm được cả tính cứng vĩnh cửu. SƠ ĐỒ TƯ DUY
|














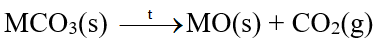
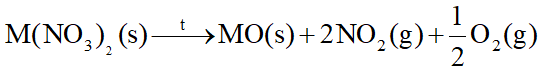






Danh sách bình luận