Lý thuyết Mol và tỉ khối của chất khí - Khoa học tự nhiên 8 Cánh diềuKhái niệm mol Quảng cáo
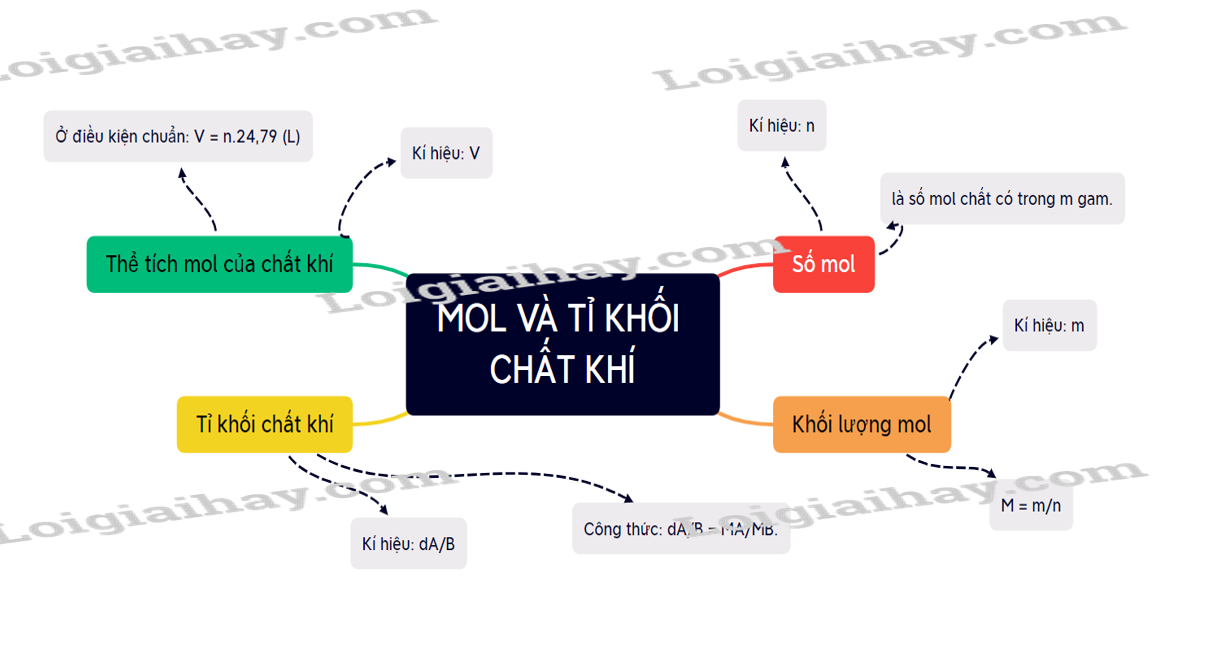
I. Khái niệm mol Mol là lượng chất có chứa 6,022 x 1023 hạt vi mô (nguyên tử, phân tử,…) của chất đó. Ví dụ: 1 nguyên tử đồng (Cu) là lượng đồng có chứa 6,022 x 1023 nguyên tử Cu II. Khối lượng mol Khối lượng mol (kí hiệu là M) của một chất là khối lượng bằng gam của N nguyên tử hoặc phân tử chất đó Ví dụ: Khối lượng nguyên tử oxygen là 16 amu, khối lượng mol nguyên tử của oxygen là 16 gam/mol. III. Chuyển đổi giữa số mol chất và khối lượng Nếu đặt n là số mol chất, M là khối lượng mol chất và m là khối lượng chất, ta có công thức: \(n = \frac{m}{M}(mol) \to m = n.M(gam);M = \frac{m}{n}(gam/mol)\) IV. Thể tích mol của chất khí Một mol của bất kì chất khí nào cũng chiếm những thể tích bằng nhau khi ở cùng điều kiện nhiệt độ và áp suất. V. Chuyển đổi giữa lượng chất và thể tích chất khí Ở điều kiện chuẩn ( áp suất 1 bar và nhiệt độ 250C), nếu đặt n là số mol chất khí, V là thể tích chất khí ở cùng điều kiện chuẩn thì ta có biểu thức: V = 24,79 x n (lít) à n = V/24,79 (mol) VI. Tỉ khối của chất khí Tỉ khối của khí A đối với khí B là tỉ số giữa khối lượng mol của khí A và khối lượng mol của khí B Tỉ khối của khí A đối với khí B được kí hiệu là dA/B và được tính bằng biểu thức: \({d_{A/B}} = \frac{{{M_A}}}{{{M_B}}}\) Tỉ khối của một khí với không khí \({d_{X/khongkhi}} = \frac{{{M_X}}}{{29}}\)
|




















Danh sách bình luận