Lý thuyết Định luật Boyle. Định luật Charles - Vật lí 12 Chân trời sáng tạoTrạng thái và quá trình biến đổi trạng thái của khí Định luật Boyle Định luật Charles Quảng cáo
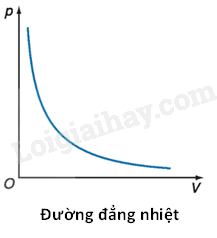
Bài 6. Định luật Boyle. Định luật Charles 1. Trạng thái và quá trình biến đổi trạng thái của khí - Trạng thái của một khối lượng khí (khối khí) không đổi được xác định bằng ba thông số: thể tích V, áp suất p và nhiệt độ tuyệt đối T - Quá trình biến đổi trạng thái của một khối lượng khí xác định mà trong đó có một thông số trạng thái không đổi gọi là đẳng quá trình + Đẳng nhiệt là quá trình biến đổi trạng thái, trong đó nhiệt độ được giữ không đổi + Đẳng áp là quá trình biến đổi trạng thái, trong đó áp suất được giữ không đổi + Đẳng tích là quá trình biến đổi trạng thái, trong đó thể tích được giữ không đổi 2. Định luật Boyle - Khi nhiệt độ của một khối lượng khí xác định giữ không đổi thì áp suất gây ra bởi khí tỉ lệ nghịch với thể tích của nó: pV = hằng số - Đồ thị biểu diễn định luật Boyle là một nhánh của đường hypebol.
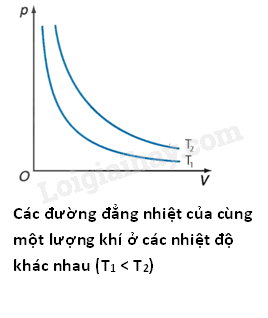
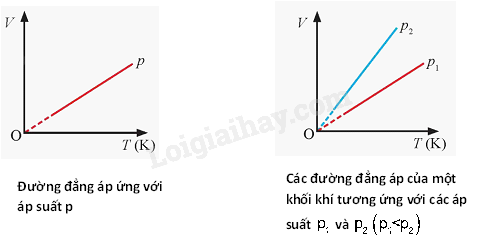
- Đường đẳng nhiệt của cùng một lượng khí ứng với các nhiệt độ khác nhau thì khác nhau. Đường đẳng nhiệt của cùng một lượng khí ứng với nhiệt độ \({T_1}\) ở thấp hơn đường đẳng nhiệt ứng với nhiệt độ \({T_2}\), với \({T_1} < {T_2}\). - Nếu gọi \({p_1},\,\,{V_1}\) là áp suất và thể tích của khí ở trạng thái 1; \({p_2},\,\,{V_2}\) là áp suất và thể tích của khí ở trạng thái 2 thì: \({p_1}{V_1} = {p_2}{V_2}\) 3. Định luật Charles - Khi áp suất của một khối lượng khí xác định giữ không đổi thì thể tích của khí tỉ lệ thuận với nhiệt độ tuyệt đối của nó: \(\frac{V}{T} = \) hằng số - Nếu gọi \({V_1},\,\,{T_1}\) lần lượt là thể tích và nhiệt độ tuyệt đối ở trạng thái 1; \({V_2},\,\,{T_2}\) lần lượt là thể tích và nhiệt độ tuyệt đối ở trạng thái 2 thì \(\frac{{{V_1}}}{{{T_1}}} = \frac{{{V_2}}}{{{T_2}}}\)
Sơ đồ tư duy về “Định luật Boyle. Định luật Charles” |





















Danh sách bình luận