Lý thuyết cấu tạo vỏ nguyên tửI. SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG NGUYÊN TỬ Quảng cáo
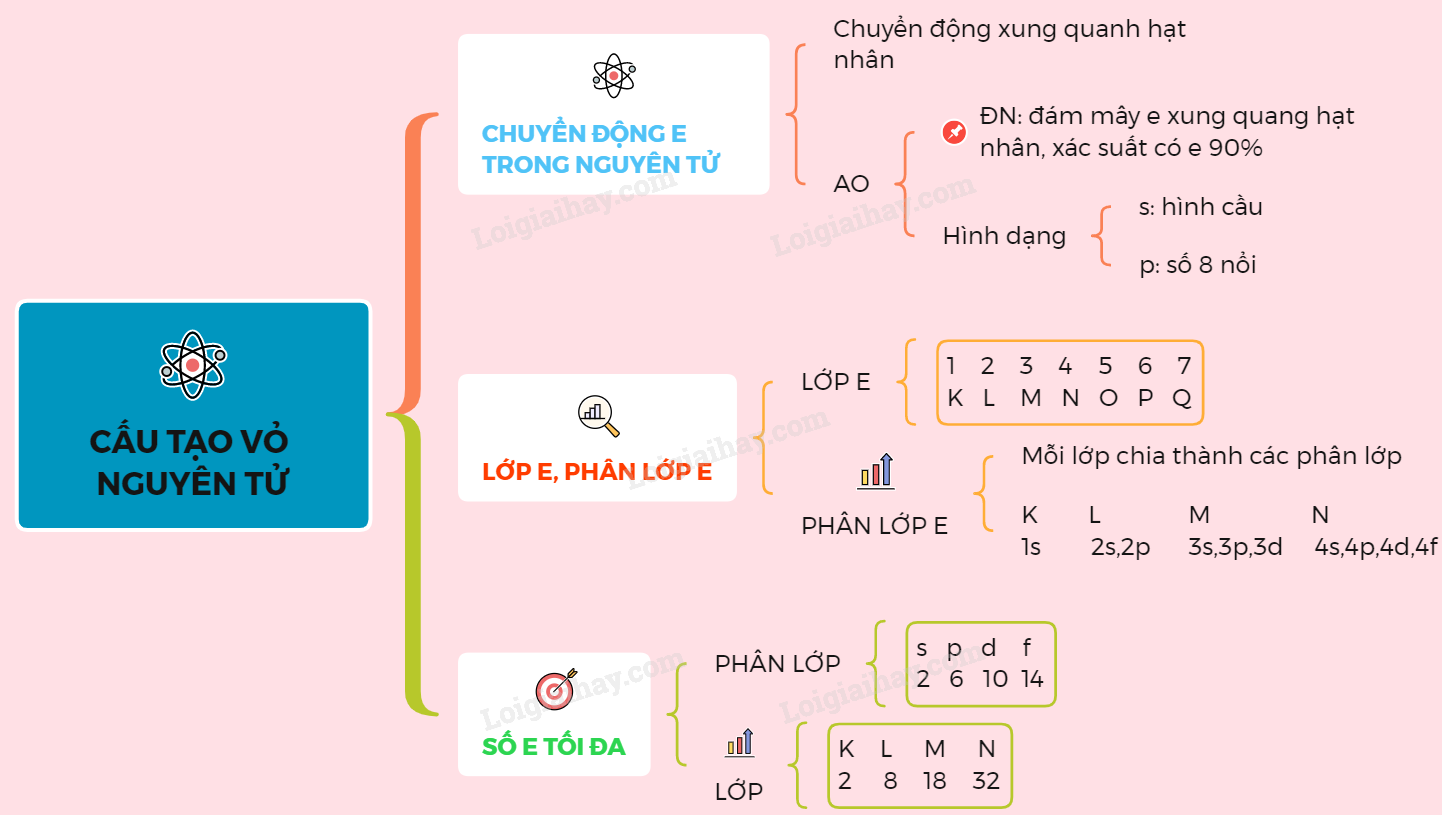
I. SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG NGUYÊN TỬ 1. Sự chuyển động của electron trong nguyên tử Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo quỹ đạo xác định nào và tạo thành đám mây electron. 2. Obitan nguyên tử (AO) a) Định nghĩa: Obitan nguyên tử là khu vực đám mây electron xung quanh hạt nhân mà xác suất có mặt electron khoảng 90%. b) Hình dạng obitan nguyên tử: Dựa trên sự khác nhau về trạng thái electron trong nguyên tử ta có: - Obitan s: dạng hình cầu. - Obitan p: gồm 3 obitan px, py, pz có hình dạng số 8 nổi, định hướng theo 3 trục Ox, Oy, Oz của hệ tọa độ. II. LỚP ELECTRON VÀ PHÂN LỚP ELECTRON 1. Lớp electron Lớp electron gồm các electron có mức năng lượng gần bằng nhau. Các lớp electron xếp theo thứ tự mức năng lượng từ thấp đến cao (từ gần nhân ra ngoài):
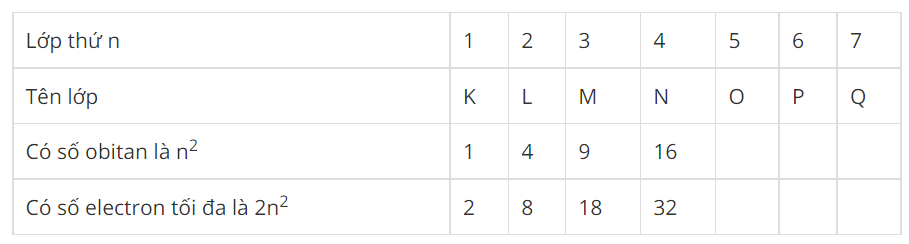
2. Phân lớp electron - Mỗi lớp electron lại chia thành các phân lớp. - Các electron trên cùng một phân lớp có mức năng lượng bằng nhau. - Các phân lớp được kí hiệu bằng các chữ cái thường s, p, d, f. - Số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó. => Lớp thứ n có n phân lớp
* Các em cần phân biệt rõ ràng giữa lớp và phân lớp nhé. - Các electron ờ phân lớp s được gọi là các electron s, ở phân lớp p được gọi là các electron p... III. SỐ ELECTRON TỐI ĐA TRONG MỘT PHÂN LỚP, MỘT LỚP - Số electron tối đa trong một phân lớp như sau :
- Phân lớp electron đã có đủ số electron tối đa gọi là phân lớp electron bão hoà. - Từ đó suy ra số electron tối đa trong một lớp :
=> Số electron tối đa của lớp thứ n là 2n2. Sơ đồ tư duy: Cấu tạo vỏ nguyên tử
Loigiaihay.com
|