Bài 22. Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 74, 75, 76 SBT Hóa 12 Cánh diềuCho phát biểu sau: “Khi tan trong nước Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
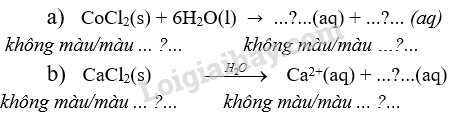
22.1 Cho phát biểu sau: “Khi tan trong nước, muối của các kim loại chuyển tiếp …(1)… thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hoá trị riêng từ các phân tử H2O để hình thành các liên kêt cho - nhận, tạo ra phức chất aqua có dạng tổng quát là ...(2).... Cụm từ cần điền vào (1) và (2) lần lượt là: A. điện li, [M(OH2)n]+. B. điện li, [M(OH2)m]n+. C. phân li, [M(OH2)m]n+. D. phân li, [M(OH2)n]+. Phương pháp giải: Dựa vào sự hình thành liên nkết trong phức chất. Lời giải chi tiết: (1) phân li, (2) [M(OH2)m]n+ Đáp án C 22.2 Khi cho dung dịch ammonia dư vào dung dịch chứa phức chất [Ni(OH2)6]2+ và anion Cl- thì có phản ứng sau: [Ni(OH2)6]2+(aq) + 6NH3(aq) → [Ni(NH3)6]2+(aq) + 6H2O(l) (*) Phát biểu nào dưới đây là không đúng? A. Trong điều kiện của phản ứng (*), phức chất [Ni(NH3)6]2+(aq) kém bền hơn phức chất [Ni(OH2)6]2+(aq). B. Phản ứng (*) là phản ứng thế phối tử. C. Dung dịch sau phản ứng có pH > 7. D. Trong phản ứng không có sự thay đôi số oxi hoá của các nguyên tố. Phương pháp giải: Dựa vào phản ứng trao đổi phối tử. Lời giải chi tiết: Phản ứng hoàn toàn, sản phẩm [Ni(NH3)6]2+(aq) bền hơn [Ni(OH2)6]2+(aq) Đáp án A 22.3 Nước có lượng đáng kể các cation Al3+ và Fe3+ được gọi là nước nhiễm phèn. Trong nước nhiễm phèn, mỗi cation này bị thuỷ phân tạo thành phức chất gồm 1 nguyên tử trung tâm, 3 phối tử OH- và 3 phối từ H2O. a) Viết phương trình hoá học của các phản ứng diễn ra. b) Vì sao nước phèn có pH thấp? c) Vì sao trong nước phèn xuất hiện các chất lơ lửng không tan? Phương pháp giải: Dựa vào sự hình thành phức chất. Lời giải chi tiết: a) Phương trình hóa học: Al3+(aq) + 6H2O(l) → [Al(OH2)6]3+(aq); [Al(OH2)6]3+(aq) →[Al(OH)3(OH2)3](s) + H+(aq) Fe3+(aq) + 6H2O(l) → [Fe(OH2)6]3+(aq); [Fe(OH2)6]3+(aq) →[Fe(OH)3(OH2)3](s) + H+(aq) b) Vì các phản ứng tạo phức xảy ra hình thành H+ tạo môi trường acid → pH thấp c) Đó là các sản phẩm phức kết tủa [Al(OH)3(OH2)3] và [Fe(OH)3(OH2)3] 22.4 Muối cobalt(II) chloride có màu hồng. Hoà tan muối này vào nước thu được dung dịch màu xanh (dung dịch A) do ion Co2+ tạo thành phức chất aqua có dạng hình học bát diện. Phức chất này kém bền đối với nhiệt. Khi nhúng một băng giấy lọc màu trắng vào dung dịch A rồi sấy ở khoảng 100°C cho đến khô thu được băng giấy có màu hồng. Người ta có thể dùng băng giấy này để phát hiện nước trong một số mẫu vật. Giải thích nguyên nhân của ứng dụng vừa nêu, viết phương trình hoá học minh hoạ. Phương pháp giải: Dựa vào sự hình thành phức chất. Lời giải chi tiết: Nguyên nhân của ứng dụng trên là dựa vào phản ứng tạo phức của cation Co2+ trong dung dịch: Co2+(aq) + 6H2O(l) → [Co(OH2)62+(aq) 22.5 Mỗi phát biểu dưới đây đúng hay sai? (a) Trong nước, cation của kim loại M (có hoá trị n) thường tồn tại ở dạng phức chất aqua [M(OH2)m]n+. (b) Các phức chất aqua [M(OH2)m]n+ luôn có màu. (c) Trong nhiều phức chất aqua [M(OH2)m]n+, số phối tử thường là 6. (d) Phức chất aqua [M(OH2)m]n+ có thể tan hoặc không tan trong nước. Phương pháp giải: Dựa vào màu sắc của phức chất. Lời giải chi tiết: (a) Đúng (b) Sai. Có một số cation kim loại không có màu trong dung dịch (c) Sai. Số phối tử tùy thuộc vào cấu tạo của ion trung tâm (d) Sai. Phức chất aqua tan trong nước 22.6 Những phát biểu nào dưới đây là đúng? (a) Phản ứng tạo thành phức chất thường kèm theo sự biến đổi về màu sắc. (b) Phức chất tạo thành phải bền hơn so với chất tham gia phản ứng. (c) Quá trình hoà tan copper(II) chloride trong nước có diễn ra phản ứng hình thành phức chất. (d) Quá trình hoà tan potassium permanganate (KMnO4) trong nước có diễn ra phản ứng hình thành phức chất. (e) Quá trình hoà tan aluminium sulfate trong nước có diễn ra phản ứng hình thành phức chất. Phương pháp giải: Dựa vào phản ứng trao đổi phối tử. Lời giải chi tiết: a) sai vì có những phản ứng không có sự biến đổi về màu sắc. b), c), e) đúng d) sai vì vì không có sự tạo thành phức chất. 22.7 Tìm kiếm thông tin để hoàn thành các phương trình hoá học sau:
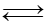
Phương pháp giải: Dựa vào màu sắc của phức chất. Lời giải chi tiết: a) [Co(OH2)6]2+ và 2Cl- ; màu xanh b) 2Cl-, màu trắng 22.8 Dự đoán hiện tượng của quá trình diễn ra khi cho mỗi chất: Ba(OH)2, Na2CO3, NH3, CuO vào dung dịch sulfuric acid loãng dư. Quá trình nào có dấu hiệu của phản ứng tạo phức chất trong dung dịch? Giải thích. Phương pháp giải: Dựa vào phản ứng trao đổi phối tử. Lời giải chi tiết: Ba(OH)2: Có phản ứng tạo kết tủa trắng Na2CO3: Tan, phản ứng không nhìn thấy hiện tượng thay đổi màu sắc NH3: Phản ứng không làm thay đổi màu sắc CuO: Tan, tạo dung dịch màu xanh do có phản ứng tạo phức chất: CuO(s) + 2H+(aq)→ Cu2+(aq) + H2O(l) Cu2+(aq) + 6H2O(l) → [Cu(OH2)6]2+(aq) 22.9 Các dung dịch chứa những ion nào sau đây tạo môi trường có pH nhỏ hơn 7 do quá trình thuỷ phân? a) \({{\rm{K}}^{\rm{ + }}}\), \({\rm{N}}{{\rm{a}}^{\rm{ + }}}\), \({\rm{SO}}_{\rm{4}}^{{\rm{2 - }}}\), \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\) b) [Al(OH2)6]3+, \({\rm{SO}}_{\rm{4}}^{{\rm{2 - }}}\) c) [Fe(OH2)6]2+,[Fe(OH2)6]3+, \({\rm{C}}{{\rm{l}}^{\rm{ - }}}\) d) \({{\rm{K}}^{\rm{ + }}}\), \({\rm{N}}{{\rm{a}}^{\rm{ + }}}\), \({\rm{CO}}_3^{{\rm{2 - }}}\), \({\rm{HCO}}_3^{\rm{ - }}\) Phương pháp giải: Dựa vào tính chất của phức chất. Lời giải chi tiết: b,c có pH nhỏ hơn 7 do thủy phân tạo H+ 22.10 Có hai thí nghiệm dưới đây. Thí nghiệm 1 ở 0°C: Có một ống nghiệm chứa 1 mL dung dịch copper(II) sulfate 0,5% màu xanh nhạt. Thêm từ từ cho đến hết 2 mL dung dịch hydrochloric acid đặc không màu vào ống nghiệm đó thì thu được dung dịch có màu vàng chanh do có quá trình: [Cu(OH2)6]2+(aq) + 4Cl- Thí nghiệm 2 ở 20°C: Có một ống nghiệm chứa 1 mL dung dịch copper(II) sulfate 0,5% màu xanh nhạt. Thêm từ từ cho đến hết 2 mL dung dịch sodium chloride bão hoà không màu vào ống nghiệm đó thì thu được dung dịch có màu xanh nhạt hơn so với ban đầu. Mỗi phát biểu sau đây đúng hay sai? (a) Biểu thức tính hằng số cân bằng của phản ứng ở thí nghiệm 1 là:
(c) Trong thí nghiệm 1, nồng độ anion Cl- càng cao thì phản ứng thuận càng dễ diễn ra. (d) Trong thí nghiệm 2 không có dấu hiệu của phản ứng hình thành phức chất. Phương pháp giải: Dựa vào tính chất hóa học của phức chất Lời giải chi tiết: (a) Sai. Có thể không tính H2O (b) Sai. Phản ứng thuận K lớn hơn nên thuận lợi hơn (c) Đúng (d) Đúng vì Nếu hình thành phức [CuCl4]2-(aq) phải có màu vàng chanh nhưng thí nghiệm 2 không thấy hiện tượng này 22.11 Khi hoà tan một lượng phèn nhôm - kali vào nước thì có các quá trình cơ bản sau diễn ra: Al3+(aq) + 6H2O(l) → [Al(OH2)6]3+(aq) (1) [Al(OH2)6]3+(aq) + 3H2O(l) ⥦ [Al(OH)3(H2O)3](s) + 3H3O+(aq) (2) Mỗi phát biểu sau đây là đúng hay sai? (a) Quá trình (1) là quá trình tạo phức chất aqua của cation Al3+. Quá trình này diễn ra rất thuận lợi. (b) Các quá trình (1) và (2) giúp giải thích vì sao cation Al3+ là một base trong dung dịch nước theo Bronsted – Lowry. (c) Ở quá trình (2), các phân tử nước đóng vai trò là dung môi. (d) Để thu được nhiều kết tủa keo thì cần hoà tan lượng nhỏ phèn trong lượng lớn nước. Phương pháp giải: Dựa vào tính chất hóa học của phức chất. Lời giải chi tiết: (a) Đúng. Phản ứng 1 chiều (b) Sai. Al3+ là acid do nhường proton H+ (c) Sai. Vừa là dung môi, vừa là chất tạo phối tử thay thế (d) Đúng 22.12 Phèn sắt - ammonium là muối kép có công thức (NH4)2SO4.Fe2(SO4)3.24H2O thường được dùng làm chất cầm màu vải, xử lí nước thải công nghiệp,... Khi hoà tan một lượng nhỏ phèn sắt - ammonium vào nước, sẽ có phản ứng thủy phân diễn ra, thu được phức chất không tan chứa phối tử H2O và OH- và phần dung dịch. a) Viết các phương trình hoá học của quá trình tạo phức chất không tan. b) Nêu cách chứng minh sự có mặt của tất cả các ion có trong phần dung dịch. Phương pháp giải: Dựa vào tính chất hóa học của phức chất. Lời giải chi tiết: a) Fe3+(aq) + 6H2O(l) → [Fe(OH2)6]3+(aq); [Fe(OH2)6]3+(aq) b) Thành phần dung dịch thu được gồm: H+, NH4+, SO42-. Dùng quì tím, dung dịch Ba(OH)2 để nhận biết 22.13 Cho các quá trình tạo phức chất bát diện sau:
Biết dung dịch [Fe(OH2)6]3+ màu vàng nâu, dung dịch [Fe(OH2)5(SCN)]2+ có màu đỏ, dung dịch [Fe(OH2)5F]2+ và các anion SCN-, F- đều không có màu. Mỗi phát biểu sau đây đúng hay sai? (a) Quá trình (I) xảy ra khi hoà tan iron(III) chloride trong nước. Kết thúc quá trình này thu được dung dịch có chứa lượng lớn cation Fe3+ và phức chất aqua [Fe(OH2)6]3+. (b) So với anion F-, anion SCN- dễ thay thế phối tử H2O trong [Fe(OH)6]3+ hơn. (c) Khi cho từ từ dung dịch KSCN vào dung dịch ở quá trình (III) thì dung dịch này sẽ có màu. (d) Trong các quá trình (I), (II) và (III), mỗi phân tử H2O hoặc anion SCN- hay anion F- đều sử dụng số cặp electron hoá trị riêng như nhau để cho vào orbital trống của cation Fe3+. Phương pháp giải: Dựa vào phản ứng thay thế phối tử. Lời giải chi tiết: (a) Sai. Thu được phức chất aqua (phản ứng 1 chiều) (b) Sai. Phối tử F- dễ thế hơn phối tử SCN- vì KC phản ứng (III) lớn hơn (Trường phối tử của F- lớn hơn) (c) Đúng. Phản ứng (III) thuận nghịch nên vẫn còn phức [Fe(OH2)6]3+(aq), sẽ xảy ra phản ứng (II) tạo phức chất màu đỏ (d) đúng 22.14 Cho hai quá trình sau:
Trong đó, en là ethylenediamine. Phân tử này đã dùng tất cả các cặp electron hoá trị riêng để tạo liên kết cho - nhận với cation Cu2+. Mỗi phát biểu dưới đây là đúng hay sai? (a) Quá trình (II) thuận lợi hơn quá trình (I) về năng lượng. (b) Sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi NH3 tạo ra phức chất bền hơn so với sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi en. (c) Xung quanh nguyên tử trung tâm trong phức chất [Cu(NH3)2(OH2)4]2+ và trong phức chất [Cu(en)(OH2)4]2+ đều có 6 liên kết . (d) Phản ứng diễn ra ở quá trinh (I) và (II) đều có sự tạo thành phức chất không tan và có sự biến đổi màu sắc. Phương pháp giải: Dựa vào tính chất hóa học của phức chất Lời giải chi tiết: a. Đúng vì \({\Delta _r}H_{298}^0(2) > {\Delta _r}H_{298}^0(1)\)nên thuận lợn về năng lượng hơn. b. Sai vì en tạo phức bền hơn khi có KC lớn hơn c. Đúng vì [Cu(en)(OH2)4]2+ mặc dù có 5 phối tử nhưng phối tử en là phối tử 2 càng, tạo 2 liên kết d. Sai vì phức chất ở dạng iôn là phức chất tan trong nước 22.15 Khi hòa tan zinc(II)chloride trong nước, diễn ra một số quá trình cơ bản sau: Zn2+(aq) + 6H2O(l) → [Zn(OH2)6]2+(aq) (I) [Zn(OH2)6]2+(aq)→ [Zn(OH)(OH2)5]+(aq) + H+(aq) KC=10-9 (II) H+(aq) + H2O(l) → H3O+(aq) (III) Cho các phát biểu sau: (1) Quá trình (I) và (III) có thể diễn ra yếu hơn quá trình (II). (2) Từ quá trình (II) có thể suy ra “[Zn(OH2)6]2+ là acid theo Arrhenius”. (3) Từ quá trình (III) có thể suy ra “H2O là base theo Bronsted - Lowry”. (4) Từ quá trình (I), (II) và (III) suy ra “trong nước, cation Zn2+ là acid theo Bronsted - Lowry”. (5) Dung dịch zinc(II) chloride có tính acid khá mạnh. (6) Trong dung dịch zinc(II) chloride, nước vừa là dung môi, vừa đóng vai trò base theo Bronsted - Lowry. Số phát biểu đúng là: A. 2. B. 3. C. 4. D 5 Phương pháp giải: Dựa vào tính chất hóa học của phức chất. Lời giải chi tiết: (1) Sai vì quá trình (II) xảy ra không hoàn toàn (thuận nghịch) (2) Đúng (3) Đúng (4) Đúng (5) Sai vì KC bé nên tính acid yếu (6) Đúng Đáp án C
|














 (aq) [CuCl4]2-(aq) + 6H2O(l) KC = 4,18.105
(aq) [CuCl4]2-(aq) + 6H2O(l) KC = 4,18.105 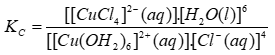
 [Fe(OH)3(OH2)3](s) + H+(aq)
[Fe(OH)3(OH2)3](s) + H+(aq)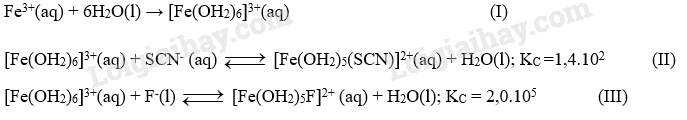
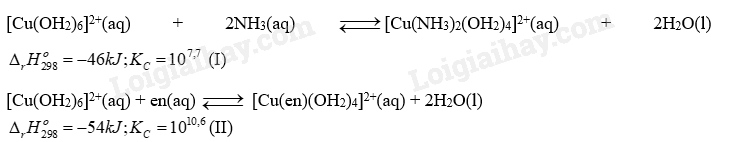






Danh sách bình luận