Bài 4. Ammonia và một số hợp chất ammonium trang 24, 25, 26, 27, 28, 29 Hóa học 11 Chân trời sáng tạoAmmonia là một hợp chất của hydrogen và nitrogen, có rất nhiều ứng dụng trong đời sống và sản xuất. Ammonia có những tính chất và ứng dụng gì? Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 24 MĐ Ammonia là một hợp chất của hydrogen và nitrogen, có rất nhiều ứng dụng trong đời sống và sản xuất. Ammonia có những tính chất và ứng dụng gì? Phương pháp giải: Nêu tính chất vật lý, tính chất hóa học và ứng dụng của ammonia. Lời giải chi tiết: - Tính chất của ammonia: + Tính chất vật lý: Ammonia là chất khí không màu, mùi khai và xốc, nhẹ hơn không khí. Ammonia tan rất nhiều trong nước tạo thành dung dịch ammonia. + Tính chất hóa học: Trong phản ứng hóa học, ammonia thể hiện tính khử và tính base. - Ứng dụng của ammonia: Ammonia được sử dụng để sản xuất nitric acid, các loại phân đạm. Ammonia còn được sử dụng làm chất làm lạnh, làm dung môi và nhiều ứng dụng quan trọng khác trong đời sống và sản xuất. CH tr 24 CH Quan sát Hình 4.1, mô tả cấu tạo phân tử ammonia. Dự đoán tính tan (trong nước) và tính oxi hóa – khử của ammonia. Giải thích. Phương pháp giải: Nước là dung môi phân cực. Các hợp chất phân cực tan tốt trong nước. Số oxi hóa của N: -3; 0; +1; +2; +3; +4; +5. Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm. Lời giải chi tiết: - Phân tử ammonium có dạng hình chóp tam giác, được cấu tạo bởi 3 liên kết cộng hóa trị phân cực N – H. Trên nguyên tử N còn 1 cặp electron hóa trị chưa tham gia liên kết. - Các liên kết NH3 là liên kết cộng hoá trị phân cực nên các phân tử ammonia dễ tạo liên kết hydrogen với nhau và với phân tử nước. Vì tạo được liên kết hydrogen với nước nên ammonia tan rất nhiều trong nước. - Số oxi hóa của N trong NH3 là -3. Đây là số oxi hóa thấp nhất của N nên trong các phản ứng oxi hóa khử, ammonia đóng vai trò là chất khử. CH tr 25 CH1 Quan sát Hình 4.2, giải thích hiện tượng thí nghiệm. Từ đó cho biết tại sao không thu khí ammonia bằng phương pháp đẩy nước. Phương pháp giải: Khí ammonia tan nhiều trong nước. NH3 (ammonia) là dung dịch có tính base theo thuyết acid – base của Brosted – Lowry. Dung dịch ammonia làm quỳ tím hóa xanh, phenolphthalein hóa hồng. Thu khí bằng phương pháp đẩy nước áp dụng cho những chất khí không tan hoặc ít tan trong nước. Lời giải chi tiết: Khí ammonia tan nhiều trong nước. làm áp suất trong bình khí chứa ammonia giảm, hút nước có pha phenolphthalein lên bình, phun thành tia; khí ammonia có tính base, làm phenolphthalein hóa hồng nên các tia nước phun lên có màu hồng. Vì khí ammonia tan nhiều trong nước, nên không thể sử dụng phương pháp đẩy nước để thu khí ammonia. CH tr 25 CH2 Tính tỉ khối của NH3 so với không khí. Từ kết quả đó, hãy giải thích vì sao có thể thu khí NH3 bằng phương pháp đẩy không khí (úp ngược bình). Phương pháp giải:
Lời giải chi tiết:
CH tr 25 CH3 Từ sự kết hợp giữa NH3 với nước, nhận xét tính acid — base của NH3 trong dung dịch. Nêu cách nhận biết khí NH3 bằng quỳ tím. Giải thích Phương pháp giải: Theo thuyết acid, base của Bronsted – Lowry: Acid là chất cho H+ (proton), base là chất nhận H+. Dung dịch có tính acid làm quỳ tím hóa đỏ, dung dịch có tính base làm quỳ tím hóa xanh. Lời giải chi tiết: Khi tan trong nước, ammonia nhận thêm H+ từ nước, do đó ammonia có tính base. Dung dịch ammonia có tính base. Khi sử dụng quỳ tím ẩm để nhận biết khí ammonia, quỳ tím hóa xanh. CH tr 25 CH4 Chuẩn bị hai đầu đũa thuỷ tinh quấn bông. Đũa 1 nhúng vào dung dịch HCl đặc, đũa 2 nhúng vào dung dịch NH3 đặc, sau đó đưa lại gần nhau (Hình 4.3). Quan sát và nêu hiện tượng xảy ra. Từ đó để xuất phương pháp nhận biết ammonia bằng dung dịch HCl đặc. Phương pháp giải: NH3 (ammonia) là dung dịch có tính base theo thuyết acid – base của Brosted – Lowry. Ammonia dạng khí (hay dung dịch) kết hợp với acid tạo thành muối ammonium. Lời giải chi tiết: Hiện tượng: Khi đưa hai đũa nhúng HCl đặc và NH3 đặc lại gần nhau, xuất hiện khói trắng. Phương pháp nhận biết ammonia: sử dụng HCl đặc. Hiện tượng: xuất hiện khói trắng là muối ammonium chloride (NH4Cl). Phương trình hóa học: NH3 + HCl → NH4Cl CH tr 26 CH1 Cho biết ammonia thể hiện tính chất gì trong phản ứng với acid và oxygen. Phương pháp giải: Theo thuyết acid, base của Bronsted – Lowry: Acid là chất cho H+ (proton), base là chất nhận H+. Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm. Lời giải chi tiết:
CH tr 26 CH2 Dựa vào nguyên lí chuyển dịch cân bằng Le Chatelier, hãy cho biết để tăng hiệu suất phản ứng tổng hợp NH3 cần điều chỉnh nhiệt độ và áp suất như thế nào. Điều đó có gây trở ngại gì cho phản ứng tổng hợp NH3 trên thực tế hay không? Vì sao? Phương pháp giải: Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó. Lời giải chi tiết:
Trong phản ứng tổng hợp NH3: + Phản ứng thuận là phản ứng tỏa nhiệt, theo nguyên lí chuyển dịch cân bằng Le Chatelier, để phản ứng chuyển dịch theo chiều thuận, ta cần giảm nhiệt. Tuy nhiên, khi thực hiện phản ứng ở nhiệt độ quá thấp thì tốc độ của phản ứng nhỏ, phản ứng diễn ra chậm. Do đó người ta chọn nhiệt độ khoảng 380 °C – 450 °C. + Phản ứng thuận là phản ứng làm giảm số mol khí, theo nguyên lí chuyển dịch cân bằng Le Chatelier, để phản ứng chuyển dịch theo chiều thuận, ta cần tăng áp suất. Trên thực tế, người ta thực hiện phản ứng trên ở áp suất 25 bar – 200 bar. CH tr 27 CH1 Quan sát Hình 4.5, cho biết trạng thái, màu sắc của muối ammonium chloride và đặc tính liên kết của phân tử. Phương pháp giải: Liên kết ion được tạo thành bởi lực hút tĩnh điện của các ion mang điện tích trái dấu. Lời giải chi tiết: Muối ammoium chloride ở trạng thái rắn, màu trắng. Phân tử chứa liên kết ion được tạo bởi ion ammonium (NH4+) và chloride (Cl-). Muối ammonium là tinh thể ion. CH tr 27 CH2 Quan sát Thí nghiệm, nếu hiện tượng xảy ra. Giải thích. Viết phương trình hoá học khi cho NH4Cl, NH4NO3, (NH4)2SO4 tác dụng với dung dịch NaOH Phương pháp giải: Dung dịch ammonium phản ứng với dung dịch base, đun nóng sinh ra khí ammonia. NH3 (ammonia) là dung dịch có tính base theo thuyết acid – base của Brosted – Lowry. Dung dịch ammonia làm quỳ tím hóa xanh, phenolphthalein hóa hồng. Lời giải chi tiết: Hiện tượng: Khi đun nóng dung dịch muối ammonium với NaOH đặc, xuất hiện khí có mùi khai, xốc. Đặt mẩu quỳ tím ẩm lên miệng ống nghiệm, quỳ tím hóa xanh. Giải thích: Khi đun nóng dung dịch muối ammonium với NaOH đặc, sinh ra khí ammonia có mùi khai, xốc. Khí ammonia tiếp xúc với nước trong quỳ tím ẩm, ammonia nhận H+ của nước, tạo thành ion ammonium (), dung dịch có tính base yếu, làm giấy quỳ tím hóa xanh.
CH tr 28 CH1 Đun nóng NH4Cl (Hình 4.6) thấy có hiện tượng khói trắng trong ống nghiệm. Giải thích. Phương pháp giải: Muối ammonium dễ bị phân hủy khi đun nóng. Muối ammoium chloride ở trạng thái rắn, màu trắng. Lời giải chi tiết:
CH tr 28 CH2 Viết phương trình hoá học khi cho dung dịch (NH4)2CO3 tác dụng với các dung dịch KOH, HCl, Ba(OH)2, CaCl2. Phương pháp giải: - Phản ứng trao đổi là một loại phản ứng hoá học, trong đó hai hợp chất tham gia trao đổi cho nhau thành phần cấu tạo của nó mà không làm thay đổi chỉ số oxi hóa. - Điều kiện: + Hai chất tham gia phản ứng: đều là dung dịch (nếu là chất không tan thì chỉ tác dụng với acid). + Sản phẩm: có chất kết tủa hoặc chất bay hơi hoặc chất điện li yếu. - Phản ứng giữa (NH4)2CO3 và các dung dịch KOH, HCl, Ba(OH)2, CaCl2 thuộc phản ứng trao đổi Lời giải chi tiết:
CH tr 28 CH3 NH4HCO3 thường được dùng làm bột nở trong sản xuất bánh bao. Giải thích. Phương pháp giải: Muối ammonium dễ bị phân hủy khi đun nóng. Lời giải chi tiết:
CH tr 28 CH4 Tìm hiểu thông tin và nêu một số ứng dụng của ammonia trong đời sống và sản xuất. Phương pháp giải: Muối ammonia được sử dụng rộng rãi trong đời sống và sản xuất. Lời giải chi tiết: Một số ứng dụng của ammonia: - Dùng trong hệ thống làm lạnh trong công nghiệp. - Sản xuất nitric acid (HNO3). - Sản xuất phân đạm: NH4Cl, NH4NO3, (NH4)2SO4,… phân urea: (NH2)2CO. - Thuốc nhuộm, chất cọ rửa bông, len và lụa. - Ngành công nghiệp dầu khí sử dụng ammonia trung hòa các thành phần acid của dầu thô, bảo vệ thiết bị không bị ăn mòn. - Sử dụng trong ngành công nghiệp khai thác các kim loại như copper, nickel từ quặng CH tr 29 CH1 Hãy giải thích vì sao các loại phân bón như NH4Cl, NH4NO3, (NH4)2SO4 không thích hợp bón cho đất chua. Phương pháp giải: Theo thuyết acid, base của Bronsted – Lowry: Acid là chất cho H+ (proton), base là chất nhận H+. Đất chua có môi trường acid: pH < 7. [H+] > [OH-] Lời giải chi tiết:
Muối ammonia dễ tan trong nước, khi bón phân chứa NH4Cl, NH4NO3, (NH4)2SO4các muối này phân li tạo ra ion NH4+. Ví dụ: NH4NO3 phân li tạo
Ion ammonium (NH4+) là một acid yếu, tạo môi trường acid, làm đất chua hơn.
CH tr 29 BT1
Liên kết hoá học trong phân tử NH3là liên kết
A. cộng hoá trị có cực. C. cộng hoá trị không cực. B. ion. D. kim loại. Phương pháp giải: - Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. - Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung. + Liên kết cộng hóa trị không phân cực là liên kết cộng hóa trị trong đó cặp electron chung không lệch về phía nguyên tử nào. + Liên kết cộng hóa trị phân cực là liên kết cộng hóa trị trong đó cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn. - Liên kết kim loại: là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của electron tự do Lời giải chi tiết: Liên kết trong phân tử NH3 được hình thành bởi cặp electron dùng chung giữa nguyên tử N và các nguyên tử H. Do độ âm của N lớn hơn độ âm điện của H nên cặp electron dùng chung bị lệch về phía N. Liên kết hoá học trong phân tử NH3 là liên kết cộng hóa trị phân cực.
→ Chọn A. - Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. - Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung. + Liên kết cộng hóa trị không phân cực là liên kết cộng hóa trị trong đó cặp electron chung không lệch về phía nguyên tử nào. + Liên kết cộng hóa trị phân cực là liên kết cộng hóa trị trong đó cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn. - Liên kết kim loại: là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của electron tự do
CH tr 29 BT2 Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một chất khí. Chất khí đó là A. NH3. B. H2. C. NO2. D. NO. Phương pháp giải: Dung dịch ammonium phản ứng với dung dịch base, đun nóng sinh ra khí ammonia. Lời giải chi tiết: → Chọn A. CH tr 29 BT3 Khi thải rác thải sinh hoạt chứa một lượng lớn ion ammonium vào ao, hồ sẽ xảy ra quá trình oxi hoá ammonium thành ion nitrate dưới tác dụng của vi khuẩn. Quá trình này làm giảm oxygen hoà tan trong nước, gây ngạt cho sinh vật sống dưới nước. Người ta phải xử lí nguồn nước gây ô nhiễm đó bằng cách chuyển ion ammonium thành ammonia, rồi chuyển tiếp thành nitrogen không độc. Hãy đề xuất một số hóa chất để thực hiện quá trình trên và viết phương trình hoá học của các phản ứng xảy ra. Phương pháp giải: Dung dịch ammonium phản ứng với dung dịch base, đun nóng sinh ra khí ammonia. Oxi hóa ammonia để thu được nitrogen. Lời giải chi tiết:
CH tr 29 BT4 Cho cân bằng hoá học: Cân bằng chuyển a) tăng nhiệt độ. b) tách ammonia ra khỏi hỗn hợp phản ứng. c) giảm thể tích của hệ phản ứng. Phương pháp giải: Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó. Lời giải chi tiết: a) Phản ứng thuận là phản ứng tỏa nhiệt, phản ứng nghịch là phản ứng thu nhiệt. Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ (chiều tỏa nhiệt) → Cân bằng chuyển dịch theo chiều nghịch. b) Tách ammonia ra khỏi hỗn hợp phản ứng, làm giảm nồng độ ammonia. Cân bằng chuyển dịch theo chiều làm tăng nồng độ ammonia → Cân bằng chuyển dịch theo chiều thuận. c) Giảm thể tích của hệ phản ứng tức là tăng áp suất của hệ. Cân bằng chuyển dịch theo chiều làm giảm áp suất của hệ (chiều giảm số mol khí) → Cân bằng chuyển dịch theo chiều thuận. CH tr 29 BT5 Viết phương trình hoá học của các phản ứng xảy ra khi cho dung dịch (NH4)2SO4 tác dụng với dung dịch NaOH, dung dịch Ba(OH)2, dung dịch BaCl2, dung dịch Ba(NO3)2. Phương pháp giải: - Phản ứng trao đổi là một loại phản ứng hoá học, trong đó hai hợp chất tham gia trao đổi cho nhau thành phần cấu tạo của nó mà không làm thay đổi chỉ số oxi hóa. - Điều kiện: + Hai chất tham gia phản ứng: đều là dung dịch (nếu là chất không tan thì chỉ tác dụng với acid). + Sản phẩm: có chất kết tủa hoặc chất bay hơi hoặc chất điện li yếu. - Phản ứng giữa (NH4)2SO4 với dung dịch NaOH, dung dịch Ba(OH)2, dung dịch BaCl2, dung dịch Ba(NO3)2 thuộc phản ứng trao đổi Lời giải chi tiết:
Lý thuyết >> Xem chi tiết: Lý thuyết Ammonia và một số hợp chất ammonium - Hóa học 11 - Chân trời sáng tạo
|
















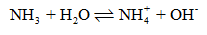
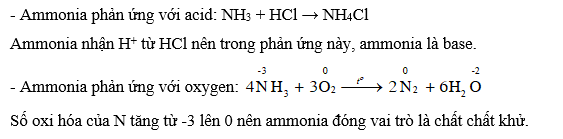



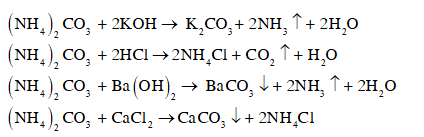


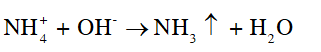

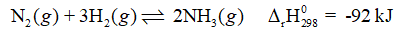 dịch theo chiều nào (có giải thích) khi:
dịch theo chiều nào (có giải thích) khi:






Danh sách bình luận