Bài 19.7, 19.8, 19.9 trang 47 SBT Hóa học 10Giải bài 19.7, 19.8, 19.9 trang 47 sách bài tập Hóa học 10. Trong phản ứng : Số phân tử HCl đóng vai trò chất khử bằng k lần tổng số phân tử HCl tham gia phản ứng. Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Câu 19.7. Trong phản ứng : Số phân tử HCl đóng vai trò chất khử bằng k lần tổng số phân tử HCl tham gia phản ứng. Giá trị của k là \(\begin{array}{l} Phương pháp giải: Viết quá trình khử, oxi hóa và cân bằng PTHH theo phương pháp thăng bằng electron. Lời giải chi tiết: \({K_2}C{r_2}{O_7} + 14HCl\xrightarrow{{{t^o}}}2CrC{l_3} + 3C{l_2} + 2KCl + {H_2}O\) \( \Rightarrow k = \dfrac{6}{{14}} = \dfrac{3}{7}\) => Chọn D Câu 19.8. Cho phán ứng : \(Fe{S_2} + HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + {H_2}S{O_4} + NO \uparrow + {H_2}O\) Hệ số tối giản của \(HNO_3\) và \(H_2SO_4\) trong phản ứng trên lần lượt là A.12;4. B. 16 ; 4. C.10; 6. D. 8 ; 2. Phương pháp giải: Viết quá trình khử, oxi hóa và cân bằng PTHH theo phương pháp thăng bằng electron. Lời giải chi tiết: \(Fe{S_2} + 8HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + 2{H_2}S{O_4} + 5NO \uparrow + 2{H_2}O\) => Chọn D Câu 19.9. Trong phản ứng đốt cháy \(CuFeS_2\) tạo ra sản phẩm \(CuO, Fe_2O_3\) và \(SO_2\) thì một phân tử \(CuFeS_2\) sẽ A. nhận 13e. B. nhận 12e. C. nhường 13e. D. nhường 12e. Phương pháp giải: Viết quá trình oxi hóa của \(CuFeS_2\) Lời giải chi tiết: \(\mathop {CuFe{S_2}}\limits^0 \to \mathop {Cu}\limits^{ + 2} + \mathop {Fe}\limits^{ + 3} + 2\mathop S\limits^{ + 4} + 13e\) => 1 phân tử \(CuFeS_2\) nhường 13e => Chọn C Loigiaihay.com
|














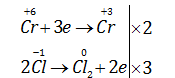
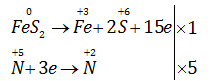






Danh sách bình luận