Đề thi học kì 1 Hóa 8 - Đề số 5Đề bài
Câu 1 :
Công thức hóa học của khí metan, biết trong phân tử có 1C và 4H là
Câu 2 :
Trong các hiện tượng sau, đâu là hiện tượng hóa học?
Câu 3 :
Trong phản ứng: Magie + axit sunfuric → magie sunfat + khí hiđro. Magie sunfat là
Câu 4 :
Khí A có công thức phân tử dạng RO2, có tỉ khối hơi so với H2 là 32. Vậy A có công thức phân tử là:
Câu 5 :
Thành phần phần trăm khối lượng của nguyên tố Na có trong Na2SO4 là
Câu 6 :
Một hợp chất khí A có thành phần về khối lượng của các nguyên tố là 40% S và 60% O. Hãy xác định công thức hóa học của hợp chất khí A biết A có tỉ khối so với khí H2 là 40?
Câu 7 :
Cho 2,4 gam Mg vào dung dịch chứa 0,3 mol HCl. Tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn. Biết phương trình hóa học của phản ứng là: Mg + 2HCl → MgCl2 + H2
Câu 8 :
Nước sông hồ thuộc loại:
Câu 9 :
Hợp chất A trong phân tử gồm có 1X, 1S, 4O liên kết với nhau (X là nguyên tố chưa biết), biết nguyên tử X có khối lượng bằng 5/4 lần phân tử khí oxi. Tìm CTHH của A
Câu 10 :
Một hợp chất của nguyên tố M (hóa trị II) và O có phân tử khối là 40. CTHH của hợp chất đó là
Câu 11 :
Sắp xếp đúng trình tự các bước lập PTHH: 1) Viết PTHH 2) Cân bằng số nguyên tử của từng nguyên tố : tìm hệ số thích hợp đặt trước CTHH 3) Viết sơ đồ phản ứng là phương trình chữ của chất tham gia và sản phẩm 4) Viết sơ đồ phản ứng gồm CTHH của các chất tham gia và các sản phẩm
Câu 12 :
Khi đun nóng, đường bị phân hủy, biến đổi thành than và nước. Như vậy, phân tử đường do những nguyên tử của nguyên tố nào tạo nên? Đường là đơn chất hay hợp chất?
Câu 13 :
Hỗn hợp có thể tách riêng các chất thành phần bằng phương pháp lọc là:
Câu 14 :
Những nguyên tố tạo nên Canxi cacbonat có trong vỏ trứng là:
Câu 15 :
Kí hiệu hoá học của sắt là:
Câu 16 :
Một đơn vị cacbon (1 đvC) có khối lượng bằng
Câu 17 :
Khối lượng nguyên tử được coi bằng
Câu 18 :
Khí clo do nguyên tố clo tạo nên; muối ăn do kim loại natri và clo tạo nên; muối natri hipoclorơ do 3 nguyên tố: natri, clo và oxi tạo nên. Nguyên tố nào cho dưới đây là nguyên liệu cấu tạo chung của các chất này?
Câu 19 :
Hợp chất của kim loại M với nhóm SO4 có công thức là M2(SO4)3. PTK = 342. Tính toán để xác định M là nguyên tố nào?
Câu 20 :
Chất có PTK bằng nhau là (biết O = 16, N = 14, S = 32, C = 12)
Câu 21 :
Công thức hoá học phù hợp của Si(IV) là:
Câu 22 :
Cho biết CTHH của X với H là H3X, của Y với O là YO.Chọn CTHH nào đúng cho hợp chất X và Y:
Câu 23 :
Làm thế nào để biết có phản ứng xảy ra?
Câu 24 :
Cho hỗn hợp gồm hai muối A2SO4 và BSO4 có khối lượng 44,2 g tác dụng vừa đủ với 62,4 g BaCl2 trong dung dịch thì cho 69,9 g kết tủa BaSO4 và 2 muối tan. Khối lượng 2 muối tan sau phản ứng là:
Câu 25 :
Thể tích của 280g khí Nitơ ở đktc là:
Câu 26 :
Tính khối lượng khí H2 có trong 6,72 lít khí H₂(đo ở đktc)?
Câu 27 :
Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là
Câu 28 :
Nước tự nhiên là:
Câu 29 :
Ngtử của nguyên tố Y được cấu tạo bởi 36 hạt .Trong hạt nhân, hạt mang điện dương bằng số hạt không mang điện. Số proton có trong hạt nhân nguyên tử A là?
Câu 30 :
Nguyên tử X có tổng số hạt là 21. Số hạt không mang điện chiếm 33,33%. Xác định p, n, e của X.
Câu 31 :
Dãy nào gồm các chất là đơn chất?
Câu 32 :
Quá trình nào sau đây là hiện tượng vật lí?
Câu 33 :
Cho phương trình hóa học: AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2 Sử dụng phương pháp cân bằng kim loại – phi kim cân bằng phương trình trên và cho biết tỉ lệ hệ số các chất trong phương trình lần lượt là:
Câu 34 :
Trong các mệnh đề sau, mệnh đề nào phản ánh bản chất của định luật bảo toàn khối lượng? 1. Trong phản ứng hoá học nguyên tử được bảo toàn, không tự nhiên sinh ra và cũng không tự nhiên mất đi. 2. Tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất phản ứng. 3. Trong phản ứng hoá học, nguyên tử không bị phân chia. 4. Số phần tử các chất sản phẩm bằng số phần tử các chất phản ứng.
Câu 35 :
Hoà tan hoàn toàn 5,6 gam Fe trong dung dịch HCl, sau phản ứng thu được FeCl2 và khí H2. a. Tính khối lượng FeCl2 thu được sau phản ứng. b. Tính số mol HCl đã tham gia phản ứng.
Lời giải và đáp án
Câu 1 :
Công thức hóa học của khí metan, biết trong phân tử có 1C và 4H là
Đáp án : C Lời giải chi tiết :
Công thức hóa học của khí metan, biết trong phân tử có 1C và 4H là CH4
Câu 2 :
Trong các hiện tượng sau, đâu là hiện tượng hóa học?
Đáp án : C Lời giải chi tiết :
Hiện tượng hóa học là: “Ma trơi” là ánh sáng màu đỏ thường được nhìn thấy vào ban đêm do photphin (PH3) cháy trong không khí. Vì photphin tác dụng với oxi tỏa nhiệt và tạo ra ánh sáng màu đỏ.
Câu 3 :
Trong phản ứng: Magie + axit sunfuric → magie sunfat + khí hiđro. Magie sunfat là
Đáp án : B Lời giải chi tiết :
Magie + axit sunfuric → magie sunfat + khí hiđro (chất tham gia) (sản phẩm) => magie sunfat là chất sản phẩm
Câu 4 :
Khí A có công thức phân tử dạng RO2, có tỉ khối hơi so với H2 là 32. Vậy A có công thức phân tử là:
Đáp án : A Phương pháp giải :
+) ${d_{A/{H_2}}} = \frac{{{M_A}}}{{{M_{{H_2}}}}} = > {M_A} = {d_{A/{H_2}}}.{M_{{H_2}}}$ +) A có công thức phân tử là RO2 => M = MR + 2.MO = 64 => MR => nguyên tố R Lời giải chi tiết :
Khí A có tỉ khối so với H2 là 32 => ${d_{A/{H_2}}} = \frac{{{M_A}}}{{{M_{{H_2}}}}} = > {M_A} = {d_{A/{H_2}}}.{M_{{H_2}}} = 32.2 = 64$ A có công thức phân tử là RO2 => M = MR + 2.MO = 64 => MR = 64 – 2.16 = 32 => R là nguyên tố S Vậy công thức phân tử của A là SO2
Câu 5 :
Thành phần phần trăm khối lượng của nguyên tố Na có trong Na2SO4 là
Đáp án : B Phương pháp giải :
+) Tính ${M_{N{a_2}S{O_4}}}$ +) Trong 1 mol Na2SO4 có 2 mol nguyên tử Na ; 1 mol nguyên tử S và 4 mol nguyên tử O +) $\% {m_{Na}} = \dfrac{{2.{M_{Na}}}}{{{M_{N{a_2}S{O_4}}}}}.100\% $ Lời giải chi tiết :
+) ${M_{N{a_2}S{O_4}}} = 2.23 + 32 + 16.4 = 142$ +) Trong 1 mol Na2SO4 có 2 mol nguyên tử Na ; 1 mol nguyên tử S và 4 mol nguyên tử O +) $\% {m_{Na}} = \dfrac{{2.{M_{Na}}}}{{{M_{N{a_2}S{O_4}}}}}.100\% $$ = \dfrac{{2.23}}{{142}}.100\% = 32,39\% $
Câu 6 :
Một hợp chất khí A có thành phần về khối lượng của các nguyên tố là 40% S và 60% O. Hãy xác định công thức hóa học của hợp chất khí A biết A có tỉ khối so với khí H2 là 40?
Đáp án : C Phương pháp giải :
+) Gọi công thức hóa học cần tìm của A là SxOy +) Từ tỉ lệ $ \dfrac{{\% {m_S}}}{{\% {m_O}}} = > \dfrac{x}{y}$ (1) +) A có tỉ khối so với khí H2 là 40 => MA = 40.MH2 = 80 => ${M_{{S_x}{O_y}}} = PT(2)$
Lời giải chi tiết :
Gọi công thức hóa học cần tìm của A là SxOy Ta có: $\% {m_S} = \dfrac{{32{\text{x}}}}{{32{\text{x}} + 16y}}.100\% = 40\% $ và $\% {m_O} = \dfrac{{16y}}{{32{\text{x}} + 16y}}.100\% = 60\% $ $ = > \dfrac{{\% {m_S}}}{{\% {m_O}}} = \dfrac{{\dfrac{{32{\text{x}}}}{{32{\text{x}} + 16y}}}}{{\dfrac{{16y}}{{32{\text{x}} + 16y}}}} = \dfrac{{40\% }}{{60\% }} = > \dfrac{{32{\text{x}}}}{{16y}} = \dfrac{2}{3} = > \dfrac{x}{y} = \dfrac{1}{3}$ (1) +) A có tỉ khối so với khí H2 là 40 => MA = 40.MH2 = 80 => ${M_{{S_x}{O_y}}} = 32{\text{x}} + 16y = 80\,\,\,(2)$ Từ (1) và (2) => x = 1 và y = 3 Vậy công thức hóa học của A là SO3
Câu 7 :
Cho 2,4 gam Mg vào dung dịch chứa 0,3 mol HCl. Tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn. Biết phương trình hóa học của phản ứng là: Mg + 2HCl → MgCl2 + H2
Đáp án : A Phương pháp giải :
+) Tính số mol Mg +) Viết PTHH +) Xét tỉ lệ: $\dfrac{{{n_{Mg}}}}{1}$ và $\dfrac{{{n_{HCl}}}}{2}$ => chất dư, chất hết => tính H2 theo chất hết Lời giải chi tiết :
Số mol Mg là: ${n_{Mg}} = \dfrac{{2,4}}{{24}} = 0,1(mol)$ PTHH: Mg + 2HCl → MgCl2 + H2 Xét tỉ lệ: $\dfrac{{{n_{Mg}}}}{1} = \dfrac{{0,1}}{1} = 0,1$ và $\dfrac{{{n_{HCl}}}}{2} = \dfrac{{0,3}}{2} = 0,15$ Vì 0,1 < 0,15 => Mg phản ứng hết, HCl dư => phản ứng tính theo Mg 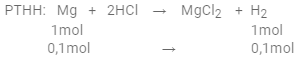 $ = > {V_{{H_2}}} = 0,1.22,4 = 2,24(l)$
Câu 8 :
Nước sông hồ thuộc loại:
Đáp án : D Lời giải chi tiết :
Nước sông hồ thuộc loại: hỗn hợp
Câu 9 :
Hợp chất A trong phân tử gồm có 1X, 1S, 4O liên kết với nhau (X là nguyên tố chưa biết), biết nguyên tử X có khối lượng bằng 5/4 lần phân tử khí oxi. Tìm CTHH của A
Đáp án : D Phương pháp giải :
Bước 1: Gọi công thức hóa học tổng quát của A là XSO4 Bước 2: \(Vì\,\,{M_X}\,\, = \,\,\frac{5}{4}.{M_{{O_2}}}\) Dựa vào phân tử khối của O2 \( \Rightarrow \) Nguyên tử khối của X \( \Rightarrow \) Xác định được NTHH. Bước 3: Kết luận CTHH phù hợp. Lời giải chi tiết :
Gọi công thức hóa học của A là: XSO4 Phân tử khí oxi có ${M_{{O_2}}} = 16.2 = 32$ đvC $ \Rightarrow {M_X} = \dfrac{5}{4}.32 = 40$ đvC => X là nguyên tố Ca => Công thức hóa học của hợp chất A là: CaSO4
Câu 10 :
Một hợp chất của nguyên tố M (hóa trị II) và O có phân tử khối là 40. CTHH của hợp chất đó là
Đáp án : A Phương pháp giải :
Bước 1: Lập công thức hóa học của nguyên tố M (hóa trị II) với O Bước 2: Lập phương trình tính phân tử khối của hợp chất => tính nguyên tử khối của M Bước 3: Tìm M và kết luận CTHH Lời giải chi tiết :
Theo bài ra, M có hóa trị II CTHH của hợp chất cần tìm có dạng: MO Ta có: ${M_M} + {M_O} = 40$ $ \Leftrightarrow {M_M} = 40 - 16 = 24$ $ \Rightarrow $ M là Mg $ \Rightarrow $ Công thức hóa học của hợp chất cần tìm là: MgO
Câu 11 :
Sắp xếp đúng trình tự các bước lập PTHH: 1) Viết PTHH 2) Cân bằng số nguyên tử của từng nguyên tố : tìm hệ số thích hợp đặt trước CTHH 3) Viết sơ đồ phản ứng là phương trình chữ của chất tham gia và sản phẩm 4) Viết sơ đồ phản ứng gồm CTHH của các chất tham gia và các sản phẩm
Đáp án : C Lời giải chi tiết :
Bước 1: Viết sơ đồ phản ứng, gồm công thức hóa học của chất tham gia, sản phẩm. Bước 2: Cân bằng số nguyên tử mỗi nguyên tố: tìm hệ số thích hợp đặt trước các công thức sao cho số nguyên tử các nguyên tố ở chất tham gia và chất tạo thành là bằng nhau. Bước 3: Viết thành phương trình hóa học. => Thứ tự đúng là: 4, 2, 1
Câu 12 :
Khi đun nóng, đường bị phân hủy, biến đổi thành than và nước. Như vậy, phân tử đường do những nguyên tử của nguyên tố nào tạo nên? Đường là đơn chất hay hợp chất?
Đáp án : D Lời giải chi tiết :
Khi đun nóng, đường bị phân hủy thành than (C) và nước (H2O) => trong phân tử đường chứa 2 nguyên tố C, H và O => Đường là hợp chất
Câu 13 :
Hỗn hợp có thể tách riêng các chất thành phần bằng phương pháp lọc là:
Đáp án : C Phương pháp giải :
Tách được 2 chất trong hỗn hợp có: 1 chất tan trong nước, còn 1 chất thì không tan Lời giải chi tiết :
Cát và muối hòa tan vào trong nước dư \( \to\) lọc phần chất rắn không tan thu được cát Dung dịch nước muối thu được ta đem chưng cất để làm bay hơi hết nước đi \( \to\) thu được muối khan Do vậy tách riêng được cát và muối
Câu 14 :
Những nguyên tố tạo nên Canxi cacbonat có trong vỏ trứng là:
Đáp án : B Lời giải chi tiết :
Canxi cacbonat có công thức hóa học là: CaCO3 => được tạo nên từ các nguyên tố: Ca, C, O
Câu 15 :
Kí hiệu hoá học của sắt là:
Đáp án : D Lời giải chi tiết :
Al là kí hiệu của nguyên tố nhôm Ba là kí hiệu của nguyên tố bari Ca là kí hiệu của nguyên tố canxi Fe là kí hiệu của nguyên tố sắt
Câu 16 :
Một đơn vị cacbon (1 đvC) có khối lượng bằng
Đáp án : B Phương pháp giải :
Khối lượng của 1 nguyên tử C bằng 1,9926.10-23 gam 1 đvC = \(\dfrac{1}{{12}}\) khối lượng nguyên tử C Lời giải chi tiết :
Khối lượng của 1 nguyên tử C bằng 1,9926.10-23 gam 1 đvC = \(\dfrac{1}{{12}}\) khối lượng nguyên tử C \( = \dfrac{1}{{12}}.1,{9926.10^{ - 23}}\,\,(gam) = 1,{6605.10^{ - 24}}\,\,(gam)\)
Câu 17 :
Khối lượng nguyên tử được coi bằng
Đáp án : B Lời giải chi tiết :
Khối lượng nguyên tử được coi bằng khối lượng của proton và khối lượng của nơtron vì electron có khối lượng rất nhỏ nên bỏ qua
Câu 18 :
Khí clo do nguyên tố clo tạo nên; muối ăn do kim loại natri và clo tạo nên; muối natri hipoclorơ do 3 nguyên tố: natri, clo và oxi tạo nên. Nguyên tố nào cho dưới đây là nguyên liệu cấu tạo chung của các chất này?
Đáp án : D Phương pháp giải :
Chọn nguyên tố nào chung được tạo thành trong các chất Lời giải chi tiết :
3 chất trên cùng được tạo nên bởi nguyên tố clo
Câu 19 :
Hợp chất của kim loại M với nhóm SO4 có công thức là M2(SO4)3. PTK = 342. Tính toán để xác định M là nguyên tố nào?
Đáp án : C Phương pháp giải :
Phân tử khối của M2(SO4)3 = 342 (g/mol) =>2M + 3×(32 + 4×16) = 342 => M = ? + Tra bảng 1 SGK/ 42 g Tên và kí hiệu hóa học của nguyên tố M Lời giải chi tiết :
Phân tử khối của M2(SO4)3 = 342 (g/mol) =>2M + 3×(32 + 4×16) = 342 => 2M + 288 = 342 => 2M= 52 => M = 52 :2 = 27 + Tra bảng 1 SGK/ 42 g M là nguyên tố Nhôm (Al).
Câu 20 :
Chất có PTK bằng nhau là (biết O = 16, N = 14, S = 32, C = 12)
Đáp án : B Lời giải chi tiết :
PTK của các chất: O3: 16.3 = 48; N2: 14.2 = 28; CO: 12 + 16 = 28; SO2: 32 + 16.2 = 64; O2: 16.2 = 32; NO2: 14 + 16.2 = 46
Câu 21 :
Công thức hoá học phù hợp của Si(IV) là:
Đáp án : B Phương pháp giải :
Áp dụng biểu thức tính hóa trị: \[\mathop {{A_x}}\limits^a \mathop {{B_y}}\limits^b \Rightarrow a.x = b.y\] Lời giải chi tiết :
Gọi công thức Si với O là SixOy Ta có: \[\mathop {S{i_x}}\limits^{IV} \mathop {{O_y}}\limits^{II} \Rightarrow x.IV = y.II \Rightarrow \dfrac{x}{y} = \dfrac{{II}}{{IV}} = \dfrac{1}{2}\] => SiO2
Câu 22 :
Cho biết CTHH của X với H là H3X, của Y với O là YO.Chọn CTHH nào đúng cho hợp chất X và Y:
Đáp án : C Phương pháp giải :
Áp dụng biểu thức tính hóa trị: \[\mathop {{A_x}}\limits^a \mathop {{B_y}}\limits^b \Rightarrow a.x = b.y\] Lời giải chi tiết :
Gọi hóa trị của X, Y lần lượt là a, b Ta có: \[\mathop {{H_3}}\limits^I \mathop X\limits^a \Rightarrow I.3 = a.1 \Rightarrow a = III\] \[\mathop Y\limits^b \mathop O\limits^{II} \Rightarrow b.1 = II.1 \Rightarrow b = II\] Gọi công thức của X và Y là XxYy Ta có: \[\mathop {{X_x}}\limits^{III} \mathop {{Y_y}}\limits^{II} \Rightarrow x.III = y.II \Rightarrow \frac{x}{y} = \frac{{II}}{{III}} = \frac{2}{3} \Rightarrow {X_2}{Y_3}\]
Câu 23 :
Làm thế nào để biết có phản ứng xảy ra?
Đáp án : D Lời giải chi tiết :
Để biết có phản ứng xảy ra, ta dựa vào dấu hiệu có chất mới tạo thành, như + Thay đổi màu sắc + Tạo chất bay hơi hoặc chất kết tủa + Tỏa nhiệt hoặc phát sáng
Câu 24 :
Cho hỗn hợp gồm hai muối A2SO4 và BSO4 có khối lượng 44,2 g tác dụng vừa đủ với 62,4 g BaCl2 trong dung dịch thì cho 69,9 g kết tủa BaSO4 và 2 muối tan. Khối lượng 2 muối tan sau phản ứng là:
Đáp án : B Lời giải chi tiết :
Áp dụng định luật bảo toàn khối lượng mA2SO4 + mBSO4 + mBaCl2 = mBaSO4 + m muối tan => m muối tan = mA2SO4 + mBSO4 + mBaCl2 - mBaSO4 = 44,2 + 62,4 – 69,9 = 36,7g
Câu 25 :
Thể tích của 280g khí Nitơ ở đktc là:
Đáp án : C Phương pháp giải :
Áp dụng công thức tính số mol và thể tích khí ở điều kiện tiêu chuẩn \(n = \dfrac{m}{M}\) \(V = n.22,4\) Lời giải chi tiết :
m N2 = 280 g; MN2= 28 g/mol => nN2 = 10 mol VN2 = 22,4 . nN2= 10 . 22,4 = 224 lít
Câu 26 :
Tính khối lượng khí H2 có trong 6,72 lít khí H₂(đo ở đktc)?
Đáp án : A Lời giải chi tiết :
1 mol phân tử H2 (đo ở đktc) chiếm thể tích 22,4 lít X mol phân tử H2 (đo ở đktc) chiếm thể tích 6,72 lít \( \to x = \dfrac{{1.6,72}}{{22,4}} = 0,3\,\,mol\) \({M_{{H_2}}} = 2.1 = 2\,\,g/mol\) 1 mol phân tử H2 có khối lượng là 2 gam 0,3 mol phân tử H2 có khối lượng là x gam \( \to x = \dfrac{{0,3.2}}{1} = 0,6\,\,gam\)
Câu 27 :
Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là
Đáp án : D Phương pháp giải :
Áp dụng công thức V =22,4.n Lời giải chi tiết :
Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là V = (0,5 +0,2).22,4 =15,68 lít
Câu 28 :
Nước tự nhiên là:
Đáp án : B Lời giải chi tiết :
Nước tự nhiên là: 1 hỗn hợp gồm nước có hòa tan lẫn muối và các chất khoáng
Câu 29 :
Ngtử của nguyên tố Y được cấu tạo bởi 36 hạt .Trong hạt nhân, hạt mang điện dương bằng số hạt không mang điện. Số proton có trong hạt nhân nguyên tử A là?
Đáp án : A Phương pháp giải :
Tổng số hạt của nguyên tử là p, n, e → lập phương trình với dữ kiện 36 Trong hạt nhân, hạt không mang điện là n; hạt mang điện là p → lập được phương trình hóa học hai hạt bằng nhau. giải ra được p và n. Từ đó tính được: Z = số p ; số khối A = p + n =? Lời giải chi tiết :
Đặt số proton, notron của nguyên tử Y lần lượt là p và n Nguyên tử trung hòa về điện nên số e = số p = p (hạt) Tổng số hạt trong Y là 36 → p + e + n = 36 hay 2p + n = 36 (1) Trong hạt nhân, hạt mang điện dương bằng hạt không mang điện nên: p = n (2) Từ (1) và (2) ta có hệ phương trình: \(\left\{ \begin{array}{l}2p + n = 36\\p = n\end{array} \right. \Rightarrow p = n = \frac{{36}}{3} = 12\) (hạt)
Câu 30 :
Nguyên tử X có tổng số hạt là 21. Số hạt không mang điện chiếm 33,33%. Xác định p, n, e của X.
Đáp án : A Phương pháp giải :
Gọi số proton = số electron = p Số notron = n Tổng số hạt của nguyên tử X = 21 => 2p + n = 21 (1) Số hạt không mang điện trong X chiếm 33,33% nên n= \({{33,33\% } \over {100\% }}.21 = ?\) Thay n đã tìm được vào phương trình (1) => p = ? Lời giải chi tiết :
Gọi số hạt proton và notron của X lần lượt là p, n Vì số hạt proton bằng số hạt electron nên só electron của X cũng là p Tổng số hạt của X là 21 suy ra 2p + n =21 (1) Số hạt không mang điện trong X chiếm 33,33% nên n=\({{33,33\% } \over {100\% }}.21 = 7\) Thay n=7 vào phương trình (1) => 2p + 7 = 21 => 2p = 14 => p = 7 Số hạt p, n,e của X lần lượt là 7,7,7
Câu 31 :
Dãy nào gồm các chất là đơn chất?
Đáp án : B Phương pháp giải :
Dựa vào khái niệm đơn chất và hợp chất – sgk hóa 8 – trang 22 Lời giải chi tiết :
A chỉ có chứa Cl2 là đơn chất B chỉ chứa đơn chất C chỉ chứa hợp chất D chứa Cl2 là đơn chất
Câu 32 :
Quá trình nào sau đây là hiện tượng vật lí?
Đáp án : A Lời giải chi tiết :
A là hiện tượng vật lý B,C,D là hiện tượng hóa học
Câu 33 :
Cho phương trình hóa học: AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2 Sử dụng phương pháp cân bằng kim loại – phi kim cân bằng phương trình trên và cho biết tỉ lệ hệ số các chất trong phương trình lần lượt là:
Đáp án : B Phương pháp giải :
Cân bằng theo thứ tự O, Ag, N. Lời giải chi tiết :
PTHH: AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2 - Đầu tiên ta cân bằng nguyên tố O - Ta thấy ở VP có tổng 4 nguyên tử trong NO2 và O2 còn VT có 3 nguyên tử O trong AgNO3 → cần làm chẵn số nguyên tử O ở VT bằng cách đặt 2 trước AgNO3. => 2AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2 - Tiếp theo ta thấy VT có 2 nguyên tử Ag trong AgNO3 còn VP chỉ có 1 nguyên tử Ag → Đặt hệ số 2 trước Ag. => 2AgNO3 \(\xrightarrow{{{t^0}}}\) 2Ag + NO2 + O2 - Tương tự ta thấy VT có 2 nguyên tử N trong AgNO3 còn VP chỉ có 1 nguyên tử N → Đặt hệ số 2 trước NO2. => 2AgNO3 \(\xrightarrow{{{t^0}}}\) 2Ag + 2NO2 + O2 Vậy sau khi cân bằng hệ số các chất trong phương trình lần lượt là 2:2:2:1
Câu 34 :
Trong các mệnh đề sau, mệnh đề nào phản ánh bản chất của định luật bảo toàn khối lượng? 1. Trong phản ứng hoá học nguyên tử được bảo toàn, không tự nhiên sinh ra và cũng không tự nhiên mất đi. 2. Tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất phản ứng. 3. Trong phản ứng hoá học, nguyên tử không bị phân chia. 4. Số phần tử các chất sản phẩm bằng số phần tử các chất phản ứng.
Đáp án : D Phương pháp giải :
Ghi nhớ định luật bảo toàn khối lượng. Lời giải chi tiết :
Mệnh đề 1 đúng Mệnh đề 2 đúng Mệnh đề 3 sai vì phản ứng hóa học sẽ phân chia lại sự liên kết giữa các nguyên tử Mệnh đề 4 sai vì số phần từ sản phẩm và phản ứng có thể khác nhau
Câu 35 :
Hoà tan hoàn toàn 5,6 gam Fe trong dung dịch HCl, sau phản ứng thu được FeCl2 và khí H2. a. Tính khối lượng FeCl2 thu được sau phản ứng. b. Tính số mol HCl đã tham gia phản ứng.
Đáp án : B Phương pháp giải :
Viết phương trình hóa học xảy ra, tính toán theo phương trình hóa học. Lời giải chi tiết :
nFe = m : M = 5,6 : 56 = 0,1 (mol) Fe + 2HCl → FeCl2 + H2 1 : 2 : 1 : 1 0,1 → 0,2 → 0,1 → 0,1 a. mFeCl2 = n x M = 0,1 x 127 = 12,7 (g) b. nHCl=0,2 (mol) |



















Danh sách bình luận