Đề thi học kì 1 Hóa 8 - Đề số 4Đề bài
Câu 1 :
Vì sao nguyên tử có khả năng liên kết với nhau?
Câu 2 :
Kí hiệu hóa học của nguyên tố sắt là
Câu 3 :
Cho nguyên tử khối của Bari là 137 đvC. Khối lượng thực nguyên tố trên là
Câu 4 :
Dựa vào dấu hiệu nào sau đây để phân biệt phân tử của đơn chất với phân tử của hợp chất?
Câu 5 :
Chọn đáp án sai
Câu 6 :
Từ công thức hóa học của CuSO4 có thể suy ra được những gì?
Câu 7 :
Dấu hiệu của phản ứng hóa học
Câu 8 :
Cho phương trình hóa học: aP2O5 + bH2O → cH3PO4. Sau khi cân bằng phương trình phản ứng thì giá trị của b là
Câu 9 :
Thể tích 1 mol của hai chất khí bằng nhau nếu được đo ở
Câu 10 :
Dãy gồm các chất khí nhẹ hơn không khí là
Câu 11 :
Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là
Câu 12 :
Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc) là
Câu 13 :
A là hợp chất của nguyên tố M (hóa trị I) và O, trong đó M chiếm 74,2% về khối lượng. Xác định CTHH của A
Câu 14 :
Cho 13,2g hỗn hợp gồm magie, sắt và kẽm cháy trong khí oxi, thu được 18g hỗn hợp chất rắn. Khối lượng oxi tham gia phản ứng là:
Câu 15 :
Trong một phản ứng hóa học, giữa các sản phẩm với các chất phản ứng không có sự thay đổi về
Câu 16 :
Hợp chất được cấu tạo từ nitơ (N) hoá trị II và oxi (O) hoá trị II là:
Câu 17 :
Việc hiểu biết tính chất của chất có lợi gì?
Câu 18 :
Hỗn hợp là sự trộn lẫn của mấy chất với nhau?
Câu 19 :
Mỗi công thức hóa học của một chất cho chúng ta biết
Câu 20 :
Hợp chất B trong phân tử gồm có 1X, 1S, 4O liên kết với nhau (X là nguyên tố chưa biết), biết nguyên tử X có khối lượng bằng 2 lần phân tử khí nitơ. Tìm CTHH của B.
Câu 21 :
Cho các câu sau: a) Than chì là chất dùng làm lõi bút chì b) Xe đạp được chế tạo từ sắt, nhôm, cao su…. Trong 2 câu trên vật thể là:
Câu 22 :
Đốt cháy hoàn toàn m (g) CH4 cần dùng 0,4 (g) khí O2 thu được 1,4 (g) CO2 và 1,6(g) H2O. m có giá trị là:
Câu 23 :
Cho PƯHH: 2HCl + CaCO3 → CaCl2 + H2O + CO2.
Câu 24 :
0,5 mol nguyên tử hyđro có chứa bao nhiêu nguyên tử hyđro?
Câu 25 :
0,25 mol phân tử Al₂O₃ có khối lượng là bao nhiêu?
Câu 26 :
Kim loại M tạo ra hiđroxit M(OH)3. Phân tử khối của hiđroxit là 107 đvC. Nguyên tử khối của M là:
Câu 27 :
Hạt nhân nguyên tử có cấu tạo bởi các loại hạt:
Câu 28 :
Nguyên tử M có số nơtron nhiều hơn số proton là 1 và số hạt mang điện nhiều hơn số hạt không mang điện là 10. Tổng số hạt p và n có trong nguyên tử M là:
Câu 29 :
Dãy nào gồm các chất là đơn chất?
Câu 30 :
Dãy nào gồm các chất là hợp chất?
Câu 31 :
Cho biết CTHH của X với H là H3X, của Y với O là YO.Chọn CTHH nào đúng cho hợp chất X và Y:
Câu 32 :
Hòa tan vôi sống (CaO) vào nước được vôi tôi canxi hiđroxit (Ca(OH)2). Đây là hiện tượng
Câu 33 :
Cho phương trình hóa học: (NH4)2Cr2O7 \(\xrightarrow{{{t^0}}}\) Cr2O3 + N2 + H2O Tổng hệ số các chất trong phương trình hóa học trên sau khi cân bằng là:
Câu 34 :
Cho phương trình hóa học: AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2 Sử dụng phương pháp cân bằng kim loại – phi kim cân bằng phương trình trên và cho biết tỉ lệ hệ số các chất trong phương trình lần lượt là:
Câu 35 :
Ở cùng điều kiện nhiệt độ và áp suất, so sánh thể tích của 4 gam CH4 và 1 gam H2 ta có:
Lời giải và đáp án
Câu 1 :
Vì sao nguyên tử có khả năng liên kết với nhau?
Đáp án : A Lời giải chi tiết :
Nguyên tử có khả năng liên kết với nhau do các lớp electron chuyển động xung quanh hạt nhân
Câu 2 :
Kí hiệu hóa học của nguyên tố sắt là
Đáp án : B Lời giải chi tiết :
Kí hiệu hóa học của nguyên tố sắt là Fe
Câu 3 :
Cho nguyên tử khối của Bari là 137 đvC. Khối lượng thực nguyên tố trên là
Đáp án : D Phương pháp giải :
1 đvC =$\dfrac{1}{{12}}$ khối lượng nguyên tử C = $\dfrac{1}{{12}}.1,{9926.10^{ - 23}}\,\,gam$ Lời giải chi tiết :
Nguyên tử khối của Bari là 137 đvC Mà 1 đvC = $\dfrac{1}{{12}}$ khối lượng nguyên tử C = $\dfrac{1}{{12}}.1,{9926.10^{ - 23}}\,\,gam$ => 137 đvC = $137.\dfrac{1}{{12}}.1,{9926.10^{ - 23}}\,\,gam$ = 2,275.10-22 gam
Câu 4 :
Dựa vào dấu hiệu nào sau đây để phân biệt phân tử của đơn chất với phân tử của hợp chất?
Đáp án : D Lời giải chi tiết :
Để phân biệt phân tử của đơn chất với phân tử của hợp chất ta dựa vào nguyên tử của cùng nguyên tố hay khác nguyên tố: - Phân tử gồm những nguyên tử cùng loại là đơn chất - Phân tử gồm những nguyên tử khác loại là hợp chất
Câu 5 :
Chọn đáp án sai
Đáp án : C Lời giải chi tiết :
Đáp án sai là: Al2O3 có 2 nguyên tử nhôm và 2 nguyên tử oxi trong phân tử. => sửa lại: Al2O3 có 2 nguyên tử nhôm và 3 nguyên tử oxi trong phân tử.
Câu 6 :
Từ công thức hóa học của CuSO4 có thể suy ra được những gì?
Đáp án : D Phương pháp giải :
Xem lại lí thuyết công thức hóa học của hợp chất và cách tính phân tử khối Lời giải chi tiết :
Từ công thức hóa học của CuSO4 có thể suy ra được: - CuSO4 do 3 nguyên tố Cu, O, S tạo nên => A đúng - Có 4 nguyên tử oxi trog phân tử => B đúng - Phân tử khối = 64 + 32 + 16.4 = 160 (đvC) => C đúng
Câu 7 :
Dấu hiệu của phản ứng hóa học
Đáp án : D Lời giải chi tiết :
Dấu hiệu của phản ứng hóa học là - Có thể thay đổi màu sắc, trạng thái, mùi. - Tỏa nhiệt, thu nhiệt hoặc phát sáng. - Tạo ra kết tủa, bay hơi, hoặc đổi màu
Câu 8 :
Cho phương trình hóa học: aP2O5 + bH2O → cH3PO4. Sau khi cân bằng phương trình phản ứng thì giá trị của b là
Đáp án : C Lời giải chi tiết :
aP2O5 + bH2O → cH3PO4 Ở bên phải có 3 nguyên tử H, bên trái có 2 nguyên tử H => thêm 2 vào trước H3PO4 để làm chẵn số H aP2O5 + bH2O → 2H3PO4 ở bên phải có 6 nguyên tử H và 2 nguyên tử P => bên trái cần thêm 3 vào H2O và không cần thêm hệ số trước P2O5 => phương trình hóa học: P2O5 + 3H2O → 2H3PO4
Câu 9 :
Thể tích 1 mol của hai chất khí bằng nhau nếu được đo ở
Đáp án : D Lời giải chi tiết :
Thể tích 1 mol của hai chất khí bằng nhau nếu được đo ở cùng điều kiện nhiệt độ và áp suất.
Câu 10 :
Dãy gồm các chất khí nhẹ hơn không khí là
Đáp án : D Phương pháp giải :
Xem lại công thức tính tỉ khối của khí A so với không khí Lời giải chi tiết :
Không khí có M = 29 g/mol => chất nhẹ hơn không khí là chất có M < 29 g/mol +) Loại A vì: ${M_{C{O_2}}} = 12 + 16.2 = 44$ > 29 => khí CO2 nặng hơn không khí +) Loại B vì: ${M_{S{O_2}}} = 32 + 16.2 = 64$ > 29 => khí SO2 nặng hơn không khí +) Loại C vì: ${M_{N{O_2}}} = 14 + 16.2 = 46$ > 29 => khí NO2 nặng hơn không khí
Câu 11 :
Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là
Đáp án : A Phương pháp giải :
+) Tính ${M_{F{{\text{e}}_3}{O_4}}}$ +) Trong 1mol Fe3O4 có 3 mol nguyên tử Fe và 4 mol nguyên tử O => %mFe = $\dfrac{{3.{M_{F{\text{e}}}}.100\% }}{{{M_{F{{\text{e}}_3}{O_4}}}}}$ Lời giải chi tiết :
${M_{F{{\text{e}}_3}{O_4}}} = 3.56 + 4.16 = 232$ Trong 1mol Fe3O4 có 3 mol nguyên tử Fe và 4 mol nguyên tử O => %mFe = $\dfrac{{3.{M_{F{\text{e}}}}.100\% }}{{{M_{F{{\text{e}}_3}{O_4}}}}}$=72,4%
Câu 12 :
Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc) là
Đáp án : C Phương pháp giải :
+) Tính số mol Zn : ${n_{Zn}} = \dfrac{{13}}{{65}}$ PTHH: 2Zn + O2 $\xrightarrow{{{t^o}}}$ 2ZnO Tỉ lệ theo PT: 2mol 1mol 2mol 0,2mol ? mol Số mol khí O2 đã dùng là: ${n_{{O_2}}} = \dfrac{{0,2.1}}{2}$ => Thể tích O2 là: V = n.22,4 Lời giải chi tiết :
Số mol Zn là: ${n_{Zn}} = \dfrac{{13}}{{65}} = 0,2\,mol$ PTHH: 2Zn + O2 $\xrightarrow{{{t^o}}}$ 2ZnO Tỉ lệ theo PT: 2mol 1mol 2mol 0,2mol ? mol Số mol khí O2 đã dùng là: ${n_{{O_2}}} = \dfrac{{0,2.1}}{2} = 0,1\,mol$ => Thể tích O2 là: V = n.22,4 = 0,1.22,4 = 2,24 lít
Câu 13 :
A là hợp chất của nguyên tố M (hóa trị I) và O, trong đó M chiếm 74,2% về khối lượng. Xác định CTHH của A
Đáp án : D Phương pháp giải :
Bước 1: Lập công thức hóa học của nguyên tố M (hóa trị I) với O Bước 2: Lập phương trình tính phần trăm khối lượng của M => tính nguyên tử khối của M Bước 3: Tìm M và kết luận CTHH Lời giải chi tiết :
Theo bài ra, M có hóa trị I CTHH của hợp chất A có dạng: ${M_2}O$ Ta có: $\% {m_M} = \frac{{{m_M}}}{{{m_A}}}.100\% => \frac{{2{M_M}}}{{2{M_M} + 16}} = \frac{{74,2}}{{100}}$ $ \Leftrightarrow {M_M} = 23$ $ \Rightarrow $ M là Na $ \Rightarrow $ Công thức hóa học của hợp chất cần tìm là:$N{a_2}O$
Câu 14 :
Cho 13,2g hỗn hợp gồm magie, sắt và kẽm cháy trong khí oxi, thu được 18g hỗn hợp chất rắn. Khối lượng oxi tham gia phản ứng là:
Đáp án : B Phương pháp giải :
Áp dụng định luật bảo toàn khối lượng ta có: mmagie,sắt,kẽm + moxi = mhh rắn \( \to\) 13,2 + moxi = 18 \( \to\) moxi = ? Lời giải chi tiết :
Magie, sắt, kẽm + oxi → hỗn hợp rắn Áp dụng định luật bảo toàn khối lượng ta có: mmagie,sắt,kẽm + moxi = mhh rắn \( \to\) 13,2 + moxi = 18 \( \to\) moxi = 18 – 13,2 = 4,8 (g)
Câu 15 :
Trong một phản ứng hóa học, giữa các sản phẩm với các chất phản ứng không có sự thay đổi về
Đáp án : C Lời giải chi tiết :
Số nguyên tử của mỗi nguyên tố của các chất trước và sau phản ứng được bảo toàn
Câu 16 :
Hợp chất được cấu tạo từ nitơ (N) hoá trị II và oxi (O) hoá trị II là:
Đáp án : B Phương pháp giải :
Dùng quy tắc hóa trị để lập công thức: \(\mathop A\limits^a x\mathop B\limits^b y\) Theo quy tắc hóa trị thì: a× x = b× y => lập tỉ lệ \(\dfrac{x}{y} = \dfrac{a}{b} = ?\) => từ đó tìm được công thức Lời giải chi tiết :
Gọi công thức là: \(\mathop N\limits^{II} x\mathop O\limits^{II} y\) Theo quy tắc hóa trị ta có: II× x = II× y => \(\dfrac{x}{y} = \dfrac{{II}}{{II}} = \dfrac{1}{1}\) => chọn x = 1 và y = 1 => công thức cấu tạo là NO
Câu 17 :
Việc hiểu biết tính chất của chất có lợi gì?
Đáp án : D Lời giải chi tiết :
Hiểu các tính chất của chất chúng ta có thể + Phân biệt chất này với chất khác + Biết sử dụng chất an toàn + Biết ứng dụng chất thích hợp trong đời sống và sản xuất
Câu 18 :
Hỗn hợp là sự trộn lẫn của mấy chất với nhau?
Đáp án : A Lời giải chi tiết :
Hỗn hợp là 2 hay nhiều chất trộn lại với nhau. Mỗi chất trong hỗn hợp được gọi là 1 chất thành phần
Câu 19 :
Mỗi công thức hóa học của một chất cho chúng ta biết
Đáp án : D Lời giải chi tiết :
Mỗi công thức hóa học chỉ 1 phân tử của chất, cho biết + Nguyên tố nào tạo ra chất + Số nguyên tử của mỗi nguyên tố trong 1 phân tử chất + Phân tử khối của chất
Câu 20 :
Hợp chất B trong phân tử gồm có 1X, 1S, 4O liên kết với nhau (X là nguyên tố chưa biết), biết nguyên tử X có khối lượng bằng 2 lần phân tử khí nitơ. Tìm CTHH của B.
Đáp án : C Phương pháp giải :
+ B trong phân tử gồm có 1X, 1S, 4O liên kết với nhau => được chỉ số chân của các nguyên tử trong hợp chất + Phân tử khối của X = 2 phân tử khối của nito => MX = 2. MN2 = ? Lời giải chi tiết :
Hợp chất B gồm có 1X, 1S, 4O liên kết với nhau => CTHH chung của B là: XSO4 MX = 2.MN2 => MX = 2 . 28 = 56 -> X là sắt (Fe) => CTHH của A là FeSO4
Câu 21 :
Cho các câu sau: a) Than chì là chất dùng làm lõi bút chì b) Xe đạp được chế tạo từ sắt, nhôm, cao su…. Trong 2 câu trên vật thể là:
Đáp án : C Lời giải chi tiết :
Trong 2 câu trên vật thể là: Lõi bút chì, xe đạp
Câu 22 :
Đốt cháy hoàn toàn m (g) CH4 cần dùng 0,4 (g) khí O2 thu được 1,4 (g) CO2 và 1,6(g) H2O. m có giá trị là:
Đáp án : A Lời giải chi tiết :
Áp dụng định luật bảo toàn khối lượng: \( \to m = {m_{C{O_2}}} + {m_{{H_2}O}} - {m_{{O_2}}} = 1,4 + 1,6 - 0,4 = 2,6\,\,gam\)
Câu 23 :
Cho PƯHH: 2HCl + CaCO3 → CaCl2 + H2O + CO2.
Đáp án : A Lời giải chi tiết :
PƯHH: 2HCl + CaCO3 → CaCl2 + H2O + CO2. đúng
Câu 24 :
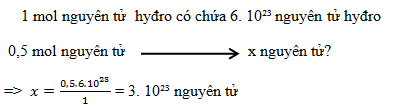
0,5 mol nguyên tử hyđro có chứa bao nhiêu nguyên tử hyđro?
Đáp án : C Lời giải chi tiết :
Câu 25 :
0,25 mol phân tử Al₂O₃ có khối lượng là bao nhiêu?
Đáp án : D Lời giải chi tiết :
Câu 26 :
Kim loại M tạo ra hiđroxit M(OH)3. Phân tử khối của hiđroxit là 107 đvC. Nguyên tử khối của M là:
Đáp án : C Phương pháp giải :
Từ phương trình: \({M_{M{{(OH)}_3}}} = 107 \Rightarrow {M_M} = ?\) Lời giải chi tiết :
Theo bài ta có phương trình: \(\begin{array}{l}{M_{M{{(OH)}_3}}} = 107\\ \Rightarrow {M_M} + ({M_O} + {M_H}) \times 3 = 107\\ \Rightarrow {M_M} + (16 + 1) \times 3 = 107\\ \Rightarrow {M_M} + 17 \times 3 = 107\\ \Rightarrow {M_M} = 107 - 51\\ \Rightarrow {M_M} = 56\,(dvC)\end{array}\)
Câu 27 :
Hạt nhân nguyên tử có cấu tạo bởi các loại hạt:
Đáp án : B Phương pháp giải :
Đọc lại cấu tạo hạt nhân nguyên tử Lời giải chi tiết :
Hạt nhân cấu tạo bởi: Proton, Nơtron. Chú ý
Học sinh có thể nhầm lẫn cấu tạo nguyên tử mà chọn đáp án 3 loại hạt Electron, Proton, Nơtron.
Câu 28 :
Nguyên tử M có số nơtron nhiều hơn số proton là 1 và số hạt mang điện nhiều hơn số hạt không mang điện là 10. Tổng số hạt p và n có trong nguyên tử M là:
Đáp án : D Phương pháp giải :
Lập phương trình với dữ kiện 1 Lập phương trình với dữ kiện 10 giải hệ được p, n =? Từ đó tìm được số khối: A = p+n Lời giải chi tiết :
Đặt số proton, notron lần lượt là p và n (hạt) Nguyên tử trung hòa về điện nên số electron = số proton = p (hạt) Trong M, số notron nhiều hơn số proton là 1 → n – p = 1 (1) Số hạt mang điện nhiều hơn số hạt không mang điện là 10 → p + e – n = 10 hay 2p – n = 10 (2) Từ (1) và (2) ta có hệ phương trình:\(\left\{ \begin{array}{l}n - p = 1\,\\ - n + 2p = 10\end{array} \right. \Rightarrow \left\{ \begin{array}{l}n = 12\\p = 11\end{array} \right.\) Tổng số hạt p và n có trong nguyên tử M là: p + n = 11 + 12 = 23
Câu 29 :
Dãy nào gồm các chất là đơn chất?
Đáp án : B Phương pháp giải :
Dựa vào khái niệm đơn chất và hợp chất – sgk hóa 8 – trang 22 Lời giải chi tiết :
A chỉ có chứa Cl2 là đơn chất B chỉ chứa đơn chất C chỉ chứa hợp chất D chứa Cl2 là đơn chất
Câu 30 :
Dãy nào gồm các chất là hợp chất?
Đáp án : C Phương pháp giải :
Dựa vào khái niệm đơn chất và hợp chất – sgk hóa 8 – trang 22 Lời giải chi tiết :
A có chứa Cl2 là đơn chất B chỉ chứa đơn chất C chỉ chứa hợp chất D chứa Cl2 là đơn chất
Câu 31 :
Cho biết CTHH của X với H là H3X, của Y với O là YO.Chọn CTHH nào đúng cho hợp chất X và Y:
Đáp án : C Phương pháp giải :
Áp dụng quy tắc hóa trị tính được hóa trị của X trong H3X là a Áp dụng quy tắc hóa trị tính được hóa trị của Y trong YO là b Sau đó thành lập công thức hóa học của X(a) với Y(b) Lời giải chi tiết :
Theo quy tắc hóa trị cho H3X thì hóa trị của X là \({{I.3} \over 1} = III\) Theo quy tắc hóa trị cho YO thì hóa trị của Y là \({{II.1} \over 1} = II\) Đặt công thức hóa học cho X và Y là XxYy Theo quy tắc hóa trị thì III.x = II.y suy ra \({x \over y} = {{II} \over {III}} = {2 \over 3}\) Chọn x=2 và y=3 CTHH phù hợp là X2Y3
Câu 32 :
Hòa tan vôi sống (CaO) vào nước được vôi tôi canxi hiđroxit (Ca(OH)2). Đây là hiện tượng
Đáp án : C Lời giải chi tiết :
Đây là hiện tượng hóa học
Câu 33 :
Cho phương trình hóa học: (NH4)2Cr2O7 \(\xrightarrow{{{t^0}}}\) Cr2O3 + N2 + H2O Tổng hệ số các chất trong phương trình hóa học trên sau khi cân bằng là:
Đáp án : A Phương pháp giải :
Sử dụng phương pháp cân bằng kim loại – phi kim + Cân bằng theo thứ tự Cr → N → H → O Lời giải chi tiết :
- Ta thấy các nguyên tố Cr, N hai vế đã bằng nhau nên ta bắt đầu cân bằng từ nguyên tố H - Ta thấy VT có 8 nguyên tử H trong (NH4)2Cr2O7 trong khi VP có 2 nguyên tử H trong H2O → Đặt hệ số 4 trước H2O => (NH4)2Cr2O7 \(\xrightarrow{{{t^0}}}\) Cr2O3 + N2 + 4H2O - Kiểm tra O ta thấy 2 vế đều đã bằng nhau, vậy PTHH trên đã cân bằng. → Tổng hệ số các chất trong phương trình là: 1 + 1+ 1+ 4 = 7
Câu 34 :
Cho phương trình hóa học: AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2 Sử dụng phương pháp cân bằng kim loại – phi kim cân bằng phương trình trên và cho biết tỉ lệ hệ số các chất trong phương trình lần lượt là:
Đáp án : B Phương pháp giải :
Cân bằng theo thứ tự O, Ag, N. Lời giải chi tiết :
PTHH: AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2 - Đầu tiên ta cân bằng nguyên tố O - Ta thấy ở VP có tổng 4 nguyên tử trong NO2 và O2 còn VT có 3 nguyên tử O trong AgNO3 → cần làm chẵn số nguyên tử O ở VT bằng cách đặt 2 trước AgNO3. => 2AgNO3 \(\xrightarrow{{{t^0}}}\) Ag + NO2 + O2 - Tiếp theo ta thấy VT có 2 nguyên tử Ag trong AgNO3 còn VP chỉ có 1 nguyên tử Ag → Đặt hệ số 2 trước Ag. => 2AgNO3 \(\xrightarrow{{{t^0}}}\) 2Ag + NO2 + O2 - Tương tự ta thấy VT có 2 nguyên tử N trong AgNO3 còn VP chỉ có 1 nguyên tử N → Đặt hệ số 2 trước NO2. => 2AgNO3 \(\xrightarrow{{{t^0}}}\) 2Ag + 2NO2 + O2 Vậy sau khi cân bằng hệ số các chất trong phương trình lần lượt là 2:2:2:1
Câu 35 :
Ở cùng điều kiện nhiệt độ và áp suất, so sánh thể tích của 4 gam CH4 và 1 gam H2 ta có:
Đáp án : B Phương pháp giải :
Cùng điều kiện nhiệt độ áp suất tỉ lệ số mol bằng tỉ lệ thể tích Lời giải chi tiết :
nCH4 = 4 : 16 =0,25 mol nH2 =0,5 mol Vì nH2 > nCH4 nên VH2 > VCH4 |




















Danh sách bình luận