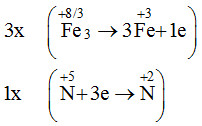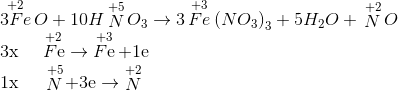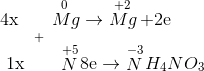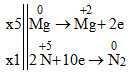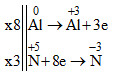40 câu hỏi lý thuyết về axit nitric và muối nitrat có lời giải (phần 2)Làm bàiQuảng cáo
Câu hỏi 1 : Cho các chất Fe, Cu, Na2CO3, C, Fe3O4, CuO, Al(OH)3 lần lượt tác dụng với dung dịch HNO3. Số phản ứng oxi hoá khử xảy ra là:
Đáp án: B Phương pháp giải: Phản ứng oxi hóa - khử là phản ứng có sự thay đổi số oxi hóa. Lời giải chi tiết: Các chất có tạo phản ứng oxi hóa khử với HNO3 là: Fe ; Cu ; C ; Fe3O4 Đáp án B Câu hỏi 2 : Phản ứng giữa HNO3 với FeO tạo ra khí NO. Tổng các hệ số trong phương trình của phản ứng Oxi hóa khử này bằng:
Đáp án: A Phương pháp giải: Lời giải chi tiết: 3FeO + 10HNO3 → 5H2O + NO + 3Fe(NO3)3 Đáp án A Câu hỏi 3 : Phản ứng giữa kim loại magiê với axit nitric đặc, giả thiết chỉ tạo ra đinitơ oxit. Tổng các hệ số trong phương trình hóa học bằng:
Đáp án: C Phương pháp giải: Lời giải chi tiết: 10HNO3 + 4Mg → 5H2O + 4Mg(NO3)2 + N2O Đáp án C Câu hỏi 4 : Cho phản ứng aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O Các hệ số a,b,c,d,e là những số nguyên đơn giản nhất. Tổng (a+b) bằng
Đáp án: B Phương pháp giải: Lời giải chi tiết: Fe + 4HNO3 → 2H2O + NO + Fe(NO3)3 Đáp án B Câu hỏi 5 : Cho phản ứng Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O Để được 1 mol NO cần bao nhiêu mol HNO3 tham gia theo phản ứng trên?
Đáp án: A Phương pháp giải: Lời giải chi tiết:
→ 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O Đáp án A Câu hỏi 6 : Cho 2 phản ứng sau: Fe + 2HCl → FeCl2 + H2 (1) Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (2) Tìm phát biểu đúng
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 7 : Phản ứng giữa HNO3 với P tạo khí NO. Tổng số các hệ số trong phản ứng là bao nhiêu ? (Biết các hệ số đều là số nguyên dương, có tỉ lệ tối giản)
Đáp án: C Phương pháp giải: Viết và cân bằng phương trình của phản ứng oxi hóa - khử. Lời giải chi tiết: PTHH: 3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO Đáp án C Câu hỏi 8 : Mg + HNO3 → ? + NO + ? Hệ số của HNO3 trog phản ứng trên là?
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án: C 3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O Câu hỏi 9 : Phản ứng nhiệt phân nào sai trong các phản ứng sau:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án: D Đây là trường hợp đặc biệt cần lưu ý: $$4Fe{(N{O_3}{\rm{)}}_2}{\rm{ }}\buildrel {{t^0}} \over \longrightarrow {\rm{ 2F}}{{\rm{e}}_2}{{\rm{O}}_3}{\rm{ + 8N}}{{\rm{O}}_2} \uparrow {\rm{ }} + {\rm{ }}{O_2} \uparrow $$ Câu hỏi 10 : Dãy tất cả các chất đều tác dụng với dung dịch HNO3 đặc, nóng tạo khí màu nâu đỏ bay ra là:
Đáp án: B Phương pháp giải: Dựa vào tính chất hóa học của HNO3. Lời giải chi tiết: Các chất có phản ứng oxi hóa khử với HNO3 đều thỏa mãn. A loại Fe(OH)3 B đúng C loại Cu(OH)2 D loại Fe2O3 Đáp án B Câu hỏi 11 : Nhiệt phân hoàn toàn Fe(NO3)2 ngoài không khí, sản phẩm thu được là:
Đáp án: C Phương pháp giải: Dựa vào phản ứng nhiệt phân muối nitrat. Lời giải chi tiết: Phương trình nhiệt phân của Fe(NO3)2: 4Fe(NO3)2 \(\overset{t^o}{\rightarrow}\) 2Fe2O3 + 8NO2 + O2 Đáp án C Câu hỏi 12 : Dãy tất cả các muối nitrat bị nhiệt phân cho sản phẩm là kim loại, khí NO2 và O2 là
Đáp án: D Phương pháp giải: Dựa vào lý thuyết về phản ứng nhiệt phân muối nitrat M(NO3)n: - M = [K, Na, Ba, Ca] → Muối nitrit + O2 - M = [Mg, ..., Cu] → Oxit KL + NO2 + O2 - M = [Ag, ...) → KL + NO2 + O2 Lời giải chi tiết: Nhiệt phân các muối nitrat từ Ag trở đi ta sẽ thu được KL + NO2 + O2. Đáp án D Câu hỏi 13 : Cho từng chất FeO, Fe, Fe(OH)2, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 lần lượt tác dụng với HNO3 đặc, nóng. Số phản ứng oxi hóa - khử xảy ra là:
Đáp án: C Phương pháp giải: Khi phản ứng với HNO3, những hợp chất của Fe mà chứa Fe có số oxi hóa 0, +2 có thể tăng lên +3 nên là phản ứng oxi hóa - khử. Lời giải chi tiết: Các chất có phản ứng oxi hóa - khử với HNO3 là: FeO, Fe, Fe(OH)2, Fe3O4, Fe(NO3)2, FeSO4, FeCO3. Vậy có 7 chất thỏa mãn. Đáp án C Câu hỏi 14 : Tổng hệ số (nguyên, tối giản) của phản ứng hóa học sau là bao nhiêu? FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO2 + H2O
Đáp án: D Phương pháp giải: Cân bằng phản ứng oxi hóa - khử bằng phương pháp thăng bằng electron. Lời giải chi tiết: 1 x (FeS2 – 15e → Fe+3 + 2S+6) 15 x (N+5 + 1e → N+4) PTHH: FeS2 + 18HNO3 → Fe(NO3)3 + 2H2SO4 + 15NO2 + 7H2O Đáp án D Câu hỏi 15 : Dãy gồm những chất chỉ tác dụng với HNO3 mà HNO3 chỉ thể hiện tính oxi hóa là:
Đáp án: A Phương pháp giải: HNO3 thể hiện tính oxi hóa khi tác dụng với các chất có tính khử. Những chất khử là những chất có khả năng nhường e để lên mức oxi hóa cao hơn Lời giải chi tiết: B. Loại CaO C. Loại Fe2O3 D. Loại CuO Đáp án A Câu hỏi 16 : Nhiệt phân hoàn toàn một lượng cùng số mol 4 chất rắn NaNO3, KNO3,Cu(NO3)2 và AgNO3. Chất nhiệt phân cho thể tích khí thu được lớn nhất là:
Đáp án: B Phương pháp giải: Viết PTHH nhiệt phân các muối. Lời giải chi tiết: A. NaNO3 → NaNO2 + ½ O2 => 1 mol muối thu được 0,5 mol khí B. Cu(NO3)2 → CuO + 2NO2 + ½ O2 => 1 mol muối thu được 2,5 mol khí C. KNO3 → KNO2 + ½ O2 => 1 mol muối thu được 0,5 mol khí D. AgNO3 → Ag + NO2 + ½ O2 => 1 mol muối thu được 1,5 mol khí Đáp án B Câu hỏi 17 : Cho bột Fe vào dung dịch gồm AgNO3 và Cu(NO3)2. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X gồm 2 muối và chất rắn Y gồm 2 kim loại. Hai muối trong X và 2 kim loại trong Y lần lượt là:
Đáp án: D Phương pháp giải: Áp dụng quy tắc alpha. Lời giải chi tiết: 2 kim loại là Cu và Ag => AgNO3 phải hết 2 muối sẽ gồm Fe(NO3)2 và Cu(NO3)2 Thứ tự phản ứng: Fe + 2AgNO3 → Fe(NO3)2 + 2Ag Fe + Cu(NO3)2 → Fe(NO3)2 + Cu Đáp án D Câu hỏi 18 : Cho 2 muối X, Y thỏa mãn điều kiện sau : (1) X + Y -> Không phản ứng (2) X + Cu -> Không phản ứng (3) Y + Cu -> Không phản ứng (4) X + Y + Cu -> Phản ứng Hai muối X, Y thỏa mãn là :
Đáp án: C Phương pháp giải: Lời giải chi tiết: H2SO4 đặc nóng có thể hòa tan Cu => chỉ có đáp án C thỏa mãn Đáp án C Câu hỏi 19 : Có các muối sau đây: NH4NO2, NH4HCO3, KNO3, Cu(NO3)2, AgNO3, NH4NO3. Có bao nhiêu muối khi nhiệt phân tạo thành sản phẩm có chứa hai oxit ?
Đáp án: C Phương pháp giải: Lời giải chi tiết: NH4HCO3, Cu(NO3)2, NH4NO3. H2O thực chất là oxit của Hidro Đáp án C Câu hỏi 20 : Cho các chất sau: NO, NO2, N2O3, HNO3, NH4Cl, N2O. Số oxi hóa của N trong các chất lần lượt là :
Đáp án: B Phương pháp giải: Lời giải chi tiết: Hướng dẫn giải: => Số oxi hóa của N là : +2,+4, +3, +5, -3, +1 Đáp án B. Câu hỏi 21 : Hệ số của HNO3 trong phương trình : FeO + HNO3 -> Fe(NO3)3 + H2O + NO
Đáp án: A Phương pháp giải: Lời giải chi tiết: Hướng dẫn giải: Đáp án A. Câu hỏi 22 : Cho phương trình: Mg + HNO3 -> Mg(NO3)2 + NH4NO3 +H2O Tỉ lệ 2 muối nitrat của amoni và magiê là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Hướng dẫn giải: 4Mg + 10HNO3 -> 4Mg(NO3)2 + NH4NO3 +3H2O => Tỉ lệ 2 muối nitrat của amoni và magiê là 1:4. Đáp án B. Câu hỏi 23 : Cho các chất FeO, Fe2O3, Fe(NO3)2, CuO.Số chất tác dụng được với HNO3 giải phóng khí NO là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Hướng dẫn giải: Chỉ có FeO, Fe(NO3)2 tạo NO khí tác dụng với HNO3 vì có chứa Fe(II) nên bị HNO3 oxi hóa Còn Fe2O3, CuO là oxit cao nhất của Fe,Cu => chỉ tạo san rphẩm là muối và nước => chọn D Đáp án D. Câu hỏi 24 : Cho hỗn hợp gồm Fe(NO3)2 và Al2O3 vào dung dịch H2SO4 (loãng dư) thu được dung dịch X. Cho dung dịch KOH dư vào X thu được kết tủa Y. Kết tủa Y có
Đáp án: B Phương pháp giải: Ghi nhớ: NO3- trong môi trường axit có tính oxi hóa giống hệt HNO3 Lời giải chi tiết: Fe( NO3)2 và Al2O3 + H2SO4 loãng dư => dd X gồm Fe3+, Al3+, SO42-, H+ Dd X + KOH dư => chỉ thu được kết tủa là Fe(OH)3↓ vì Al(OH)3 là hiđroxit lưỡng tính nên tan trong KOH dư Đáp án B Câu hỏi 25 : Nhiệt phân các muối sau: Fe(NO3)2, KNO3, NH4HCO3, NH4NO3, CaCO3. Số thí nghiệm sinh ra đơn chất là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 26 : Nhiệt phân hoàn toàn hỗn hợp rắn X gồm Cu(NO3)2, AgNO3, Fe(NO3)2 thu được chất rắn Y chứa các chất sau
Đáp án: D Phương pháp giải: Ghi nhớ sản phẩm nhiệt phân muối nitrat của các kim loại trong dãy điện hóa: Trước Mg => sản phẩm nhiệt phân tạo ra muối nitrit và O2 Từ Mg đến Cu => sản phẩm nhiệt phân là oxit kim loại + NO2 + O2 Sau Cu => sản phẩm nhiệt phân là kim loại + NO2 + O2 Lời giải chi tiết: \(\left\{ \begin{gathered} Đáp án D Câu hỏi 27 : Tổng hệ số cân bằng của các chất tham gia trong phản ứng sau là: Mg + HNO3 → Mg(NO3)2 + N2O↑ + H2O
Đáp án: C Phương pháp giải: Cân bằng phương trình bằng phương pháp thăng bằng eletron. Lời giải chi tiết: \(\begin{array}{l} 4Mg + 10HNO3 → 4Mg(NO3)2 + N2O↑ + 5H2O Tổng hệ số các chất tham gia là: 4 + 10 = 14 Đáp án C Câu hỏi 28 : Trong phản ứng sau: HNO3 + C → CO2 + NO2 + H2O. Cacbon là
Đáp án: C Phương pháp giải: HS ghi nhớ “khử cho – o nhận” - Chất khử (bị oxi hóa) là chất nhường e. - Chất oxi hóa (bị khử) là chất nhận e Lời giải chi tiết: \(\mathop C\limits^0 \to \mathop C\limits^{ + 4} + 4e\) => C nhường e => C là chất khử (hay chất bị oxi hóa) Đáp án C Câu hỏi 29 : Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng: (a) bông khô (b) bông có tẩm nước (c) bông có tẩm nước vôi trong (d) bông có tẩm giấm ăn Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là
Đáp án: D Phương pháp giải: Đê hạn chế khí NO2 thoát ra ngoài tốt nhất cần lựa chọn bông tẩm có khả năng phản ứng với NO2 tạo chất rắn an toàn. Lời giải chi tiết: Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng bông có tẩm nước vôi trong vì: 2Ca(OH)2 + 4NO2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O Đáp án D Câu hỏi 30 : Axit HNO3 tinh khiết là chất lỏng không màu, dễ bị phân hủy khi chiếu sáng vì vậy người ta đựng nó trong bình tối màu. Trong thực tế bình chứa dung dịch HNO3 đậm đặc thường có màu vàng vì nó có hòa lẫn một ít khí X. Vậy X là khí nào sau đây?
Đáp án: C Phương pháp giải: Khí này được tạo ra do quá trình phân hủy của HNO3 đậm đặc. Khí này có màu khiến cho dung dịch HNO3 đặc có màu. Lời giải chi tiết: HNO3 là axit dễ bị phân hủy khi chiếu sáng: 2HNO3 → 2H2O + NO2 (nâu) + ½ O2 (không màu) Khí X tạo màu cho dung dịch HNO3 đặc là NO2. Đáp án C Câu hỏi 31 : Cho phương trình phản ứng: Mg + HNO3 → Mg(NO3)2 + NO + H2O. Tổng hệ số cân bằng (số nguyên tối giản) của các chất trong phản ứng trên là
Đáp án: C Phương pháp giải: Cân bằng phương trình oxi hóa - khử theo phương pháp thăng bằng electron. Lời giải chi tiết: \(\begin{array}{*{20}{c}}{3x}\\{2x}\end{array}\left| \begin{array}{l}Mg \to M{g^{2 + }} + 2e\\{N^{ + 5}} + 3e \to {N^{ + 2}}\end{array} \right.\) 3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O. Tổng hệ số cân bằng (số nguyên tối giản) của các chất trong phản ứng trên là 20. Đáp án C Câu hỏi 32 : Trong các kim loại Mg, Al, Cu, Fe. Số kim loại bị oxi hóa bởi HNO3 đặc nguội là
Đáp án: B Phương pháp giải: HS ghi nhớ một số kim loại bị thụ động trong HNO3 đặc nguội: Al, Fe, Cr. Lời giải chi tiết: Al, Fe bị thụ động hóa bởi HNO3 đặc nguội nên không bị oxi hóA → Trong dãy kim loại Mg, Al, Cu, Fe chỉ có Mg, Cu bị oxi hóa bởi HNO3 đặc nguội. → 2 kim loại Đáp án B Câu hỏi 33 : Cho phản ứng : aAl + bHNO3 → cAl(NO3)3 + dNO + eH2O. Hệ số a, b, c, d, e là các số nguyên, tối giản. Tổng (a+b) bằng
Đáp án: D Phương pháp giải: Cân bằng phương trình theo phương pháp thăng bằng electron Bước 1: Xác định sự thay đổi số oxi hóa của 1 số nguyên tố, xác định chất khử, chất oxi hóa. Bước 2: Viết quá trình oxi hóa, quá trình khử, cân bằng mỗi quá trình. Bước 3: Đặt hệ số thích hợp trước chất khử, chất oxi hóa sao cho số electron quá trình oxi hóa bằng số electron quá trình khử. Bước 4: Đặt hệ số thích hợp vào các chất trong phương trình và hoàn thành phương trình. Lời giải chi tiết: Bước 1: Xác định sự thay đổi số oxi hóa của 1 số nguyên tố trong phản ứng \(a\mathop {Al}\limits^0 + bH\mathop N\limits^{ + 5} {O_3} \to \mathop {cAl}\limits^{ + 3} {(N{O_3})_3} + \mathop {dN}\limits^{ + 2} O + e{H_2}O\) Bước 2,3: Viết quá trình oxi hóa, quá trình khử, cân bằng mỗi quá trình. Đặt hệ số trước chất khử, chất oxi hóa thích hợp sao cho số mol e nhường quá trình oxi hóa = số mol e nhận của quá trình khử \(\begin{array}{*{20}{c}}{1x}\\{1x}\end{array}\left| \begin{array}{l}A{l^0} \to A{l^{ + 3\,}} + 3e\\{N^{ + 5}} + 3e \to {N^{ + 2}}\end{array} \right.\) Bước 3: Đặt hệ số vào chất khử, chất oxi hóa. Cân bằng phương trình \(\mathop {Al}\limits^0 + H\mathop N\limits^{ + 5} {O_3} \to \mathop {Al}\limits^{ + 3} {(N{O_3})_3} + \mathop N\limits^{ + 2} O + {H_2}O\) Kiểm tra nguyên tố N bên vế phải sau đó đặt hệ số HNO3 bên vế trái Sau đó kiểm tra số H bên vế trái và đặt vào hệ số H2O bên vế phải \(\mathop {Al}\limits^0 + 4H\mathop N\limits^{ + 5} {O_3} \to \mathop {Al}\limits^{ + 3} {(N{O_3})_3} + \mathop N\limits^{ + 2} O + 2{H_2}O\) Kiểm tra cả 2 vế oxi đều đủ 12 nguyên tử O → phương trình trên được cân bằng Vậy (a+b) = (1+4) = 5 Đáp án D Câu hỏi 34 : Khi bị nhiệt phân dãy muối nitrat nào sau đây cho sản phẩm là oxit kim loại, khí nitơ đioxit và oxi?
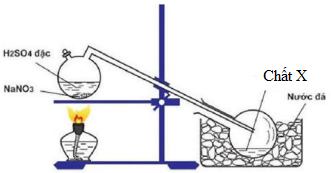
Đáp án: D Phương pháp giải: Nhiệt phân muối nitrat M(NO3)n - Nếu M là [K, ..., Ca] thì nhiệt phân thu được muối M(NO2)n và O2 - Nếu M là [Mg, ..., Cu] thì nhiệt phân thu được M2On, NO2, O2 Ngoại lệ: 2Fe(NO3)2 → Fe2O3 + 4NO2 + 0,5O2 - Nếu M là [Ag, ...] thì nhiệt phân thu được M, NO2, O2 Lời giải chi tiết: Nhiệt phân các muối nitrat của các kim loại [Mg, …, Cu] thu được oxit kim loại, NO2, O2. A loại KNO3, Hg(NO3)2, LiNO3 B loại AgNO3, NaNO3 C loại AgNO3 D đúng Đáp án D Câu hỏi 35 : Cho dãy các chất: Cu, Fe3O4, Na2SO3, AgNO3, Fe(OH)3, FeO. Số chất trong dãy tác dụng được với dung dịch hỗn hợp NaNO3 và HCl là
Đáp án: B Phương pháp giải: Những chất tác dụng với dung dịch hỗn hợp là những chất tác dụng với 1 trong 2 chất hoặc tác dụng với cả 2 chất đồng thời (2 chất tương đương tác dụng với H+ và NO3-) Lời giải chi tiết: Tất cả các chất trong dãy đều phản ứng được với dung dịch hỗn hợp NaNO3 và HCl. Đáp án B Câu hỏi 36 : Để điều chế chất X trong phòng thí nghiệm, người ta cho NaNO3 rắn phản ứng với H2SO4 đặc theo bình sau:
Chất X là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: PTHH : NaNO3(rắn) + H2SO4(đặc) \(\xrightarrow{{{t^o}}}\) NaHSO4 + HNO3 → Chất X là HNO3 Đáp án D Câu hỏi 37 : Hoàn thành các phương trình phản ứng sau: a) Mg + HNO3 → ? + N2 + ? b) Al + HNO3 → ? + NH4NO3 + ? Phương pháp giải: Điền những chất còn thiếu vào dấu “?” và cân bằng phản ứng bằng phương pháp thăng bằng electron. Lời giải chi tiết: a) 5Mg + 12HNO3 → 5Mg(NO3)2 + N2 + 6H2O
b) 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 15H2O
Câu hỏi 38 : Một nhóm học sinh thực hiện thí nghiệm cho kim loại Cu tác dụng với dung dịch HNO3 đặc. Hiện tượng quan sát nào sau đây là đúng?
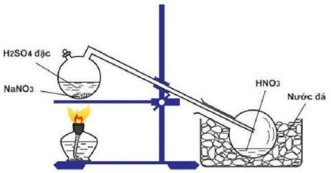
Đáp án: C Phương pháp giải: PTHH tổng quát: kim loại + HNO3 → muối + sản phẩm khử + H2O HNO3 đặc cho sản phẩm khử là NO2 (khí màu nâu đỏ) Lời giải chi tiết: \(3Cu + 8HN{O_3} \to 3Cu{(N{O_3})_2} + 2N{O_2} + 4{H_2}O\) Khí NO2 thoát ra có màu nâu đỏ Dung dịch muối Cu(NO3)2 có màu xanh Đáp án C Câu hỏi 39 : Cho hình vẽ mô tả thí nghiệm điều chế HNO3 trong phòng thí nghiệm như sau: Phát biểu không đúng về quá trình điều chế là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A $NaN{O_3} + {H_2}S{O_4} \to HN{O_3} \uparrow + NaHS{O_4}$
Câu hỏi 40 : Tìm phản ứng nhiệt phân sai:
Đáp án: A Phương pháp giải: Nhiệt phân muối nitrat: - Muối nitrat của các KL hoạt động (K, Na, Ba, Ca, …) tạo thành muối nitrit và O2 - Muối nitrat của các KL trung bình (Mg, …., Cu) tạo thành oxit bazo, NO2 và O2 - Muối nitrat của KL yếu (Ag, Hg, …) tạo thành KL, NO2 và O2 Lời giải chi tiết: 2AgNO3 → 2Ag + 2NO2 + O2 Đáp án A Quảng cáo
|