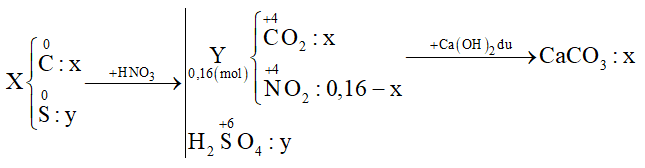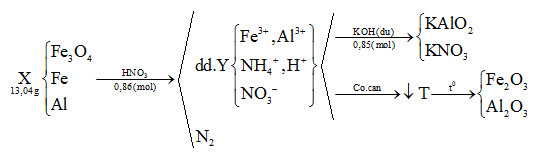20 bài tập vận dụng cao về axit nitric - muối nitrat có lời giải (phần 3)Làm bàiQuảng cáo
Câu hỏi 1 : Cho 3,5a gam hỗn hợp X gồm C và S tác dụng với lượng dư dung dịch HNO3 đặc, nóng, thu được hỗn hợp khí Y gồm NO2 và CO2 có thể tích 3,584 lít (đktc). Dẫn toàn bộ Y qua bình đựng dung dịch nước vôi trong dư thu được 12,5a gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là:
Đáp án: B Phương pháp giải: Đặt số mol C và S lần lượt là x và y (mol) Cho X + HNO3 đặc nóng:
+) Bảo toàn e → 4nC + 6nS = nNO2 → (1) +) Từ tỉ lệ \(\frac{{{m_X}}}{{{m_{CaC{{\rm{O}}_3}}}}}\) → (2) Giải (1) (2) được x và y Xác định giá trị của a Lời giải chi tiết: Đặt số mol C và S lần lượt là x và y (mol) Cho X + HNO3 đặc nóng:
+) Bảo toàn e → 4nC + 6nS = nNO2 → 4x + 6y = 0,16 - x (1) +) \(\frac{{{m_X}}}{{{m_{CaC{{\rm{O}}_3}}}}} = \frac{{12{\rm{x}} + 32y}}{{100{\rm{x}}}} = \frac{{3,5}}{{12,5}}\) (2) Giải (1) (2) được x = 0,02 và y = 0,01 ⟹ mX = 3,5a = 0,02.12 + 0,01.32 ⟹ a = 0,16 Đáp án B Câu hỏi 2 : Hòa tan hoàn toàn hỗn hợp gồm 0,03 mol Cu và 0,09 mol Mg vào dung dịch chứa 0,07 mol KNO3 và 0,16 mol H2SO4 loãng thì thu được dung dịch chỉ chứa các muối sunfat trung hòa và 1,12 lít (đktc) hỗn hợp khí X gồm các oxit của nitơ có tỉ khối so với H2 là x. Giá trị của x là
Đáp án: D Phương pháp giải: Kết hợp các phương pháp bảo toàn nguyên tố, bảo toàn điện tích Lời giải chi tiết: Bảo toàn Cu, Mg, K, S ta có sơ đồ như sau: \(\left\{ \begin{array}{l}Cu:0,03\\Mg:0,09\end{array} \right. + \left\{ \begin{array}{l}KN{O_3}:0,07\\{H_2}S{O_4}:0,16\end{array} \right. \to \left\{ \begin{array}{l}C{u^{2 + }}:0,03\\M{g^{2 + }}:0,09\\{K^ + }:0,07\\N{H_4}^ + \\S{O_4}^{2 - }:0,16\end{array} \right. + \mathop {Khi}\limits_{0,05} \left\{ \begin{array}{l}N\\O\end{array} \right. + {H_2}O\) Bảo toàn điện tích → nNH4 = 0,01 mol Bảo toàn N → nN(khí) = nNO3- - nNH4+ = 0,06 mol Bảo toàn H → nH2O = (2nH2SO4 - 4nNH4+)/2 = 0,14 mol Bảo toàn O → nO(khí) = (3nKNO3 + 4nH2SO4) - (4nSO42- + nH2O) = 0,07 mol ⟹ mkhí = mN(khí) + mO(khí) = 0,06.14 + 0,07.16 = 1,96 gam ⟹ Mkhí = 1,96 : 0,05 = 39,2 ⟹ x = dkhí/H2 = 39,2/2 = 19,6 Đáp án D Câu hỏi 3 : Hòa tan hết 2,72 gam hỗn hợp X gồm: FeS2, FeS, Fe, CuS và Cu trong 500 ml dung dịch HNO3 1M, sau khi kết thúc các phản ứng thu được dung dịch Y và 0,07 mol một chất khí. Cho Y tác dụng với lượng dư dung dịch BaCl2 thu được 4,66 gam kết tủa. Mặt khác, dung dịch Y có thể hòa tan tối đa m gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 là NO. Giá trị của m là
Đáp án: C Phương pháp giải: Coi hh X gồm Fe, Cu và S \(2,72\,g\,X\left\{ \begin{array}{l}Fe:\,x(mol)\\Cu:\,y(mol)\\S\end{array} \right. + HN{O_3}:0,5 \to 0,07\,mol\,NO + dd\,Y\left\{ \begin{array}{l}F{e^{3 + }}\\F{e^{2 + }}\\{H^ + }\\S{O_4}^{2 - }\\N{O_3}^ - \end{array} \right. + BaC{l_2}du \to 4,66\,g\,BaS{O_4}\) Sử dụng bảo toàn nguyên tố S, H Sử dụng bảo toàn khối lượng và bảo toàn e Lời giải chi tiết: Coi hh X gồm Fe, Cu và S \(2,72\,g\,X\left\{ \begin{array}{l}Fe:\,x(mol)\\Cu:\,y(mol)\\S\end{array} \right. + HN{O_3}:0,5 \to 0,07\,mol\,NO + dd\,Y\left\{ \begin{array}{l}F{e^{3 + }}\\F{e^{2 + }}\\{H^ + }\\S{O_4}^{2 - }\\N{O_3}^ - \end{array} \right. + BaC{l_2}du \to 4,66\,g\,BaS{O_4}\) BTNT “S”: nS = nBaSO4 = 4,66 : 233 = 0,02 (mol) quá trình nhường e Fe → Fe+3 + 3e x → 3x (mol) Cu → Cu+2 + 2e y → 2y (mol) S + H2O + 6e → 8H+ + SO42- 0,02 → 0,12→ 0,16 (mol) quá trình nhận e 4H+ + NO3‑ + 3e → NO + 2H2O (*) 0,28 0,21 ← 0,07 (mol) Lượng H+ có trong dd Y là: nH+ = nHNO3 + 8nS - 4nNO = 0,5 + 8.0,02 - 4.0,07 = 0,38 (mol) Ta có hệ: \(\left\{ \begin{array}{l}{m_{hhX}} = 56x + 64y + 0,02.32 = 2,72\\Bt\,e:3x + 2y + 0,12 = 0,21\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,02\\y = 0,015\end{array} \right.\) Vậy dd Y chứa \(\left\{ \begin{array}{l}F{e^{3 + }}:0,02\,\,mol\\C{u^{2 + }}:0,015\,mol\\{H^ + }:0,38\,\,mol\\S{O_4}^{2 - }:\,0,02\,mol\\N{O_3}^ - :0,43\,mol\end{array} \right. + Cu:a(mol) \to \left\{ \begin{array}{l}F{e^{2 + }}:0,015\,\,mol\\C{u^{2 + }}:0,015\, + a\,mol\\S{O_4}^{2 - }:\,0,02\,mol\\N{O_3}^ - :\end{array} \right. + NO + {H_2}O\) Cho Cu vào dd Y có: nNO = 1/4nH+ = 1/4.0,38 = 0,095 (mol) (Nhìn theo tương tự như bán phản ứng (*)) Bảo toàn e ta có: 2nCu = nFe3+ + 3nNO = 0,02 + 3.0,095 → nCu = 0,1525 (mol) → mCu = 0,1525×64 = 9,76 (g) Đáp án C Câu hỏi 4 : Hòa tan hoàn toàn 11,05 gam kim loại Zn vào m gam dung dịch HNO3 20% loãng (dùng dư 10% so với lượng phản ứng), sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y và 0,448 lít (đktc) hỗn hợp khí X gồm N2 và N2O. Tỉ khối của X so với H2 bằng 18. Giá trị của m là:
Đáp án: B Phương pháp giải: Bài tập KL + Axit HNO3: - Công thức giải nhanh: + ne = nNO3- = nNO2 + 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 + nHNO3 = 2nNO2 + 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 Lời giải chi tiết: Hỗn hợp khí X có x mol N2 và y mol N2O +) x + y = 0,448 : 22,4 = 0,02 mol +) mX = 28x + 44y = 0,02.2.18 = 0,72 gam → x = y = 0,01 mol nZn = 11,05 : 65 = 0,17 mol Ta thấy: ne = 2nZn > (10nN2 + 8nN2O) → Sau phản ứng còn có NH4NO3 Bảo toàn e: 2nZn = 10nN2 + 8nN2O + 8nNH4NO3 → nNH4NO3 = 0,02 mol nHNO3 pứ = 12nN2 + 10nN2O + 10nNH4NO3 = 0,42 mol → nHNO3 bđ = 0,42. 110% = 0,462 mol → mdd HNO3 = (63.0,462).100/20 = 145,53 gam Đáp án B Câu hỏi 5 : Hòa tan hoàn toàn 10,680 gam hỗn hợp gồm Mg và Zn bằng lượng vừa đủ 500 ml dung dịch HNO3 1,2M. Sau khi các phản ứng kết thúc, thu được 1,2096 lít khí N2O (đktc) duy nhất và dung dịch X chứa m gam muối. Giá trị của m là
Đáp án: A Phương pháp giải: - Ta có các bán phản ứng tạo sản phẩm khử: 10H+ + 2NO3- + 8e → N2O + 5H2O 10H+ + NO3- + 8e → NH4+ + 3H2O Từ các bán phản ứng lập mối liên hệ giữa HNO3 phản ứng và số mol các sản phẩm khử. - Bảo toàn nguyên tố H tính được số mol H2O. - Áp dụng bảo toàn khối lượng tính được khối lượng muối thu được. Lời giải chi tiết: Ta có các bán phản ứng tạo sản phẩm khử: 10H+ + 2NO3- + 8e → N2O + 5H2O 10H+ + NO3- + 8e → NH4+ + 3H2O \( \to {n_{HN{O_3}pu}} = 10{n_{{N_2}O}} + 10{n_{N{H_4}^ + }} \Leftrightarrow 0,5.1,2 = 10.0,054 + 10{n_{N{H_4}^ + }} \Leftrightarrow {n_{N{H_4}^ + }} = 0,006\) Bảo toàn nguyên tố H → \({n_{{H_2}O}} = \frac{{{n_{HN{O_3}}} - 4{n_{N{H_4}^ + }}}}{2} = \frac{{0,6 - 4.0,006}}{2} = 0,288(mol)\) Bảo toàn khối lượng → \({m_{muoi}} = {m_{KL}} + {m_{HN{O_3}}} - {m_{{N_2}O}} - {m_{{H_2}O}} = 10,68 + 0,6.63 - 44.0,054 - 0,288.18 = 40,92(g)\) Đáp án A Câu hỏi 6 : Cho 5 gam bột Mg vào dung dịch hỗn hợp KNO3 và H2SO4, đun nhẹ, trong điều kiện thích hợp, đến khi phản ứng xảy ra hoàn toàn thu được dung dịch X chứa m gam muối; 1,792 lít hỗn hợp khí Y (đktc) gồm hai khí không màu, trong đó có một khí hóa nâu ngoài không khí và còn lại 0,44 gam chất rắn không tan. Biết tỉ khối hơi của Y đối với H2 là 11,5. Tính m? Phương pháp giải: Kết luận các khí có trong Y và tính số mol mỗi khí trong Y Áp dụng bảo toàn electron, chứng minh sau phản ứng thu được muối amoni, tính số mol muối amoni. Tìm số mol các ion K+ và SO42- thông qua H+và NO3- Áp dụng bảo toàn khối lượng cho dung dịch X và tìm m. Lời giải chi tiết: Hỗn hợp khí Y gồm NO (x mol) và H2 (y mol) \({n_Y} = \frac{{1,792}}{{22,4}} = 0,08\,\,mol \to x + y = 0,08\) (1) \({d_{Y/{H_2}}} = 11,5 \to \frac{{{M_Y}}}{{{M_{{H_2}}}}} = 11,5 \to {M_Y} = 11,5.2 = 23 \to {m_Y} = 23.0,08 = 1,84\,\,gam \to 30{\rm{x}} + 2y = 1,84\) (2) Từ (1) và (2) \( \to \left\{ \begin{array}{l}x + y = 0,08\\30{\rm{x}} + 2y = 1,84\end{array} \right. \to \left\{ \begin{array}{l}x = 0,06\\y = 0,02\end{array} \right.\) Ta có mMg phản ứng = 5 – 0,44 = 4,56 gam \( \to {n_{Mg}} = \frac{{4,56}}{{24}} = 0,19\,\,mol\) Quá trình trao đổi electron: Mg0 → Mg+2 + 2e 4H+ + NO3- + 3e → NO + 2H2O 0,19 → 0,38 0,24 ← 0,06 ← 0,18 ← 0,06 10H+ + NO3- + 8e → NH4+ + 3H2O 0,2 ← 0,02 ← 0,16 → 0,02 2H+ + 2e → H2 0,04 ← 0,04 ← 0,02 Ta thấy: ne nhường = 2nMg phản ứng = 0,38 mol ≠ ne nhận = 3nNO + 2nH2 = 3.0,06 + 2.0,02 = 0,22 → Phản ứng có tạo muối amoni \({n_{NH_4^ + }} = \frac{{2{n_{Mg}} - 3{n_{NO}} - 2{n_{{H_2}}}}}{8} = 0,02\,\,mol\) \({n_{{H^ + }}} = 4{n_{NO}} + 10{n_{NH_4^ + }} + 2{n_{{H_2}}} = 0,48\,\,mol \to {n_{SO_4^{2 - }}} = \frac{1}{2}{n_{{H^ + }}} = 0,24\,\,mol\) \({n_{NO_3^ - }} = {n_{NO}} + {n_{NH_4^ + }} = 0,08\,\,mol \to {n_{{K^ + }}} = {n_{NO_3^ - }} = 0,08\,\,mol\) Dung dịch X chứa Mg2+(0,19 mol), K+ (0,08 mol), SO42- (0,24 mol), NH4+ 0,02 mol \( \to m = 0,19.24 + 0,08.39 + 0,24.96 + 0,02.18 = 31,08\,\,gam\) Câu hỏi 7 : Hỗn hợp X gồm Al, Fe3O4, FeO và CuO (trong đó oxi chiếm 27% khối lượng hỗn hợp). Cho 1,568 lít khí CO (đktc) đi qua m gam X nung nóng, sau một thời gian thu được hỗn hợp chất rắn Y và hỗn hợp khí Z có khối lượng 3 gam. Hòa tan hoàn toàn Y trong dung dịch HNO3 loãng dư, thu được dung dịch chứa 28,3092 gam muối và 1,008 lít khí NO (ở đktc, là sản phẩm khử duy nhất). Giá trị m gần nhất với giá trị nào sau đây?
Đáp án: A Phương pháp giải: Quy đổi X thành Al, Fe, Cu và O với mO = 0,27m → nO (mol) Ta có CO + O → CO2 nCO →BTKL có mO phản ứng → nO phản ứng → nO(Y) Khi Y + HNO3 Bảo toàn e có 3nNO + 2nO(Y) = 3nAl + 3nFe + 2nCu Lại có mmuối = mKL + mNO3- = (m - 0,27m) + 62.(3nAl + 3nFe + 2nCu) → m Lời giải chi tiết: Quy đổi X thành Al, Fe, Cu và O với mO = 0,27m → nO = 0,016875m (mol) - Phản ứng khử oxit KL bằng CO có thể viết là: CO + O → CO2 Ta có: mCO bđ + mO pư = mZ → mO pư = 3 - 0,07.28 = 1,04 gam → nO pư = 0,065 mol → nO(Y) = 0,016875m - 0,065 (mol) - Khi Y + HNO3 thì nNO = 0,045 mol Bảo toàn e có: 3nNO + 2nO(Y) = 3nAl + 3nFe + 2nCu = 3.0,045 + 2.(0,016875m - 0,065) = 0,03375m + 0,005 (mol) Lại có: mmuối = mKL + mNO3- = (m - 0,27m) + 62.(3nAl + 3nFe + 2nCu) = 28,3092 → 0,73m + 62.(0,03375m + 0,005) = 28,3092 → m = 9,92 gam gần nhất với 9,9 gam Đáp án A Câu hỏi 8 : Cho 5,1 gam hỗn hợp A gồm hai kim loại Mg và Al có tỉ lệ mol 1:1 tác dụng vừa đủ với dung dịch gồm KNO3 và HCl đến khi các phản ứng xảy ra hoàn toàn thu được dung dịch B và hỗn hợp khí có thể tích 3,36 lít (đktc) gồm NO và H2 có tỉ khối của B so với H2 bằng 31/3. Cô cạn cẩn thận dung dịch B thu được m gam muối. Tính giá trị m ? Phương pháp giải: - Từ tổng khối lượng hỗn hợp KL và tỉ lệ mol ta tính được số mol từng KL. - Dựa vào tỉ khối và tổng thể tích của khí ta tính được số mol từng khí. - Tóm tắt: A + KNO3 + HCl → 0,1 mol NO và 0,05 mol H2 So sánh: ne nhường = 2nMg + 3nAl > n e nhận = 3nNO + 2nH2 nên phản ứng có tạo NH4+ Viết các quá trình cho nhận e tính được mol của NH4+ Vì phản ứng tạo cả H2 nên NO3- hết + Bảo toàn N: nKNO3 = nNO + nNH4+ + Xác định các ion có trong dung dịch sau pư. BTĐT tính được nCl- = nK+ + 2nMg2+ + 3nAl3+ + nNH4+ → m = mmuối = mion Lời giải chi tiết: - Đặt số mol của Mg và Al trong A là x mol (vì số mol 2 chất bằng nhau) → mA = 24x + 27x = 5,1 → x = 0,1 mol - Xét hỗn hợp khí NO và H2 có số mol lần lượt là a và b mol Ta có: nhh = a + b = 0,15 mol (1) mhh = Mhh.nhh => 30a + 2b = 31/3.2.0,15 = 3,1 (2) Giải (1) và (2) có a = 0,1 mol và b = 0,05 mol - Tóm tắt: A + KNO3 + HCl → 0,1 mol NO và 0,05 mol H2 QT nhường electron: Mg → Mg+2 + 2e Al → Al+3 + 3e QT nhận electron: N+5+5 + 3e → N+2 2H+ + 2e → H2 Ta có: ne nhường = 2nMg + 3nAl = 0,1.2 + 0,1.3 = 0,5 mol n e nhận = 3nNO + 2nH2 = 0,1.3 + 0,05.2 = 0,4 mol => n e nhường > n e nhận => Sản phẩm khử của NO3- còn có NH4+ QT nhường electron: Mg → Mg+2 + 2e Al → Al+3 + 3e QT nhận electron: N+5+5 + 3e → N+2 2H+ + 2e → H2 N+5+5 + 8e → N-3 (NH4+) → nNH4+ = (0,5 - 0,4) : 8 = 0,0125 mol Vì phản ứng tạo cả H2 nên NO3- hết Bảo toàn N: nKNO3 = nNO + nNH4+ = 0,1 + 0,0125 = 0,1125 mol → Dung dịch muối gồm có \(\left\{ \begin{array}{l}{K^ + }:0,1125\,mol\\M{g^{2 + }}:0,1\,mol\\A{l^{3 + }}:0,1\,mol\\NH_4^ + :0,0125\,mol\\C{l^ - }\end{array} \right.\) BTĐT: nCl- = nK+ + 2nMg2+ + 3nAl3+ + nNH4+ = 0,625 mol → m = mmuối = mion = 31,9 gam Câu hỏi 9 : Hoà tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, thu được dung dịch Y chứa 8m gam muối và x mol một chất khí duy nhất là N2O. Cho dung dịch NaOH dư vào Y, kết thúc thí nghiệm có 25,84 gam NaOH đã phản ứng. Giá trị của x gần nhất với
Đáp án: D Phương pháp giải: Khi cho m g Al vào thì → mAl(NO3)3 = (m/27).213 < 8m → Muối có NH4NO3 → nNH4NO3 theo m - Viết các quá trình cho - nhận e. Áp dụng định luật bảo toàn e => Phương trình (1) ẩn m, x - Khi cho NaOH vào Y: NaOH + NH4NO3 → NaNO3 + NH3 + H2O 4NaOH + Al(NO3)3 → 3NaNO3 + NaAlO2 + 2H2O Từ số mol NaOH phản ứng => Phương trình (2) ẩn m, x Giải hệ (1) và (2) tìm được m và x. Lời giải chi tiết: Khi cho m g Al vào thì → mAl(NO3)3 = (m/27).213 < 8m → Muối có NH4NO3 Ta có: nAl = \(\frac{m}{{27}}\) mol → nNH4NO3 = \(\frac{{8m - 213.\frac{m}{{27}}}}{{80}} = \frac{m}{{720}}\) mol QT cho e: Al → Al+3 + 3e QT nhận e: 2N+5 + 8e → 2N+1 ; N+5 + 8e → N-3 - Bảo toàn e: 3nAl = 8nN2O + 8nNH4NO3 =>\(\frac{m}{{27}}.3 = 8{\rm{x}} + 8.\frac{m}{{720}}\) (1) - Khi cho NaOH vào Y: NaOH + NH4NO3 → NaNO3 + NH3 + H2O 4NaOH + Al(NO3)3 → 3NaNO3 + NaAlO2 + 2H2O → nNaOH phản ứng = nNH4NO3 + 4nAl(NO3)3 → 0,646 =\(\frac{m}{{720}} + 4.\frac{m}{{27}}\) → m = 4,32 gam (2) Từ (1) và (2) suy ra x = 0,054 mol → x gần nhất với 0,055 Đáp án D Câu hỏi 10 : Hòa tan hoàn toàn 9,942 gam hỗn hợp gồm Al và Mg vào dung dịch HNO3 loãng, thu được dung dịch X và 3,136 lít (đktc) hỗn hợp Y gồm 2 khí không màu trong đó có một khí hóa nâu trong không khí, khối lượng của Y là 5,18 gam. Cô cạn cẩn thận dung dịch A thu được m gam chất rắn. Nung lượng chất rắn này đến khối lượng không đổi được 17,062 gam chất rắn. Giá trị gần đúng nhất của m là:
Đáp án: C Phương pháp giải: - Xét hỗn hợp khí Y: Khí không màu hóa nâu trong không khí là NO → MY = 5,18 : 0,14 = 37 → Khí còn lại có M > 37 → Y có khí N2O và NO với số mol x và y mol → Lập hệ theo số mol và khối lượng của Y giải x và y - Tóm tắt sơ đồ:
Đặt số mol Al và Mg lần lượt là a và b mol thì → pt (1) Bảo toàn nguyên có có nAl2O3 = ½ a và nMgO = b mol → pt (2) Giải hệ trên được a và b - Bảo toàn electron: 3nAl + 2nMg = 3nNO + 8nN2O + 8nNH4NO3 → nNH4NO3 Lời giải chi tiết: - Xét hỗn hợp khí Y: Khí không màu hóa nâu trong không khí là NO → MY = 5,18 : 0,14 = 37 → Khí còn lại là khí không màu có M > 37 (N2O) Giả sử Y chứa N2O (x mol)và NO (y mol) → \(\left\{ \begin{array}{l}44{\rm{x}} + 30y = 5,18\\x + y = 0,14\end{array} \right. \to x = y = 0,07\,mol\) - Sơ đồ tóm tắt: Đặt số mol Al và Mg lần lượt là a và b mol: + m hh = 27a + 24b = 9,942 (1) + Chất rắn sau nung chứa: nAl2O3 = 0,5nAl = 0,5a (mol) và nMgO = nMg = b (mol) (Áp dụng bảo toàn nguyên tố) → m chất rắn = 51a + 40b = 17,062 (2) Giải hệ trên được a = 0,082 mol và b = 0,322 mol Bảo toàn electron: 3nAl + 2nMg = 3nNO + 8nN2O + 8nNH4NO3 → 3.0,082 + 2.0,322 = 3.0,07 + 8.0,07 + 8nNH4NO3 → nNH4NO3 = 0,015 mol → Khi cô cạn dung dịch thu được: 0,015 mol NH4NO3; 0,082 mol Al(NO3)3 và 0,322 mol Mg(NO3)2 → m = 0,015.80 + 0,082.213 + 0,322.148 = 66,322 gam gần nhất với 66,323 gam Đáp án C Câu hỏi 11 : Hỗn hợp X gồm Fe và Cu. Hòa tan hoàn toàn m gam X trong dung dịch HNO3 đặc nóng dư thì có 2 mol HNO3 đã phản ứng. Mặt khác, cho m gam X tác dụng với oxi, thu được 25,2 gam chất rắn Y. Hòa tan hoàn toàn Y trong dung dịch H2SO4 đặc nóng dư thì có 0,8 mol H2SO4 đã phản ứng, thu được muối sunfat và SO2 là sản phẩm khử duy nhất của H2SO4. Giá trị của m là:
Đáp án: D Phương pháp giải: Bài tập {KL, Oxit} + Axit oxi hóa: - Quy hỗn hợp về dạng: KL, O → Công thức giải nhanh: ne = ne KL = nNO2 + 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 + 2nO nHNO3 = 2nNO2 + 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 + 2nO Lời giải chi tiết: *Thí nghiệm 1: X + HNO3 đặc nóng → sản phẩm khử là NO2 → CT giải nhanh: nHNO3 = 2nNO2 → nNO2 = 1 mol → Bảo toàn e: 3nFe + 2nCu = nNO2 = 1 mol *Thí nghiệm 2: Quy hỗn hợp oxi về dạng Fe, Cu, O → Bảo toàn e: 3nFe + 2nCu = 2nO + 2nSO2 → nSO2 = 0,5 - nO Bảo toàn điện tích: 3nFe + 2nCu = 2nSO4 → nSO4 = 0,5 mol Bảo toàn S: nH2SO4 = nSO2 + nSO4 muối → 0,8 = 0,5 - nO + 0,5 → nO = 0,2 mol → mKL = mY - mO = 25,2 - 0,2.16 = 22 gam Đáp án D Câu hỏi 12 : Hỗn hợp X gồm FeS2 và MS có số mol bằng nhau. M là kim loại có hóa trị không đổi. Cho 6,51 gam X tác dụng hoàn toàn với dung dịch HNO3 dư, nung nóng thu được dung dịch A và 13,216 lít (đktc) hỗn hợp khí B (gồm NO2 và NO) có khối lượng 26,34 gam. Thêm lượng dư dung dịch BaCl2 loãng dư vào A thấy có m1 gam kết tủa trắng. Xác định kim loại M và tính giá trị m1. Phương pháp giải: - Đặt số mol của FeS2 và MS là x mol Từ khối lượng hỗn hợp => phương trình (1) - Xét hỗn hợp khí B có nNO2 = a mol và nNO = b mol. Lập hệ phương trình về số mol và khối lượng khí xác định được a, b. - Viết quá trình cho - nhận e: QT cho e: FeS2 → Fe+3 + 2S+6 + 15e MS → M+2 + S+6 + 8e QT nhận e: N+5 +1e → N+4 N+5 + 3e → N+2 Áp dụng bảo toàn e: 15nFeS2 + nMS = nNO2 + 3nNO => phương trình (2) Giải hệ (1) và (2) thu được giá trị của M => Kim loại - Dung dịch thu được sau phản ứng có Zn2+, Fe3+, SO42-, NO3- và H+ Bảo toàn nguyên tố S: nSO42-(dd A) = 2nFeS2 + nZnS Khi cho BaCl2 dư vào dung dịch A: SO42- + Ba2+ → BaSO4 Từ mol SO42- tính được mol BaSO4 => Giá trị m1 Lời giải chi tiết: - Đặt số mol của FeS2 và MS là x mol → mA = 120x + (M + 32)x = 6,51 gam (1) - Xét hỗn hợp khí B có nNO2 = a mol và nNO = b mol: \(\left\{ \begin{array}{l}{n_B} = a + b = 0,59\\{m_B} = 46{\rm{a + 30b = 26,34}}\end{array} \right. \to \left\{ \begin{array}{l}a = 0,54\,mol\\b = 0,05\,mol\end{array} \right.\) - Quá trình cho - nhận e: QT cho e: FeS2 → Fe+3 + 2S+6 + 15e MS → M+2 + S+6 + 8e QT nhận e: N+5 +1e → N+4 N+5 + 3e → N+2 Áp dụng bảo toàn e: 15nFeS2 + nMS = nNO2 + 3nNO => 15x + 8x = 0,54 + 0,05.3 = 0,69 => x = 0,03 mol (2) Từ (1) và (2) => M = 65 (Zn) - Dung dịch thu được sau phản ứng có Zn2+, Fe3+, SO42-, NO3- và H+ Bảo toàn nguyên tố S: nSO42-(dd A) = 2nFeS2 + nZnS = 2.0,03 + 0,03 = 0,09 mol Khi cho BaCl2 dư vào dung dịch A: SO42- + Ba2+ → BaSO4 => m1 = mBaSO4 = 0,09.233 = 20,97 gam Câu hỏi 13 : Cho hỗn hợp gồm Mg và Al (tỉ lệ mol 1:1) tan vừa đủ trong dung dịch gồm HCl; 0,05 mol NaNO3 và 0,1 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối; 0,125 mol hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Tỉ khối của Y so với H2 là 12,2. Giá trị của m gần nhất với giá trị nào sau đây?
Đáp án: D Phương pháp giải: - Biện luận các chất khí trong hỗn hợp khí sản phẩm => số mol các khí => Biện luận chất nào dư, chất nào hết sau phản ứng => Các chất trong dung dịch X (Chú ý kiểm tra xem có NH4+ trong dung dịch hay không) - Dựa vào định luật bảo toàn điện tích để tích số mol các ion trong dung dịch => Khối lượng chất tan trong X Lời giải chi tiết: Vì hỗn hợp khí thu được có dY/H2 = 12,2 => Mkhí = 12,2.2 = 24,4 Có 1 khí hóa nâu ngoài không khí (NO có M = 30 > 24,4) => khí còn lại có M < 24,4 => Chỉ có thể là H2 => NO3- hết trước H+. Ta có: nNO + nH2 = 0,125 mol (1) Và: mkhí = 30nNO + 2nH2 = 0,125.24,4 = 3,05g (2) Từ (1,2) => nNO = 0,1 ; nH2 = 0,025 mol Bảo toàn nguyên tố N: nNaNO3 + nKNO3 = nNO + nNH4 (nếu có) => nNH4 = 0,05 mol Bảo toàn electron: 3nAl + 2nMg = 3nNO + 8nNH4 + 2nH2 = 3.0,1 + 8.0,05 + 0,025.2 = 0,75 mol Và: nMg = nAl (Đề bài) => nMg = nAl = 0,15 mol Vậy dung dịch X chứa: 0,15 mol Mg2+ ; 0,15 mol Al3+ ; 0,05 mol Na+ ; 0,1 mol K+ ; 0,05 mol NH4+ ; Cl- Bảo toàn điện tích: nCl = 2nMg + 3nAl + nNa + nK + nNH4 = 0,95 mol => m = åmion = 0,15.24 + 0,15.27 + 0,05.23 + 0,1.39 + 0,05.18 + 0,95.35,5 = 47,235g (Gần nhất với giá trị 47,3g) Đáp án D Câu hỏi 14 : Cho 4,08 gam Mg tác dụng với dung dịch hỗn hợp Cu(NO3)2 và H2SO4 đun nóng, khuấy đều đến khi phản ứng xảy ra hoàn toàn được dung dịch X và 0,896 lít hỗn hợp khí Y (đktc) gồm hai khí không màu, trong đó có một khí hóa nâu ngoài không khí và 1,76 gam hỗn hợp hai kim loại có cùng số mol. Biết tỉ khối của Y đối với H2 là 8. Khối lượng muối tạo thành trong dung dịch X gần nhất với giá trị nào sau đây?
Đáp án: A Phương pháp giải: - Biện luận các chất trong hỗn hợp khí và hỗn hợp kim loại => Chất nào dư, chất nào hết sau phản ứng => Số mol các chất trong các hỗn hợp => Số mol các chất phản ứng ban đầu => Tìm được các muối trong dung dịch X Lời giải chi tiết: Mg + (Cu(NO3)2, H2SO4) . Ta thấy: +) Tạo hỗn hợp 2 kim loại => Cu, Mg dư +) Tạo hỗn hợp 2 khí có M = 8.2 = 16 g/mol. 1 khí hóa nâu ngoài không khí => NO (M = 30) => Khí còn lại phải có M < 16 => H2 => H+ dư hơn so với NO3-. - nY = 0,896: 22,4 = 0,04 mol = nNO + nH2 Và: mY = mNO + mH2 = 30nNO + 2nH2 = 16.0,04 = 0,64 => nNO = nH2 = 0,02 mol - Thứ tự phản ứng sẽ là: Mg + H+ + NO3- Mg + Cu2+ Mg + H+ - Gọi số mol Cu2+ phản ứng là x => nCu = x = nMg dư => mCu + mMg dư = 1,76g = 64x + 24x => x = 0,02 mol nMg bđ = 4,08: 24 = 0,17 mol => nMg pứ = 0,17 – 0,02 = 0,15 mol Giả sử có NH4+ trong dung dịch X => Bảo toàn Nito: 2nCu(NO3)2 = nNO + nNH4 => nNH4 = 2.0,02 – 0,02 = 0,02 mol => Trong dung dịch X có 0,15 mol MgSO4 và 0,01 mol (NH4)2SO4 => mmuối = 0,15.120 + 0,01.132 = 19,32g (Gần nhất với giá trị 19,5g) Đáp án A Câu hỏi 15 : Để 26,88 gam phôi Fe ngoài không khí một thời gian, thu được hỗn hợp rắn X gồm Fe và các oxit. Hòa tan hết X trong 288 gam dung dịch HNO3 31,5%, thu được dung dịch Y chứa các muối và hỗn hợp khí Z gồm 2 khí, trong đó oxi chiếm 61,11% về khối lượng. Cô cạn Y, rồi nung đến khối lượng không đổi thấy khối lượng chất rắn giảm 67,84 gam. Xác định nồng độ % Fe(NO3)3 trong Y?
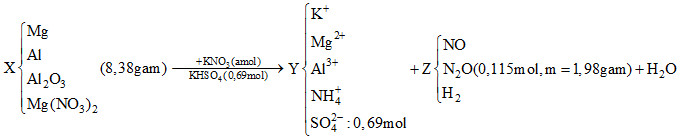
Đáp án: C Phương pháp giải: Cô cạn Y thu được chất rắn khan gồm Fe(NO3)2 (a mol) và Fe(NO3)3 (b mol). Bảo toàn nguyên tố Fe ta có: a + b = nFe = 26,88 : 56 = 0,48 (mol). Khi nung muối đến khối lượng không đổi: 2 Fe(NO3)2 → Fe2O3 + 4NO2 + 1/2O2 a mol → 2a 0,25a 2 Fe(NO3)3 → Fe2O3 + 6NO2 + 3/2O2 b mol → 3b 0,75b Sau khi nung đến khối lượng không đổi thì khối lượng chất rắn giảm chính là tổng khối lượng NO2 và O2 thoát ra. Từ đó lập hệ phương trình tìm được a và b. Khi đó tính được nNO3- (Y) = 2a + 3b Dùng bảo toàn nguyên tố N để tính được nN (Z) Từ oxi chiếm 61,11% về khối lượng nên tính được mZ, nO (Z). Quy đổi X thành Fe và O. Áp dụng định luật bảo toàn electron để tìm khối lượng X. Áp dụng định luật bảo toàn khối lượng ta có: mdung dịch Y = mX + mdd HNO3 - mZ Vậy tìm được nồng độ % của Fe(NO3)3. Lời giải chi tiết: Ta có: nHNO3 ban đầu = 1,44 mol Cô cạn Y thu được chất rắn khan gồm Fe(NO3)2 (a mol) và Fe(NO3)3 (b mol). Bảo toàn nguyên tố Fe ta có: a + b = nFe = 26,88 : 56 = 0,48 (mol). 2 Fe(NO3)2 → Fe2O3 + 4NO2 + 1/2O2 a mol → 2a 0,25a 2 Fe(NO3)3 → Fe2O3 + 6NO2 + 3/2O2 b mol → 3b 0,75b Sau khi nung đến khối lượng không đổi thì khối lượng chất rắn giảm chính là tổng khối lượng NO2 và O2 thoát ra. Ta có hệ: \(\left\{ \begin{array}{l}a + b = 0,48\\46(2a + 3b) + 32(0,25a + 0,75b) = 67,84\end{array} \right. \to \left\{ \begin{array}{l}a = 0,16{\rm{ mol}}\\{\rm{b = 0,32 mol}}\end{array} \right.\) → nNO3- (Y) = 2a + 3b = 1,28 mol Bảo toàn nguyên tố N ta có: nN(trong Z) = nHNO3 – nNO3- (Y) = 1,44 - 1,28 = 0,16 mol Vì trong hỗn hợp khí Z oxi chiếm 61,11% về khối lượng nên nitơ chiếm 38,89% về khối lượng. → mZ = mN.(100/38,89) = 0,16.14.(100/38,89) = 5,76 gam Ta có: nO (Z) = 5,76.61,11%/16 = 0,22 (mol) Quy đổi X thành Fe (0,48 mol) và O (x mol). Áp dụng định luật bảo toàn electron: 2.nFe2+ + 3.nFe3+ + 2.nO (Z) = 2.nO (X) + 5.nN (Z) => 0,16.2 + 0,32.3 + 0,22.2 = 2x + 0,16.5 → x = 0,46 mol → mX = mFe + mO = 26,88 + 0,46.16 = 34,24 (gam) Sơ đồ: X + HNO3 → Muối + Z + H2O Áp dụng định luật bảo toàn khối lượng ta có: mdung dịch Y = mX + mdd HNO3 - mZ = 34,24 + 288 – 5,76 = 316,48 (gam) Vậy \(C{\% _{Fe\left( {NO3} \right)3}} = \frac{{0,32.242.100\% }}{{316,48}} = {\text{ }}24,47\% \) Đáp án C Câu hỏi 16 : Hỗn hợp X gồm Mg, Al, Al2O3 và Mg(NO3)2. Cho 8,38 gam hỗn hợp X tác dụng với dung dịch hỗn hợp chứa a mol KNO3 và 0,69 mol KHSO4 thu được dung dịch Y chỉ chứa các muối trung hoà; 2,576 lít hỗn hợp khí Z (đktc) gồm NO, N2O và H2 có tỉ khối so với hiđro là 198/23. Dung dịch Y tác dụng tối đa với dung dịch chứa 0,68 mol NaOH thu được 12,18 gam kết tủa và có 0,448 lít khí thoát ra ở điều kiện tiêu chuẩn. Phần trăm khối lượng Al trong hỗn hợp X là
Đáp án: B Phương pháp giải: Do Y tác dụng với dung dịch NaOH thu được khí nên Y chắc chắn có chứa NH4+. Do hỗn hợp X tác dụng với dung dịch hỗn hợp KNO3 và KHSO4 thu được Y và hỗn hợp khí Z có chứa H2 nên trong dung dịch Y không còn ion NO3- (do tính oxi hóa của ion NO3- mạnh hơn H+). Mà Y chỉ chứa các muối trung hòa nên thành phần dung dịch Y gồm K+, Mg2+, Al3+, NH4+, SO42-. Sơ đồ phản ứng:
Khi cho Y tác dụng tối đa với dung dịch NaOH thì kết tủa cuối cùng thu được là Mg(OH)2 và khí thoát ra là khí NH3. Từ khối lượng kết tủa (là Mg(OH)2) ta tính được số mol Mg2+ có trong dung dịch Y. Từ thể tích khí thoát ra (là khí NH3) ta tính được số mol của ion NH4+ trong dung dịch Y. Từ số mol NaOH phản ứng tối đa với dung dịch Y ta tính được số mol Al3+ có trong dung dịch Y. Áp dụng định luật bảo toàn điện tích với dung dịch Y ta tính được số mol ion K+, từ đó suy ra nKNO3 Dùng định luật bảo toàn khối lượng ta tính được nH2O Áp dụng bảo toàn nguyên tố H ta tìm được nH2 Từ đó tính được số mol của NO và N2O trong hỗn hợp khí Z. Học sinh dựa vào các bán phản ứng để tính được số mol H+ phản ứng bằng nH+ phản ứng = 6.nAl2O3 + 10.nNH4+ + 4.nNO + 10.nN2O + 2.nH2 Từ đó học sinh tính được số mol Al2O3 trong hỗn hợp X. Dùng định luật bảo toàn nguyên tố Al ta tính được số mol Al trong hỗn hợp X Từ đó tính được % khối lượng Al trong hỗn hợp X. Lời giải chi tiết: Do Y tác dụng với dung dịch NaOH thu được khí nên Y chắc chắn có chứa NH4+. Do hỗn hợp X tác dụng với dung dịch chứa hỗn hợp KNO3 và KHSO4 thu được Y và hỗn hợp khí Z có chứa H2 nên trong dung dịch Y không còn ion NO3-. Do đó thành phần dung dịch Y gồm K+, Mg2+, Al3+, NH4+, SO42-. Sơ đồ phản ứng:
Khi cho Y tác dụng tối đa với dung dịch NaOH thì xảy ra các phương trình phản ứng sau: NH4+ + OH- → NH3↑ + H2O Mg2+ + 2OH- → Mg(OH)2↓ Al3+ + 3OH- → Al(OH)3↓ Al(OH)3 + OH- → AlO2- + 2H2O Vậy kết tủa cuối cùng thu được là Mg(OH)2 và khí thoát ra là khí NH3. Ta có: mMg(OH)2 = 12,18 gam → nMg(OH)2 = 0,21 mol → nMg2+ = 0,21 mol VNH3 = 0,448 lít → nNH3 = 0,02 mol → nNH4+ = 0,02 mol Ta có số mol NaOH phản ứng tối đa bằng: nNaOH phản ứng = 2.nMg2+ + 4.nAl3+ + nNH4+ = 0,68 mol Suy ra số mol Al3+ bằng (0,68 - 0,02 - 0,21.2) : 4 = 0,06 mol Áp dụng định luật bảo toàn điện tích với dung dịch Y ta suy ra nK+ = 0,76 mol → nKNO3 = 0,76 - 0,69 = 0,07 mol Áp dụng định luật bảo toàn khối lượng ta có: mX + mKNO3 + mKHSO4 = mchất tan trong Y + mZ + mH2O → mH2O = mX + mKNO3 + mKHSO4 - (mchất tan trong Y + mZ) = 8,38 + 0,07. 101 + 0,69.136 – (0,76.39 + 0,21.24 + 0,06.27 + 0,02.18 + 0,69. 96 + 1,98) = 4,41 gam → nH2O = 0,245 mol Áp dụng định luật bảo toàn nguyên tố H ta có: nKHSO4 = 4.nNH4+ + 2.nH2 + 2.nH2O → nH2 = 0,06 mol Gọi x, y lần lượt là số mol của NO và N2O. Ta có: \(\left\{ \begin{array}{l}x + y = 0,115 - 0,06\\30x + 44y = 1,98-0,06.2\end{array} \right.\) Giải hệ trên được x = 0,04 và y = 0,015 Khi cho hỗn hợp X tác dụng với dung dịch chứa hỗn hợp KNO3 và KHSO4 thì xảy ra các bán phản ứng sau: Al2O3 + 6H+ → 2Al3+ + 3H2O NO3- + 10H+ + 8e → NH4+ + 3H2O NO3- + 4H+ + 3e → NO + 2H2O 2 NO3- + 10H+ + 8e → N2O + 5H2O 2H+ + 2e → H2 Do đó: nH+ phản ứng = 6.nAl2O3 + 10.nNH4+ + 4.nNO + 10.nN2O + 2.nH2 = 0,69 mol → nAl2O3 = (0,69 - 0,02.10 - 0,04.4 - 0,015.10 - 0,06.2) : 6 = 0,01 mol Áp dụng định luật bảo toàn nguyên tố Al ta tính được số mol Al trong hỗn hợp X bằng: nAl (X) = nAl3+ - 2.nAl2O3 = 0,06 – 2.0,01 = 0,04 mol Vậy %mAl = \(\frac{{0,04.27.100\% }}{{8,38}}\) = 12,89% Đáp án B Câu hỏi 17 : Cho 23,82 gam hỗn hợp X gồm bột Zn và Mg (tỉ lệ mol theo thứ tự là 5:3) tan vừa đủ trong hỗn hợp dung dịch gồm NaNO3 và NaHSO4 thu được dung dịch Y chỉ chứa m gam hỗn hợp các muối trung hòa và 4,704 lít hỗn hợp khí Z (đktc) gồm hai khí không màu, trong đó có một khí hoá nâu trong không khí. Tỉ khối của Z so với H2 là 13. Giá trị m gần nhất là
Đáp án: B Phương pháp giải: Từ tỉ lệ mol và khối lượng hỗn hợp ta tính được số mol của Zn, Mg. X + NaNO3 + NaHSO4 → muối trung hòa + khí Z Khí Z chứa khí không màu hóa nâu là NO. Dựa vào tỉ khối của Z so với H2 suy ra khí còn lại là H2 → tìm số mol từng khí trong Z Các bán phản ứng: 4H+ + NO3- + 3e → NO + 2H2O Zn → Zn+2+ 2e 2H+ + 2e → H2 Mg → Mg+2 + 2e So sánh: ne nhường = 2nZn + 2nMg và ne nhận = 3nNO + nH2 nếu bằng thì không tạo NH4+ Nếu e nhường nhiều hơn e nhận thì còn phản ứng tạo ra NH4+: 10H+ + NO3- + 8e → NH4++ 3H2O → nNH4+ Bảo toàn H+ tìm số mol NaHSO4 Bảo toàn N thì tìm nNaNO3 Lời giải chi tiết: Đặt nZn = x mol và nMg = y mol thì ta có hệ phương trình sau: \(\left\{ \begin{array}{l}65x + 24y = 23,82\\x:y = 5:3\end{array} \right. \to \left\{ \begin{array}{l}x = 0,3\,mol\\y = 0,18\,mol\end{array} \right.\) X + NaNO3 + NaHSO4 → muối trung hòa + khí Z Xét khí Z có nZ = 0,21 mol và Z có 1 khí không màu hóa nâu ngoài không khí → Z có khí NO Vì MZ = 13.2 = 26 < MNO nên Z còn 1 khí không màu có M < 26 → khí này là H2 Ta có: \(\left\{ \begin{array}{l}{n_{{H_2}}} + {n_{NO}} = 0,21\\2{n_{{H_2}}} + 30{n_{NO}} = {n_Z}.M_Z^{} = 0,21.26 = 5,46\end{array} \right. \to \left\{ \begin{array}{l}{n_{{H_2}}} = 0,03\,mol\\{n_{NO}} = 0,18\,mol\end{array} \right.\) Các bán phản ứng: 4H+ + NO3- + 3e → NO + 2H2O Zn → Zn+2+ 2e 2H+ + 2e → H2 Mg → Mg+2 + 2e Vì ne nhường = 2nZn + 2nMg = 2.0,3 + 2.0,18 = 0,96 mol > ne nhận = 3nNO + nH2 = 3.0,18 + 2.0,03 = 0,6 mol → còn phản ứng tạo ra NH4+: 10H+ + NO3- + 8e → NH4++ 3H2O → nNH4+ = (0,96 - 0,6) : 8 = 0,045 mol Vì dung dịch thu được toàn muối trung hòa nên: nNaHSO4 = nH+phản ứng = 4.0,18 + 2.0,03 + 10.0,045 = 1,23 mol Bảo toàn N: nNaNO3 = nNH4+ + nNO = 0,045 + 0,18 = 0,225 mol → Dung dịch thu được sau phản ứng có \(\left\{ \begin{array}{l}Z{n^{2 + }}:0,3\\M{g^{2 + }}:0,18\,mol\\N{a^ + }:1,23 + 0,225 = 1,455\,mol\\NH_4^ + :0,045\,mol\\SO_4^{2 - }:1,23\,mol\end{array} \right.\) → mmuối = mion = 176,175 gam → mmuối gần nhất với 176 gam Đáp án B Câu hỏi 18 : Cho m gam hỗn hợp G gồm Mg và Al có tỉ lệ mol 4 : 5 vào dung dịch HNO3 20%. Sau khi các kim loại tan hết có 6,72 lít hỗn hợp X gồm NO, N2O, N2 bay ra (đktc) và được dung dịch T. Thêm một lượng O2 vừa đủ vào X, sau phản ứng được hỗn hợp khí Y. Dẫn Y từ từ qua dung dịch KOH dư, có 4,48 lít hỗn hợp khí Z đi ra (đktc). Tỉ khối của Z đối với H2 bằng 20. Nếu cho dung dịch NaOH vào dung dịch T thì lượng kết tủa lớn nhất thu được là (m + 39,1) gam. Biết HNO3 dùng dư 20% so với lượng cần thiết. Nồng độ phần trăm của Al(NO3)3 trong T gần nhất với
Đáp án: D Phương pháp giải: Phương pháp đường chéo, bảo toàn e, bảo toàn nguyên tố. Lời giải chi tiết: Khi thêm O2 vừa đủ vào Y thu được các khí NO2, N2O, N2. Dẫn qua dung dịch KOH dư thì NO2 bị hấp thụ khí còn lại là N2O và N2. => nNO = nNO2 = 0,3 – 0,2 = 0,1 mol Áp dụng đường chéo cho hỗn hợp Z:
Mà nN2O + nN2 = nZ = 0,2 mol => nN2O = 0,15 và nN2 = 0,05 Đặt: nMg = 4x và nAl = 5x (mol) => nMg(OH)2 = 4x và mAl(OH)3 = 5x m kết tủa max = mKL + mOH- => m + 39,1 = m + 17(4x.2 + 5x.3) => x = 0,1 => nMg = 0,4 mol và nAl = 0,5 mol Ta thấy: 2nMg + 3nAl > 3nNO + 8nN2O + 10nN2 => Có tạo muối NH4NO3 Bảo toàn e: 2nMg + 3nAl = 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 => 2.0,4 + 3.0,5 = 3.0,1 + 8.0,15 + 10.0,05 + 8nNH4NO3 => nNH4NO3 = 0,0375 mol Công thức tính nhanh: nHNO3 pư = 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 = 2,875 mol => nHNO3 bđ = 2,875 + 2,875.(20/100) = 3,45 mol => m dd HNO3 = 3,45.63.(100/20) = 1086,75 gam m dd sau pư = mMg + mAl + m dd HNO3 – mNO – mN2O – mN2 = 0,4.24 + 0,5.27 + 1086,75 – 0,1.30 – 0,15.44 – 0,05.28 = 1098,85 gam Ta có: nAl(NO3)3 = nAl = 0,5 mol → %mAl = (0,5.213/1098,85).100% = 9,69% gần nhất với 9,7% Đáp án D Câu hỏi 19 : Hỗn hợp X gồm Al, Fe2O3, Fe3O4, CuO, Cu (trong đó oxi chiếm 25,39% về khối lượng hỗn hợp). Cho m gam hỗn hợp X tác dụng với 8,96 lít khí CO (ở đktc) sau một thời gian thu được hỗn hợp rắn Y và hỗn hợp khí Z có tỉ khối so với hidro là 19. Cho hỗn hợp Y tác dụng với dung dịch HNO3 loãng dư thu được dung dịch T và 7,168 lít khí NO (ở đktc, sản phẩm khử duy nhất). Cô cạn T thu được 3,456m gam muối khan. Giá trị gần nhất của m là
Đáp án: A Phương pháp giải: Bảo toàn nguyên tố, bảo toàn khối lượng. Lời giải chi tiết: - Xét hỗn hợp khí Z: MZ = 19.2 = 38 Đặt nCO = x và nCO2 = y (mol) BTNT “C”: nZ = nCO + nCO2 = nCO bđ => x + y = 0,4 (1) mZ = nZ.MZ => 28x + 44y = 38.0,4 (2) Giải (1) và (2) thu được x = 0,15 và y = 0,25 mol - Xét phản ứng khử bằng CO: nO pư = nCO2 = 0,25 mol mO(Y) = mO(X) – mO pư = 0,2539m – 0,25.16 = 0,2539m – 4 (gam) Sơ đồ bài toán: \(m(g)X\left\{ \matrix{ - Xét phản ứng của Y với HNO3: nNO3- = n e nhường = 2nO(Y) + 3nNO = \(2.{{0,2539m - 4} \over {16}} + 0,32.3\) (mol) => m muối T = mKL + mNO3 => \(3,456m = 0,7461m + 62(2.{{0,2539m - 4} \over {16}} + 0,32.3)\) Giải phương trình trên thu được: m = 38,4276 gam gần nhất với 38,43 gam Đáp án A Câu hỏi 20 : Hòa tan hết 13,04 gam hỗn hợp X gồm Fe3O4, Fe và Al (trong đó Al chiếm 27/163 về khối lượng) bằng 216,72 gam dung dịch HNO3 25% (dùng dư), thu được 228,64 gam dung dịch Y và thoát ra một chất khí N2 duy nhất. Để tác dụng tối đa các chất trong dung dịch Y cần 0,85 mol KOH. Nếu cô cạn dung dịch Y thu được chất rắn T. Nung T đến khối lượng không đổi thu được m gam chất rắn. Giá trị m gần nhất với:
Đáp án: B Phương pháp giải: Lập sơ đồ cả quá trình diễn biến phản ứng trong đề bài, từ đó biện luận chất rắn cuối cùng gồm thành phần gì => thành phần các chất trong các hỗn hợp. - Cần lưu ý xem Y có NH4+ hay không (Vì đề bài không nói rằng N2 là sản phẩm khử duy nhất) - Dựa vào định luật bảo toàn nguyên tố , bảo toàn electron => tính số mol các chất trong hỗn hợp (Ban đầu dựa vào Y + 0,85 mol KOH => thành phần các chất trong dung dịch sau phản ứng => số mol các chất cần thiết) Lời giải chi tiết: mAl = 13,04.27/163 = 2,16g => nAl = 2,16 : 27 = 0,08 mol mHNO3 = 216,72.25% = 54,18g => nHNO3 = 54,18 : 63 = 0,86 mol - Giả sử dung dịch Y có NH4+, ta có sơ đồ sau :
Bảo toàn khối lượng : mX + mdd HNO3 = mdd Y + mN2 => mN2 = 13,04 + 216,72 – 228,64 = 1,12g => nN2 = 1,12 : 28 = 0,04 mol Bảo toàn nguyên tố Al : nAl = nKAlO2 = 0,08 mol Bảo toàn nguyên tố K : nKOH = nKAlO2 + nKNO3 => nKNO3 = 0,85 – 0,08 = 0,77 mol Bảo toàn nguyên tố N : nHNO3 = nNO3(Y) + nNH4 + 2nN2. Mà nNO3(Y) = nKNO3 = 0,77 mol => nNH4 = 0,86 – 0,77 – 2.0,04 = 0,01 mol Gọi số mol Fe3O4 và Fe lần lượt là x và y Bảo toàn electron : nFe3O4 + 3nFe + 3nAl = 8nNH4 + 10nN2 (Với Fe3O4 : 3Fe+8/3 → 3Fe3+ + 1e) => x + 3y = 8.0,01 + 10.0,04 – 3.0,08 => x + 3y = 0,24 mol (1) Lại có : mX = 13,04 = mFe3O4 + mFe + mAl => 232x + 56y = 13,04 – 0,08.27 = 10,88g (2) Từ (1,2) => x = 0,03 ; y = 0,07 mol - Xét sơ đồ phản ứng trên,Chất rắn T gồm Fe2O3 và Al2O3. Bảo toàn nguyên tố : nFe2O3 = ½ (nFe + 3nFe3O4) = 0,08 mol nAl2O3 = ½ nAl = 0,04 mol => m = mFe2O3 + mAl2O3 = 0,08.160 + 0,04.102 = 16,88g (Gần nhất với giá trị 16,9g) Đáp án B Quảng cáo
|