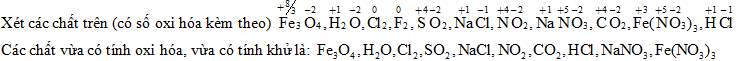40 bài tập về hóa trị và số OXH có lời giải (phần 1)Làm bàiQuảng cáo
Câu hỏi 1 : Nhận định chính xác về điện hoá trị:
Đáp án: A Phương pháp giải: Lời giải chi tiết: A. Đ. Trong hợp chất ion thì điện hóa trị chính là hóa trị của nguyên tố B. S vì trong hợp chất cộng hóa trị thì hóa trị của nguyên tố được gọi là cộng hóa tr C. S vì điện hóa trị được viết số trước dấu sau D. S vì điện hóa trị bằng điện tích của ion đó Đáp án A Câu hỏi 2 : Điện hoá trị của magie trong phân tử MgO là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 3 : Hoá trị của nitơ trong phân tử NH3 là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 4 : Số oxi hoá của N trong ion (NH4+) là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 5 : Cho các hợp chất: N2, N2O, NO, NO2. Số oxi hoá của nitơ trong các chất lần lượt là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 6 : Hợp chất nào có số oxi hoá của mangan (Mn) cao nhất là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 7 : Hợp chất mà crom có số oxi hoá +3 là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 8 : Hợp chất mà crom (Cr) có số oxi hoá khác so với các hợp chất còn lại là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: A crom có số oxi hóa +3 B, C, D crom có số oxi hóa +6 Đáp án A Câu hỏi 9 : Trong phân tử NH4NO3. Số oxi hoá của 2 nguyên tử nitơ (N) lần lượt là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 10 : Quy tắc nào sau đây chưa chính xác về việc xác định số oxi hoá:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 11 : Cho các chất: HClO, HClO2, HClO3, HClO4. Hợp chất mà clo (Cl) có số oxi hoá nhỏ nhất là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 12 : Cho các chất: HClO, HClO2, HClO3, HClO4. Số oxi hoá của clo (Cl) lần lượt là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 13 : Nhận định nào sau đây là đúng về điện hoá trị:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 14 : Nhận định nào sau đây chưa chính xác về hoá trị trong hợp chất cộng hoá trị:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Trong hợp chất cộng hóa trị, hóa trị của các nguyên tố không mang dấu => Đáp án B Câu hỏi 15 : Nhận định nào chưa chính xác về số oxi hoá:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 16 : Số oxi hoá của nitơ trong NH4+, NO2- và HNO3 lần lượt là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: NH4+: x + 4 = 1 => x = -3 NO2-: x - 4 = -1 => x = 3 HNO3: 1 + x - 6 = 0 => x = 5 => Đáp án B Câu hỏi 17 : Điện hoá trị của canxi (Ca) trong CaCl2 là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 18 : Điện hoá trị của clo (Cl) trong CaCl2 là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 19 : Hoá trị của nitơ trong phân tử NH3 là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 20 : Hợp chất mà trong đó số oxi hoá của cacbon bằng +4 là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 21 : Hợp chất mà trong đó số oxi hoá của nitơ bằng +1 là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: A nito có số oxi hóa +4 B nito có số oxi hóa +2 D nito có số oxi hóa -3 => Đáp án C Câu hỏi 22 : Hợp chất mà trong đó số oxi hoá của lưu huỳnh bằng +6 là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 23 : Hợp chất mà trong đó số oxi hoá của Cl là +5 là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 24 : Số oxi hoá của mangan (Mn) trong KMnO4 là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 25 : Số oxi hoá của crom (Cr) trong Na2Cr2O7 là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 26 : Số oxi hoá của crom (Cr) trong K2CrO4 là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 27 : Số oxi hoá của sắt (Fe) trong Fe3O4 là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 28 : Hợp chất nào sau đây magan (Mn) có số oxi hoá cao nhất:
Đáp án: D Phương pháp giải: Quy tắc xác định số oxi hóa: 1. Trong các đơn chất, số oxi hóa của nguyên tố bằng 0 2. Trong một phân tử, tổng số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng 0. 3. Trong các ion đơn nguyên tử, số oxi hóa của nguyên tố bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng số số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng điện tích của ion. 4. Trong hầu hết các hợp chất, số oxi hóa của H bằng +1 (trừ hiđrua kim loại). Số oxi hóa của O bằng -2 (trừ OF2 và peoxit). Lời giải chi tiết: Dựa vào quy tắc xác định số oxi hóa ta xác định được số oxi hóa của Mn trong các hợp chất: A. Mn có số oxi hóa là +2 B. Mn có số oxi hóa là +4 C. Mn có số oxi hóa là +6 D. Mn có số oxi hóa là +7 Đáp án D Câu hỏi 29 : Số oxi hoá của của nitơ (N) trong NO2 là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 30 : Trong các hợp chất sau, hợp chất mà mangan (Mn) có số oxi hoá lớn nhất là:
Đáp án: D Phương pháp giải: Quy tắc xác định số oxi hóa: 1. Trong các đơn chất, số oxi hóa của nguyên tố bằng 0 2. Trong một phân tử, tổng số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng 0. 3. Trong các ion đơn nguyên tử, số oxi hóa của nguyên tố bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng số số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng điện tích của ion. 4. Trong hầu hết các hợp chất, số oxi hóa của H bằng +1 (trừ hiđrua kim loại). Số oxi hóa của O bằng -2 (trừ OF2 và peoxit). Lời giải chi tiết: A. Mn có số oxi hóa +2 B. Mn có số oxi hóa +4 C. Mn có số oxi hóa +6 D. Mn có số oxi hóa +7 Đáp án D Câu hỏi 31 : Số oxi hoá của clo (Cl) trong các hợp chất: HClO, HClO2, HClO3, HClO4 lần lượt là:
Đáp án: A Phương pháp giải: Quy tắc xác định số oxi hóa: 1. Trong các đơn chất, số oxi hóa của nguyên tố bằng 0 2. Trong một phân tử, tổng số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng 0. 3. Trong các ion đơn nguyên tử, số oxi hóa của nguyên tố bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng số số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng điện tích của ion. 4. Trong hầu hết các hợp chất, số oxi hóa của H bằng +1 (trừ hiđrua kim loại). Số oxi hóa của O bằng -2 (trừ OF2 và peoxit). Lời giải chi tiết: \(\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ + 1} \mathop O\limits^{ - 2} ,{\rm{ }}\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ + 3} {\mathop O\limits^{ - 2} _2},{\rm{ }}\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ + 5} {\mathop O\limits^{ - 2} _3},{\rm{ }}\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ + 7} {\mathop O\limits^{ - 2} _4}\) Đáp án A Câu hỏi 32 : Số oxi hoá của S trong H2S , SO2 , SO32–, SO42– lần lược là :
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 33 : Số oxi hoá của Mn trong các đơn chất ,hợp chất và ion sau đây : Mn , MnO , MnCl4 , MnO4– lần lượt là :
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 34 : Số oxi hóa của Fe, Cu, Mn, Cr, Al trong các chất và ion: FeS2, Cu2S, MnO4–, Cr2O72–, AlO2– lần lượt là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án B Câu hỏi 35 : Số oxi hóa của N, O, S, Cl, Br, Kr, Mn trong các chất và ion: NH4+, CH3COOH, SO42–, Cl2, KBrO3, K2Cr2O7, K2MnO4 lần lượt là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 36 : Cho các chất và ion sau: NH4+, NH3, NO3–, N2O5, N2O, NO, NO2, NO2–. Số oxi hoá của nitơ trong các chất và ion trên được sắp xếp theo thứ tự tăng dần như sau:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 37 : Cho dãy các chất:\(F{e_3}{O_4},{H_2}O,C{l_2}{F_2},S{O_2},NaCl,N{O_2},NaN{O_3},C{O_2},Fe{(N{O_3})_3},HCl\) , số chất trong dãy vừa có tính oxi hóa, vừa có tính khử là:
Đáp án: D Phương pháp giải: Ghi nhớ: + chất có số oxi hóa trung gian, có thể tăng lên hoặc giảm xuống khi tham gia phản ứng hóa học thì vừa có tính khử, vừa có tính oxi hóa Lời giải chi tiết: Các chất vừa có tính oxi hóa, vừa có tính khử khi chất đó chứa nguyên tố có số oxi hóa trung gian (vừa có thể tăng và có thể giảm số oxi hóa) hoặc chất đó chứa ít nhất 2 nguyên tố trong đó có nguyên tố thể hiện tính oxi hóa và có nguyên tố thể hiện tính khử
Đáp án D Câu hỏi 38 : Nguyên tử S đóng vai trò vừa là chất khử, vừa là chất oxi hóa trong phản ứng nào sau đây?
Đáp án: A Phương pháp giải: S đóng vai trò vừa là chất khử, vừa là chất oxi hóa khi trong phản ứng số oxi hóa của S vừa tăng, vừa giảm Lời giải chi tiết: Xét các phản ứng với số oxi hóa của mỗi nguyên tố: \(4\mathop S\limits^0 + 6\mathop {Na}\limits^{ + 1} \mathop O\limits^{ - 2} {\mathop H\limits^{ + 1} _d}\buildrel {{t^o}} \over \longrightarrow 2{\mathop {Na}\limits^{ + 1} _2}\mathop S\limits^{ - 2} + {\mathop {Na}\limits^{ + 1} _2}{\mathop S\limits^{ + 2} _2}{\mathop O\limits^{ - 2} _3} + 3{\mathop H\limits^{ + 1} _2}\mathop O\limits^{ - 2} \) \(\mathop S\limits^0 + 3{\mathop F\limits^0 _2}\buildrel {{t^o}} \over \longrightarrow \mathop S\limits^{ + 6} {\mathop F\limits^{ - 1} _6}\) : S vừa nhường e làm số oxi hóa tăng (từ 0 lên +2), vừa nhận e làm số oxi hóa giảm (từ 0 xuống -2) S vừa thể hiện tính khử, vừa thể hiện tính oxi hóa \(\mathop S\limits^0 + \mathop H\limits^{ + 1} \mathop N\limits^{ + 5} {\mathop O\limits^{ - 2} _{3(d)}}\buildrel {{t^o}} \over \longrightarrow {\mathop H\limits^{ + 1} _2}\mathop S\limits^{ + 6} {\mathop O\limits^{ - 2} _4} + 6\mathop N\limits^{ + 4} {\mathop O\limits^{ - 2} _2} + 2{\mathop H\limits^{ + 1} _2}\mathop O\limits^{ - 2} \) : S nhường e làm số oxi hóa tăng từ 0 lên +6 S thể hiện tính khử. \(\mathop S\limits^0 + 2\mathop {Na}\limits^0 \buildrel {{t^0}} \over \longrightarrow {\mathop {Na}\limits^{ + 1} _2}\mathop S\limits^{ - 2} \) . S nhận e làm số oxi hóa giảm từ 0 xuống -2 S thể hiện tính oxi hóa Đáp án A Câu hỏi 39 : Số oxi hóa của C trong các hợp chất: \(C{H_4},CO,C,C{O_2},CO_3^{2 - },HCO_3^ - \) lần lượt là:
Đáp án: D Phương pháp giải: + Nguyên tử, phân tử luôn trung hòa về điện + Trong hầu hết các hợp chất, H có số oxi hóa +1, O có số oxi hóa -2 + Các nguyên tử kim loại nhóm IA,IIA, IIIA có số oxi hóa lần lượt là +1, +2, +3 + Các kim loại có 1 hóa trị thì có số oxi hóa tương ứng + Các nguyên tố có nhiều hóa trị thì phải đi tìm Lời giải chi tiết: \(C{H_4},CO,C,C{O_2},CO_3^{2 - },HCO_3^ - \) \(\mathop C\limits^x \mathop {{H_4}}\limits^{ + 1} :x + ( + 1) \cdot 4 = 0 \Leftrightarrow x = - 4\) \(\mathop C\limits^y \mathop O\limits^{ - 2} :y + ( - 2) = 0 \Leftrightarrow y = + 2\) C ở dạng đơn chất nên có số oxi hóa bằng 0 \(\mathop C\limits^z \mathop {{O_2}}\limits^{ - 2} :z + ( - 2) \cdot 2 = 0 \Leftrightarrow z = + 4\) \(\mathop C\limits^t {\mathop O\limits^{ - 2} _3}^{2 - }:t + ( - 2) \cdot 3 = - 2 \Leftrightarrow t = + 4\) \(\mathop H\limits^{ + 1} \mathop C\limits^r {\mathop O\limits^{ - 2} _3}^ - :( + 1) + r + ( - 2) \cdot 3 = - 1 \Leftrightarrow r = + 4\) Đáp án D Câu hỏi 40 : Cho dãy các chất và ion sau: Zn, S, FeO, SO2,N2 , HCl, Cu2+, Cl-. Số chất và ion có cả tính oxi hóa và tính khử là:
Đáp án: A Phương pháp giải: Những chất (ion) có cả tính oxi hóa và tính khử thì chất (ion) có nguyên tố mà số oxi hóa của nguyên tố trong chất (ion) đó là số oxi hóa trung gian trong các số oxi hóa mà nguyên tố đó có thể có (có khả năng tăng, giảm số oxi hóa). Lời giải chi tiết: Trong các chất, ion trên các chất (ion) có cả tính oxi hóa và khử là: S, FeO,SO2,N2,HCl (5 chất và ion) Đáp án A Quảng cáo
|