40 bài tập một kim loại tác dụng với nhiều muối có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Hoà tan 5,4 gam bột Al vào 150 ml dung dịch X chứa Fe(NO3)3 1M và Cu(NO3)2 1M. Kết thúc phản ứng thu được m gam rắn. Giá trị của m là
Đáp án: C Phương pháp giải: Tính theo PTHH: Al + 3Fe(NO3)3 → Al(NO3)3 + 3Fe(NO3)2 2Al + 3Cu(NO3)2 → 2Al(NO3)3 +3 Cu 2Al + 3Fe(NO3)2 → 2Al(NO3)3 + 3Fe Lời giải chi tiết: Ta có: nAl = 0,2 mol; nFe(NO3)3 = 0,15 mol; nCu(NO3)2 = 0,15 mol Al + 3Fe(NO3)3 → Al(NO3)3+ 3Fe(NO3)2 0,2 0,15 → 0,15 mol Sau phản ứng dư 0,2 - 0,15.1/3 = 0,15 mol Al 2Al +3 Cu(NO3)2 → 2Al(NO3)3+3 Cu 0,15 0,15 → 0,15 mol Sau phản ứng trên dư 0,15 - 2/3.0,15 = 0,05 mol Al 2Al + 3Fe(NO3)2 → 2Al(NO3)3+ 3Fe 0,05 0,15 0,075 mol Kết thúc phản ứng thu được 0,075 mol Fe và 0,15 mol Cu → m = 0,075.56+ 0,15.64 = 13,80 gam Đáp án C Câu hỏi 2 : Cho 1,12g Fe vào 200ml dung dịch A chứa AgNO3 0,25M và CuSO4 0,2M thu được chất rắn B và dd C. Kết luận nào dưới đây sai:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 3 : Cho 0,2 mol Fe vào dung dịch hỗn hợp chứa 0,2 mol Fe(NO3)3 và 0,2 mol AgNO3. Khi phản ứng hoàn toàn, số mol Fe(NO3)3 trong dung dịch bằng :
Đáp án: D Phương pháp giải: Fe +2Ag+ →Fe2+ + Ag Fe +2Fe3+ →3Fe2+ Lời giải chi tiết: Fe +2Ag+ →Fe2+ + Ag bđ 0,2 0,2 p/u 0,1 0,2 sau 0,1 Fe +2Fe3+ →3Fe2+ Bđ 0,1 0,2 p/u 0,1 0,2 => phản ứng xảy ra vừa đủ, Fe(NO3)3 hết Đáp án D Câu hỏi 4 : Hòa tan hoàn toàn 2,4 gam bột Mg vào dung dịch hỗn hợp chứa 0,1 mol Zn(NO3)2 và 0,1 mol AgNO3. Khi phản ứng xảy ra hoàn toàn thì khối lượng chất rắn thu được bằng :
Đáp án: C Phương pháp giải: Viết phương trình ion rút gọn, tính toán theo PT Mg + 2Ag+ → Mg2+ + 2Ag Mg + Zn2+ → Mg2+ + Zn => mchất rắn = mAg + mZn Lời giải chi tiết: Mg + 2Ag+ → Mg2+ + 2Ag bd 0,1 0,1 p/u 0,05 0,1 0,1 sau 0,05 Mg + Zn2+ → Mg2+ + Zn bd 0,05 0,1 p/u 0,05 0,05 0,05 => mchất rắn = mAg + mZn = 0,1.108 + 0,05.65=14,05 gam Đáp án C Câu hỏi 5 : Cho m gam bột Fe vào 200 ml dung dịch chứa 2 muối AgNO3 0,15M và Cu(NO3)2 0,1M sau một thời gian thu được 3,84g hỗn hợp kim loại và dung dịch X. Cho 3,25g bột Zn vào dung dịch X , sau khi các phản ứng hoàn toàn thu được 3,895g hỗn hợp kim loại và dung dịch Y. Giá trị của m là :
Đáp án: B Phương pháp giải: Bảo toàn khối lượng Lời giải chi tiết: Lời giải: nZn = 0,05 mol ; nNO3 = 0,07 mol => chứng tỏ Y chỉ có 0,035 mol Zn(NO3)2 Bảo toàn khối lượng : mZn + mX = mhh kim loại(2) + mZn(NO3)2 => mX = 7,26g Bảo toàn khối lượng : mFe + mmuối hh = mhh KL(1) + mX => mFe = 2,24g Đáp án B Câu hỏi 6 : Cho thanh sắt Fe vào dung dịch X chứa 0,1 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy tham kim loại tăng lên 9,2 gam thì dừng lại. Tổng khối lượng kim loại bám vào thanh sắt là
Đáp án: C Phương pháp giải: Tăng giảm khối lượng. Lời giải chi tiết: mthanh kim loại tăng = 9,2 gam Nếu chỉ có Ag+ phản ứng: Fe + 2Ag+ → Fe2+ + 2Ag 1 mol 2 mol => m tăng = 2.108 - 56.1 = 160 (g) 0,05 → m tăng = 0,05.160 = 8 (g) < 9,2 (g) => Chứng tỏ Cu2+ cũng phản ứng Fe + Cu2+ → Fe2+ + Cu 1 mol 1 mol => m tăng = 64 – 56 = 8 (g) x → x => m tăng = 8x (g) => mtăng = 8 + 8x = 9,2 => x = 0,15 mol < 0,2 mol (Cu2+ còn dư) => mkim loại bám = mCu + mAg = 20,4 gam Đáp án C Câu hỏi 7 : Cho m gam Mg vào dung dịch X gồm 0,03 mol Zn(NO3)2 và 0,05 mol Cu(NO3)2, sau một thời gian thu được 5,25 gam kim loại và dung dịch Y. Cho dung dịch NaOH vừa đủ vào dd Y khối lượng kết tủa thu được là 6,67 gam. Giá trị của m là
Đáp án: C Phương pháp giải: Lời giải chi tiết:
Câu hỏi 8 : Nhúng thanh Zn vào dung dịch hỗn hợp 3,2g CuSO4 và 6,24g CdSO4. Hỏi sau khi Cu2+ và Cd2+ bị khử hoàn toàn thì khối lượng thanh Zn tăng hay giảm? (MCd = 112)
Đáp án: B Phương pháp giải: Lời giải chi tiết: ta có : mthanh Zn tăng = (mCu – mZn pứ (1)) + (mCd – mZn pứ (2)) = 0,02.(64 – 65) + 0,03.(112 – 65) => mtăng = 1,39g Đáp án B Câu hỏi 9 : Cho 3,25 gam bột Zn vào 200 ml dung dịch chứa Al(NO3)3 0,2M; Cu(NO3)2 0,15M; AgNO3 0,1M. Sau phản ứng hoàn toàn thì khối lượng chất rắn thu được là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: nZn = 0,05 mol Zn + 2AgNO3 -> Zn(NO3)2 + 2Ag Zn + Cu(NO3)2 -> Zn(NO3)2 + Cu => chất rắn gồm : 0,02 mol Ag và 0,03 mol Cu và 0,01 mol Zn dư => mrắn = 4,73g Đáp án A Câu hỏi 10 : Cho a gam Mg vào 100 ml dung dịch Al2(SO4)3 1M và CuSO4 3M thu được 21,9 gam hỗn hợp chất rắn gồm hai kim loại. Giá trị của a là
Đáp án: D Phương pháp giải: Lời giải chi tiết: Hỗn hợp rắn gồm 2 kim loại => Al và Cu Thứ tự phản ứng gồm : Mg + Cu2+ -> Mg2+ + Cu 0,3 ← 0,3 nAl = (21,9 – 0,3.64) : 27 = 0,1 mol 3Mg + 2Al3+ -> 3Mg2+ + 2Al 0,15 ← 0,1 => a = 10,8g Đáp án D Câu hỏi 11 : Cho m gam bột Fe vào 100 ml dung dịch chứa hai muối AgNO3 0,2M và Cu(NO3)2 0,15M, sau một thời gian thu được 2,16 gam hỗn hợp kim loại và dung dịch X. Cho 4,875 gam bột Zn vào dungdịch X sau khi phản ứng xảy ra hoàn toàn, thu được 5,45 gam hỗn hợp kim loại và dung dịch Y. Giá trị của m là.
Đáp án: C Phương pháp giải: Lời giải chi tiết: Phương pháp: Bảo toàn nguyên tố, bảo toàn khối lượng Lời giải: Bảo toàn N : nNO3(dd dầu) = nNO3(dd Y) = 0,05 mol nZn = 0,075 mol > nNO3 => Zn dư => Y chỉ có 0,025 mol Zn(NO3)2 Bảo toàn khối lượng : mmuối X + mZn = mrắn(2) + mZn(NO3)2 => mmuối X = 5,3g Bảo toàn khối lượng : mmuối (dd đầu) + mFe = mrắn(1) + mmuối X => mFe = 1,24g Đáp án C Câu hỏi 12 : Cho 4,8 gam bột kim loại Mg tác dụng hoàn toàn với 500 ml dung dịch chứa FeSO4 0,2M và CuSO4 0,3M, sau phản ứng thu được m gam chất rắn. Giá trị của m là
Đáp án: A Phương pháp giải: Mg phản ứng với muối của kim loại yếu hơn trước là CuSO4 còn dư thì mới pư với FeSO4 Lời giải chi tiết:
Hướng dẫn giải nMg = 0,2 mol nFeSO4 = 0,1 mol và nCuSO4 = 0,15 mol PTHH : Mg + CuSO4 → MgSO4 + Cu → sau phản ứng này Mg dư 0,05 mol và tạo ra 0,15 mol Cu Mg + FeSO4 → MgSO4 + Fe → thu được 0,05 mol Fe →m = 0,15.64 + 0,05.56 =12,4 g Đáp án A Câu hỏi 13 : Hòa tan 5,4 gam bột Al vào 15 ml dung dịch A chứa Fe(NO3)3 1M và Cu(NO3)2 1M. Kết thúc phản ứng thu được m gam rắn. Giá trị của m là
Đáp án: A Phương pháp giải: Phương pháp : Tuân theo nguyên tắc thứ tự dãy điện hóa : Al + 3 Fe(NO3)3→ 3 Fe(NO3)2 + Al(NO3)3 2 Al + 3 Cu(NO3)2→ 2 Al(NO3)3 + 3 Cu 2 Al + 3 Fe(NO3)2→ 3 Fe + 2 Al(NO3)3 Phản ứng sau chỉ xảy sau khi phản ứng trước vẫn còn dư Al Lời giải chi tiết:
Hướng dẫn Giải n Al = 0,2 mol , n Fe(NO3)3 = 0,15 , n Cu(NO3)2 = 0,15 Al + 3 Fe(NO3)3→ 3 Fe(NO3)2 + Al(NO3)3 0,2 0,15 => 0,15 0,05 : n Al dư = 0,2 – 0,05 = 0,15 mol 2 Al + 3 Cu(NO3)2→ 2 Al(NO3)3 + 3 Cu 0,15 0,15 => 0,1 0,15 : n Al dư = 0,15 – 0,1 = 0,05 mol 2 Al + 3 Fe(NO3)2→ 3 Fe + 2 Al(NO3)3 0,05 0,15 => 0,075 dư Fe(NO3)2 => m chất rắn = m Fe + m Cu = 0,075 . 56 + 0,15 . 64 = 13,8 Đáp án A Câu hỏi 14 : Cho 5,6 gam Fe vào 200 ml dung dịch hỗn hợp AgNO3 0,1M và Cu(NO3)2 0,2M Sau khi kết thúc phản ứng thu được chất rắn có khối lượng m gam. Giá trị của m là
Đáp án: C Phương pháp giải: Lời giải chi tiết: nFe = 0,1 mol nAg+ = 0,02 mol nCu2+ = 0,04 mol Fe + 2Ag+ → Fe2+ + 2Ag 0,01←0,02→0,01→0,02 Fe + Cu2+ → Fe2+ + Cu 0,04←0,04→0,04→0,04 m chất rắn = mAg + mCu + mFe dư = 0,02.108 + 0,04.64 + (0,1 - 0,01 – 0,04).56 = 7,52 gam Đáp án C Câu hỏi 15 : Cho a gam Mg vào 100 ml dung dịch Al2(SO4)3 1M và CuSO4 3M thu được 21,9 gam hỗn hợp chất rắn gồm 2 kim loại. Giá trị của a là
Đáp án: D Phương pháp giải: - Lập luận: 2 kim loại sau phản ứng là Cu và Al => Mg hết, CuSO4 hết, Al2(SO4)3 dư - Viết và tính toán theo PTHH Lời giải chi tiết: 2 kim loại sau phản ứng là Cu và Al => Mg hết, CuSO4 hết, Al2(SO4)3 dư => nCu=nCuSO4=0,3 mol => mAl=21,9-0,3.64=2,7 gam =>nAl=0,1 mol Mg + Cu2+ → Mg2+ + Cu 0,3 ← 0,3 3Mg + 2Al3+ → 3Mg2+ + 2Al 0,15 ← 0,1 =>mMg = 0,45.24 = 10,8 gam Đáp án D Câu hỏi 16 : Cho thanh sắt Fe vào dung dịch X chứa 0,1 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy tham kim loại tăng lên 9,2 gam thì dừng lại. Tính tổng khối lượng kim loại bám vào thanh sắt
Đáp án: C Phương pháp giải: Viết phương trình ion rút gọn: Fe + 2Ag+ → Fe2+ + 2Ag Fe + Cu2+ → Fe2+ + Cu Tăng giảm khối lượng: mtăng = mAg + mCu – mFe pư Lời giải chi tiết: mthanh kim loại tăng = 9,2g Nếu chỉ có Ag+ phản ứng : Fe + 2Ag+ → Fe2+ + 2Ag 0,05 ← 0,1 => mtăng = 108.0,1 – 0,05.56 = 8g < 9,2g => Chứng tỏ Cu2+ cũng phản ứng Fe + Cu2+ → Fe2+ + Cu x →x => mtăng = (108.0,1 + 64x) – 56.(0,05 + x) = 9,2g => x = 0,15 mol => mkim loại bám = mCu + mAg = 20,4g Đáp án C Câu hỏi 17 : Cho m gam bột Fe vào 200 ml dung dịch chứa 2 muối AgNO3 0,15M và Cu(NO3)2 0,1M sau một thời gian thu được 3,84g hỗn hợp kim loại và dung dịch X. Cho 3,25g bột Zn vào dung dịch X , sau khi các phản ứng hoàn toàn thu được 3,895g hỗn hợp kim loại và dung dịch Y. Giá trị của m là :
Đáp án: B Phương pháp giải: Bảo toàn khối lượng Lời giải chi tiết: nZn = 0,05 mol ; nNO3 = 0,07 mol => chứng tỏ Y chỉ có 0,035 mol Zn(NO3)2 Bảo toàn khối lượng : mZn + mX = mhh kim loại(2) + mZn(NO3)2 => mX = 7,26g Bảo toàn khối lượng : mFe + mmuối hh = mhh KL(1) + mX => mFe = 2,24g Đáp án B Câu hỏi 18 : Cho m gam bột Fe vào 100ml dung dịch gồm Cu(NO3)2 0,5M và AgNO3 1,5M. Sau khi kết thúc phản ứng thu được dung dịch 3 muối (trong đó có một muối của Fe) và 6,48 g chất rắn. Khối lượng m gam bột Fe là
Đáp án: B Phương pháp giải: Lời giải chi tiết: nCu2+ = 0,05 mol nAg+ = 0,15 mol => mAg = 16,2 > 6,48g => AgNO3 dư, Cu(NO3)2 chưa phản ứng nAg = 6,48/108 = 0,06 mol Dung dịch chứa 3 muối Fe(NO3)3 ; AgNO3; Cu(NO3)2 Fe + 3AgNO3 → Fe(NO3)3 + 3Ag 0,02 ← 0,06 => m = 0,02.56 = 1,12 gam Đáp án B Câu hỏi 19 : Cho m gam Mg phản ứng hoàn toàn với 100ml dung dịch A chứa FeSO4 0,15M và CuSO4 0,2M sau phản ứng thu được chất rắn B có khối lượng 1,56g. Tính m:
Đáp án: D Phương pháp giải: Lời giải chi tiết: nCu2+ = 0,02 mol => nCu = 1,28 g nFe2+ = 0,015 mol => mFe = 0,84g Ta có: 1,28 < 1,56 < 1,28 + 0,84 => Cu2+ phản ứng hết, Fe phản ứng hết 1 phần nFe = ( 1,56 – 0,02.64) : 56 = 0,005 mol Bảo toàn e => nMg = ( 0,02.2 + 0,005.2) : 2 = 0,025 mol => m = 0,6g Đáp án D Câu hỏi 20 : Nhúng một thanh sắt nặng 100 gam vào 100 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và AgNO3 0,2M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Khối lượng sắt đã phản ứng là
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 21 : Cho m gam Mg vào dung dịch chứa 0,1 mol AgNO3 và 0,25 mol Cu(NO3)2, sau một thời gian thu được 19,44 gam kết tủa và dung dịch X chứa 2 muối. Tách lấy kết tủa, thêm tiếp 8,4 gam bột sắt vào dung dịch X, sau khi các phản ứng hoàn toàn thu được 9,36 gam kết tủa.Giá trị của m là
Đáp án: B Phương pháp giải: Tiến trình (1) \(Mg + \left\{ \matrix{ Tiến trình (2) \(\underbrace {Fe}_{8,4\,\,g} + \left\{ \matrix{ Bảo toàn khối lượng cho tiến trình (2). mFe + mCu2+ = mFe2+ + mrắn sau => a = ? Bảo toàn khối lượng cho tiến trình (1) mMg + mAg+ + mCu2+ = mCu2+ + mMg2+ + mrắn => m = ? (g) Lời giải chi tiết: Tiến trình (1) \(Mg + \left\{ \matrix{ Mg + 2Ag+ → Mg2+ + 2Ag 0,05 0,1 0,05 0,1 Mg + Cu2+ → Mg2+ + Cu a a a a Tiến trình (2) \(\underbrace {Fe}_{8,4\,\,g} + \left\{ \matrix{ Fe + Cu2+ → Fe2+ + Cu 0,25 –a 0,25 –a 0,25 –a Bảo toàn khối lượng cho tiến trình (2). mFe + mCu2+ = mFe2+ + mrắn sau 8,4 + 64(0,25 –a) = 56 (0,25 –a) + 9,36 => a = 0,13 Bảo toàn khối lượng cho tiến trình (1) mMg + mAg+ + mCu2+ = mCu2+ + mMg2+ + mrắn m + 108.0,1 + 64.025 = 64. 0,12 + 24. 0,18 + 19,44 => m = 4,64 (g) Đáp án B Câu hỏi 22 : Cho 2,4 gam bột kim loại Mg tác dụng hoàn toàn với 250 ml dung dịch chứa FeSO4 0,2M và CuSO4 0,3M, sau phản ứng thu được m gam chất rắn. Giá trị của m là
Đáp án: C Phương pháp giải: Bảo toàn electron, viết phương trình hóa học xảy ra. Lời giải chi tiết: nMg = 2,4 :24 = 0,1 (mol) nFeSO4 = 0,25.0,2 = 0,05 (mol) ; nCuSO4 = 0,25.0,3 = 0,075 (mol) Ta có: ne (Mg nhường) = 0,1.2 = 0,2 (mol) ne(nhận) = 0,05.2 + 0,075.2 = 0,25 (mol) > ne(Mg nhường) => Mg pư hết, muối dư Mg + Cu2+ → Mg2+ + Cu↓ Mol 0,075← 0,075 → 0,075 Mg + Fe2+ → Mg2+ + Fe↓ Mol (0,1-0,075)→ 0,025 0,025 => mchất rắn = mCu + mFe = 0,075.64 + 0,025.56 = 6,2 (g) Đáp án C Câu hỏi 23 : Cho 2,24 gam bột sắt vào 200 ml dung dịch chứa hỗn hợp gồm AgNO3 0,1M và Cu(NO3)2 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
Đáp án: A Phương pháp giải: Dựa vào dãy điện hóa xem kim loại Fe phản ứng với muối nào trước (Muối của ion kim loại có tính oxi hóa mạnh hơn). Tính toán theo phương trình phản ứng Lời giải chi tiết: nFe = 2,24 : 56 = 0,04 mol nAgNO3 = 0,1.0,2 = 0,02 mol nCu(NO3)2 = 0,5.0,2 = 0,1 mol Thứ tự các phản ứng : Fe + 2AgNO3 → Fe(NO3)2 + 2Ag Mol 0,01 Fe + Cu(NO3)2 → Fe(NO3)2 + Cu Mol 0,03 → 0,03 → 0,03 => nCu(NO3)2 dư = 0,1 – 0,03 = 0,07 mol Vậy chất rắn gồm : 0,02 mol Ag và 0,03 mol Cu => m = 0,02.108 + 0,03.64 = 4,08g Đáp án A Câu hỏi 24 : Cho 3,36 gam Fe vào 300 ml dung dịch chứa AgNO3 0,1M và Cu(NO3)2 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
Đáp án: A Phương pháp giải: Viết và tính theo PTHH. Fe + 2Ag+ → Fe2+ + 2Ag Fe + Cu2+ → Fe2+ + Cu Lời giải chi tiết: nFe = 3,36 : 56 = 0,06 mol; nAgNO3 = 0,3.0,1 = 0,03 mol; nCu(NO3)2 = 0,3.0,5 = 0,15 mol Thứ tự phản ứng: Fe + 2Ag+ → Fe2+ + 2Ag Mol 0,015/0,045 ← 0,03 → 0,03 (mol) Fe + Cu2+ → Fe2+ + Cu Mol 0,045 → 0,045 (mol) Chất rắn gồm 0,03 mol Ag và 0,045 mol Cu => mrắn = 0,03.108 + 0,045.64 = 6,12 gam Đáp án A Câu hỏi 25 : Cho m gam Mg vào dung dịch X gồm 0,036 mol Zn(NO3)2 và 0,060 mol Cu(NO3)2, sau một thời gian thu được 6,300 gam kim loại và dung dịch Y. Cho dung dịch NaOH vào dung dịch Y, thu được lượng kết tủa lớn nhất là 8,004 gam. Giá trị của m là
Đáp án: A Phương pháp giải: Khi kết tủa lớn nhất thì dung dịch cuối cùng thu được là NaNO3 - Bảo toàn nguyên tố N ta có: \({n_{NaN{{\rm{O}}_3}}} = 2.{n_{Zn{{(N{O_3})}_2}}} + 2.{n_{Cu{{(N{O_3})}_2}}}\) - Bảo toàn nguyên tố Na ta có: \({n_{NaOH}} = {n_{NaN{{\rm{O}}_3}}} = {n_{O{H^ - }(ket\,\,tua)}}\) - Khối lượng phần kim loại trong kết tủa là: \({m_{KL(hi{\rm{dr}}oxit)}} = {m_{hi{\rm{dr}}oxit}} - {m_{O{H^ - }(hi{\rm{dr}}oxit)}}\) - Bảo toàn khối lượng cho kim loại và ion kim loại để tính m: \({m_{Mg}} + {m_{Zn{{(N{O_3})}_2}}} + {m_{Cu{{(N{O_3})}_2}}} + {m_{NaOH}} = {m_{KL(lan\,1)}} + {m_{KL(hi{\rm{dr}}oxit)}}\) Lời giải chi tiết: Khi kết tủa lớn nhất thì dung dịch cuối cùng thu được là NaNO3 Bảo toàn nguyên tố N ta có: \({n_{NaN{{\rm{O}}_3}}} = 2.{n_{Zn{{(N{O_3})}_2}}} + 2.{n_{Cu{{(N{O_3})}_2}}} = 2.0,036 + 2.0,06 = 0,192(mol)\) Bảo toàn nguyên tố Na ta có: \({n_{NaOH}} = {n_{NaN{{\rm{O}}_3}}} = 0,192(mol) = {n_{O{H^ - }(ket\,\,tua)}}\) Khối lượng phần kim loại trong kết tủa là: \({m_{KL(hi{\rm{dr}}oxit)}} = 8,004 - 0,192.17 = 4,74(g)\) Bảo toàn khối lượng cho kim loại và ion kim loại: \({m_{Mg}} + {m_{Zn{{(N{O_3})}_2}}} + {m_{Cu{{(N{O_3})}_2}}} + {m_{NaOH}} = {m_{KL(lan\,1)}} + {m_{KL(hi{\rm{dr}}oxit)}}\) \( \Leftrightarrow m + 0,036.65 + 0,06.64 = 6,3 + 4,74\) \( \Leftrightarrow m = 4,86(g)\) Đáp án A Câu hỏi 26 : Cho m gam Al vào dung dịch chứa a mol FeCl3 và a mol CuCl2 thu được 19,008 gam hỗn hợp 2 kim loại. Cho m gam Al vào dung dịch chứa 3a mol AgNO3 và a mol Cu(NO3)2 thu được 69,888 gam hỗn hợp 2 kim loại. Tổng khối lượng của Cu tạo ra trong 2 thí nghiệm gần nhất với:
Đáp án: D Phương pháp giải: Bảo toàn electron Lời giải chi tiết: TN1 thu được 2 kim loại Cu và Fe; TN2 thu được 2 kim loại Ag và Cu ⟹ 2 thí nghiệm Al đều hết Mà 2 thí nghiệm dùng lượng Al như nhau nên lượng e trao đổi của 2 thí nghiệm cũng như nhau *TN1: Kim loại gồm Cu (a mol) và Fe (giả sử là b mol) → mKL(TN1) = 64a + 56b = 19,008 (1) Bảo toàn Fe → nFe2+ = nFe3+ - nFe = a - b (mol) Như vậy, ne nhận (TN1) = 2nCu + 3nFe + nFe2+ = 2a + 3b + (a - b) = 3a + 2b (mol) = ne nhận (TN2) *TN2: Kim loại gồm Ag (3a mol) và Cu ne nhận (TN2) = nAg + 2nCu → nCu = [(3a + 2b) - 3a]/2 = b mol → mKL (TN2) = 108.3a + 64b = 69,888 (2) Giải hệ (1) (2) được a = 0,192 và b = 0,12 Vậy tổng khối lượng Cu của 2 thí nghiệm là: ∑mCu = (0,192 + 0,12).64 = 19,968 gam Đáp án D Câu hỏi 27 : Hòa tan hoàn toàn a gam hỗn hợp gồm x mol AgNO3 và y mol Cu(NO3)2 vào nước, thu được dung dịch X. Cho một lượng Cu dư vào X thu được dd Y có chứa b gam muối. Cho một lượng Fe dư vào Y, thu được dung dịch Z có chứa c gam muối. Biết các phản ứng xảy ra hoàn toàn 2b = a + c. Tỉ lệ x : y là:
Đáp án: D Phương pháp giải: Bảo toàn khối lượng Lời giải chi tiết: AgNO3 : x (mol) Cu(NO3)2 : y (mol) Dd Y : Cu(NO3)2 : 0,5x + y (mol) Dd Z : Fe(NO3)2 : 0,5x + y (mol) Vì sự chênh lệch khối lượng muối là do kim loại Cu thay thế Ag; Fe thay thế Cu còn NO3- bảo toàn nên : 2b = a + c =>2 ( 0,5. x + y). 64 = 108x + 64y + (0,5x + y).56 => 72x = 8y => 9x = y => x : y = 1: 9 Đáp án D Câu hỏi 28 : Cho m gam Zn vào dung dịch chứa 0,1 mol AgNO3 và 0,15 mol Cu(NO3)2, sau một thời gian thu được 26,9 gam chất rắn và dung dịch X chứa 2 muối. Tách lấy chất rắn, thêm tiếp 5,6 gam bột sắt vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được 6 gam chất rắn. Giá trị của m là
Đáp án: D Phương pháp giải: Tăng giảm khối lượng. Lời giải chi tiết:
Câu hỏi 29 : Lấy m gam Mg tác dụng với 500ml dung dịch AgNO3 0,2M và Fe(NO3)3 2M. Kết thúc phản ứng thu được (m + 4) gam kim loại. Gọi a là tổng các giá trị m thỏa mãn bài toán trên, giá trị của a là?
Đáp án: A Phương pháp giải: Thứ tự phản ứng: (1) Mg + 2Ag+ → Mg2+ + 2Ag (2) Mg + 2Fe3+ → Mg2+ + 2Fe2+ (3) Mg + Fe2+ → Mg2+ + Fe TH1: Mg hết, Ag+ dư, Fe3+ chưa phản ứng => chỉ xảy ra phản ứng (1) TH2: Ag+ hết, Mg phản ứng một phần với Fe3+, Fe3+ ở (2) dư => xảy ra (1) và (2) TH3: Ag+ ở (1) hết, Fe3+ ở (2) hết, Mg phản ứng với Fe2+, Fe2+ ở (3) dư => xảy ra (1), (2), (3) TH4: Mg dư hết sau tất cả các phản ứng => xảy ra (1) (2) (3) Lời giải chi tiết: nMg = m/24 mol; nAg+ = 0,1 mol; nFe3+ = 1 mol Thứ tự phản ứng: (1) Mg + 2Ag+ → Mg2+ + 2Ag (2) Mg + 2Fe3+ → Mg2+ + 2Fe2+ (3) Mg + Fe2+ → Mg2+ + Fe TH1: Mg hết, Ag+ dư, Fe3+ chưa phản ứng => chỉ xảy ra phản ứng (1) => 2nMg < nAg+ hay m/12 < 0,1 => m < 0,12 nAg = 2nMg = m/12 (mol) m KL sau pư = mAg => m + 4 = 0,8m/12 => m = 0,5 gam (thỏa mãn) TH2: Ag+ hết, Mg phản ứng một phần với Fe3+, Fe3+ ở (2) dư => xảy ra (1) và (2) (1) Mg + 2Ag+ → Mg2+ + 2Ag 0,05 ← 0,1 → 0,1 (mol) (2) Mg + 2Fe3+ → Mg2+ + 2Fe2+ m/24-0,05 → m/12-0,1 (mol) Điều kiện để Fe3+ dư là: m/12-0,1 < 1 => m < 13,2 m KL sau pư = mAg => m + 4 = 0,1.108 => m = 6,8 gam (thỏa mãn) TH3: Ag+ ở (1) hết, Fe3+ ở (2) hết, Mg phản ứng với Fe2+, Fe2+ ở (3) dư => xảy ra (1), (2), (3) (1) Mg + 2Ag+ → Mg2+ + 2Ag 0,05 ← 0,1 → 0,1 (mol) (2) Mg + 2Fe3+ → Mg2+ + 2Fe2+ 0,5 ← 1 → 1 (mol) (3) Mg + Fe2+ → Mg2+ + Fe m/24-0,55 → m/24-0,55 → m/24-0,55 Điều kiện để Fe2+ ở (3) dư là m/24-0,55 < 1 => m < 37,2 gam m KL sau pư = mAg + mFe => m + 4 = 0,1.108 + 56(m/24-0,55) => m = 18 gam (thỏa mãn) TH4: Mg dư hết sau tất cả các phản ứng => xảy ra (1) (2) (3) (1) Mg + 2Ag+ → Mg2+ + 2Ag 0,05 ← 0,1 → 0,1 (mol) (2) Mg + 2Fe3+ → Mg2+ + 2Fe2+ 0,5 ← 1 → 1 (mol) (3) Mg + Fe2+ → Mg2+ + Fe 1 ← 1 → 1 (mol) mKL sau pư = mMg dư + mAg + mFe => m + 4 = m – 1,55.24 + 0,1.108 + 1.56 => vô nghiệm Kết luận: Vậy a = 0,5 + 6,8 + 18 = 25,3 gam Đáp án A Câu hỏi 30 : Cho Mg vào dung dịch chứa FeSO4 và CuSO4. Sau phản ứng, thu được chất rắn X chỉ có một kim loại và dung dịch Y chứa 2 muối. Phát biểu nào sau đây đúng?
Đáp án: B Phương pháp giải: Dựa vào thứ tự xảy ra phản ứng khi cho 1 kim loại tác dụng với 2 muối. Kl mạnh sẽ đẩy muối yếu hơn ra khỏi dung dịch muối đó trước. Lời giải chi tiết: Vì sau pư thu được 1 kim loại và 2 muối=> chỉ có pư xảy ra: Mg + CuSO4 → MgSO4 + Cu↓ Kim loại thu được là Cu Muối thu được là MgSO4 và FeSO4 => CuSO4 hết, FeSO4 chưa phản ứng, Mg hết Đáp án B Quảng cáo
|















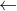 0,02 → 0,01 → 0,02 => nFe còn = 0,04 – 0,01 = 0,03 mol
0,02 → 0,01 → 0,02 => nFe còn = 0,04 – 0,01 = 0,03 mol









