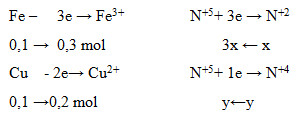20 bài tập về kim loại tác dụng với HNO3, H2SO4 đặc có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Cho 1,35g hỗn hợp Cu, Mg, Al tác dụng với HNO3 dư , thu được 1,12 lit (dktc) hỗn hợp khí NO và NO2 có tỉ khối so với H2 bằng 20 (không có sản phẩm khử nào khác). Khối lượng muối nitrat tạo thành là :
Đáp án: C Phương pháp giải: Bảo toàn khối lượng Lời giải chi tiết: Cách giải: Có : nNO + nNO2 = 0,05 mol ; M = 40g => nNO = 0,01875; nNO2 = 0,03125 mol Ta có : nNO3 = 3nNO + nNO2 = 0,0875 mol Bảo toàn khối lượng: mmuối = mKL + mNO3 = 6,775g Đáp án C Câu hỏi 2 : Hoà tan m gam Fe vào dung dịch HNO3 loãng, dư thu được 0,448 lit khí NO duy nhất (đktc). Giá trị của m là:
Đáp án: C Phương pháp giải: Bảo toàn e Lời giải chi tiết: Cách giải: Bảo toàn e : 3nFe = 3nNO => nNO = nFe = 0,02 mol m = 1,12g Đáp án C Câu hỏi 3 : Hoà tan 5,6 gam Fe bằng dung dịch HNO3loãng (dư), sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
Đáp án: A Phương pháp giải: Bảo toàn e Lời giải chi tiết: Cách giải: Bảo toàn e : 3.nFe = 3.nNO => nNO = 0,1 mol => VNO = 2,24 lit Đáp án A Câu hỏi 4 : Cho 28,88 gam hỗn hợp gồm Al, Cu và Ag tác dụng vừa đủ với 1 lít dung dịch HNO3 1,45M thu được dung dịch chứa m gam muối và 5,6 lít hỗn hợp khí X (đktc) gồm NO và N2O. Tỷ khối của X so với H2 là 16,4. Giá trị của m là
Đáp án: C Phương pháp giải: Bài toán KL + HNO3 => sản phẩm khử Công thức giải nhanh: 1. ne = nNO2 + 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 2. ne = nNO3 trong muối KL 3. nHNO3 = 2nNO + 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 Lời giải chi tiết: MX = 32,8 gam; nX = 0,25 mol => nNO = 0,2 mol; nN2O = 0,05 mol nHNO3 = 4nNO + 10nN2O + 10nNH4NO3 => nNH4NO3 = 0,015 mol Bảo toàn e: ne = nNO3 muối KL = 3nNO + 8nN2O + 8nNH4NO3 = 1,12 mol => m = mKL + mNO3 muối KL + mNH4NO3 = 99,52g Đáp án C Câu hỏi 5 : 11,0 gam hỗn hợp A gồm Fe và Al phản ứng hết với dung dich HCl dư thu được 8,96 lít H2 (đktc). Cho 22 gam hỗn hợp A phản ứng hết với dung dịch HNO3 dư thu được V lít NO (đktc) là sản phẩm khử duy nhất. Giá trị V là:
Đáp án: C Phương pháp giải: bảo toàn e. Lời giải chi tiết: Cách giải : Xét 11g A : Bảo toàn e : ne = 2nH2 = 0,8 mol = 2nFe + 3nAl Và mFe + mAl = 11g => nFe = 0,1 ; nAl = 0,2 mol => 22g A có : nFe = 0,2 mol ; nAl = 0,4 mol Bảo toàn e : 3nFe + 3nAl = 3nNO => nNO = 0,6 mol => VNO = 13,44 lit Đáp án C Câu hỏi 6 : Hòa tan hết m gam bột nhôm kim loại bằng dung dịch HNO3 thu được dung dịch A không chứa muối amoni và 1,12 lit khí N2 ở đktc. Khối lượng ban đầu m có giá trị :
Đáp án: A Phương pháp giải: Bảo toàn e Lời giải chi tiết: Cách giải: Bảo toàn e : 3nAl = 10nN2 => nAl = 1/6 mol. m= 4,5 gam. Đáp án A Câu hỏi 7 : Nung nóng 7 gam hỗn hợp X gồm Al, Mg và Fe trong khí O2. Sau một thời gian thu được 9,4 gam hỗn hợp Y. Hòa tan hoàn toàn Y vào 500 ml dung dịch HNO3 vừa đủ thu được 2,24 lít khí NO (sản phẩm khử duy nhất, đktc). Nồng độ M của dung dịch HNO3 đã dùng là:
Đáp án: B Phương pháp giải: mO = mY - mX → nO Quy đổi hỗn hợp thành: 7 gam {Al, Mg, Fe} và O Quá trình cho - nhận e: Fe0 → Fe+3 + 3e O0 + 2e → O-2 Mg0 → Mg+2 + 2e N+5 + 3e → N+2 (NO) Al0 → Al+3 + 3e Áp dụng bảo toàn e → 3nFe + 2nMg + 3nAl = 2nO + 3nNO BTNT "N" → nHNO3 pư = 3nFe(NO3)3 + 2nMg(NO3)2 + 3nAl(NO3)3 + nNO = 3nFe + 2nMg + 3nAl + nNO → CM Lời giải chi tiết: mO = mY - mX = 2,4 gam → nO = 2,4/16 = 0,15 mol Quy đổi hỗn hợp thành: 7 gam {Al, Mg, Fe} và 0,15 mol O Quá trình cho - nhận e: Fe0 → Fe+3 + 3e O0 + 2e → O-2 Mg0 → Mg+2 + 2e N+5 + 3e → N+2 (NO) Al0 → Al+3 + 3e Áp dụng bảo toàn e → 3nFe + 2nMg + 3nAl = 2nO + 3nNO = 0,15.2 + 3.0,1 = 0,6 mol BTNT "N" → nHNO3 pư = 3nFe(NO3)3 + 2nMg(NO3)2 + 3nAl(NO3)3 + nNO = 3nFe + 2nMg + 3nAl + nNO = 0,6 + 0,1 = 0,7 mol → CM = 0,7 : 0,5 = 1,4 M Đáp án B Câu hỏi 8 : Hòa tan hoàn toàn 14,4g kim loại M hóa trị II vào dung dịch HNO3 đặc dư thu được 26,88 lit NO2 (dktc) là sản phẩm khử duy nhất. Kim loại M là :
Đáp án: D Phương pháp giải: Lời giải chi tiết: (*) Phương pháp : Bảo toàn electron
- Lời giải : Bảo toản e : 2nM = nNO2 = 1,2 mol => nM = 0,6 mol => MM = 24g => Magie Đáp án D Câu hỏi 9 : Cho 10,84 gam hỗn hợp X ( Fe, Cu, Ag) hòa tan hoàn toàn bằng dung dịch HNO3 thấy giải phóng 1,344 lít khí NO (đktc) , (sản phẩm khử duy nhất) thu được m gam hỗn hợp muối. Giá trị của m là bao nhiêu?
Đáp án: D Phương pháp giải: + Bảo toàn electron + Bảo toàn khối lượng Lời giải chi tiết: nNO = 1,344: 22,4 = 0,06 (mol) Bảo toàn e: nNO3 (trong muối) = ne ( N+5 nhận) = 3nNO = 3. 0,06 = 0,18 (mol) => mMUỐI = mKL + mNO3 (trong muối) = 10,84 + 0,18. 62 = 22 (g) Đáp án D Câu hỏi 10 : Hòa tan 1,86 hợp kim của Mg và Al trong dung dịch HNO3 loãng, dư thu được 560 ml khí N2O (sản phẩm khử duy nhất ở đktc). Thành phần phần trăm theo khối lượng của Mg và Al trong hợp kim là:
Đáp án: C Phương pháp giải: + Bảo toàn electron Lời giải chi tiết: nN2O = 0,56 : 22,4 = 0,025 (mol) Gọi số mol của Mg và Al lần lượt là x và y (mol) Ta có: mhh = 24x + 27y = 1,86 (1) Bảo toàn e: n e Mg, Al nhường = n e N+5 nhận=> 2x + 3y = 0,025.8 (2) Từ (1) và (2) => x = 0,01 (mol) và y = 0,06 (mol) %m Mg = [(0,01. 24) : 1,86].100% = 12,9 % % mAl = 100% - 12,9% = 87,10% Đáp án C Câu hỏi 11 : Hỗn hợp X gồm Mg và Al. Hòa tan hoàn toàn 7,5 gam hỗn hợp X bằng lượng vừa đủ V lít dung dịch HNO3 1M, thu được 0,672 lít N2 ở đktc (là khí duy nhất thoát ra) và dung dịch chứa 54,9 gam muối. Giá trị của V là:
Đáp án: A Phương pháp giải: - Bảo toàn electron : ∑ n e (KL nhường) = ∑ n e ( N+5 nhận) Lời giải chi tiết: nN2 = 0,672 : 22,4 = 0,03 (mol) Nếu N+5 → N2 thì nNO3- TRONG MUỐI = 10nN2 = 0,03.10 = 0,3 (mol) BTKL: mMUỐI = mKL + mNO3- = 7,5 + 0,3.62 = 26,1 # 54, 9(g) => có tạo muối NH4+ Gọi nMg = a mol; nAl = b mol; nNH4+ = c mol ∑ mX = 24x + 27y = 7,5 (1) ∑ ne( KL nhường ) = ∑ nN+ 5( nhận) <=> 2x + 3y = 8c +10.0,03 (2) ∑ mmuối = 148a + 213b + 80c = 54,9 ( 3) Từ (1), (2), (3) => a = 0,2 ; b = 0,1; c = 0,05 mol CT nhanh: nHNO3 = 10nNH4+ + 12nN2 = 10. 0,05 + 12. 0,03 = 0,86 (mol) => VHNO3 = 0,86 (lít) Đáp án A Câu hỏi 12 : Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hòa tan hoàn toàn 36 gam một hỗn hợp gồm Fe và Cu có tỷ lệ mol 1:1 là (biết phản ứng tạo chất khử duy nhất là NO):
Đáp án: C Phương pháp giải: G/s: nFe = nCu = x mol 56x + 64x = 36 => x = ? Để thể tích HNO3 là ít nhất thì tạo sản phẩm là Fe2+ Bte => 2nFe + 2nCu = 3nNO => nNO = ? nHNO3 = 4nNO = ? => V dung dịch = ? Lời giải chi tiết: G/s: nFe = nCu = x mol 56x + 64x = 36 => x = 0,3 mol Để thể tích HNO3 là ít nhất thì tạo sản phẩm là Fe2+ Bte => 2nFe + 2nCu = 3nNO => nNO = 0,4 mol nHNO3 = 4nNO = 1,6 mol => V dung dịch = 1,6 lít Đáp án C Câu hỏi 13 : Nung bột sắt trong oxi, thu được m gam hỗn hợp chất rắn X. Hòa tan hết hỗn hợp X trong dung dịch HNO3 (dư), thoát ra 1,12 lít (ở đktc) NO (là sản phẩm khử duy nhất) và 21,78 g muối. Giá trị của m là?
Đáp án: D Phương pháp giải: BTNT “Fe” ta có nFe = nFe(NO3)3 = ? Quy đổi hỗn hợp X thành Fe và O BTe: 3nFe = 2nO + 3nNO => nO => m = mFe + mO Lời giải chi tiết: nFe(NO3)2 = 21,78 : 242 = 0,09 mol BTNT “Fe” ta có nFe = nFe(NO3)3 = 0,09 mol Quy đổi hỗn hợp X thành Fe (0,09 mol) và O (x mol) BTe: 3nFe = 2nO + 3nNO => 3.0,09 = 2x + 3.0,05 => x = 0,06 mol => m = mFe + mO = 0,09.56 + 0,06.16 = 6 gam Đáp án D Câu hỏi 14 : Hòa tan hoàn toàn 12 gam hỗn hợp Fe, Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là:
Đáp án: C Phương pháp giải: Đặt nFe = nCu = a mol → 56a + 64a = 12 gam → a = 0,1 mol Đặt nNO = x mol ; nNO2 = y mol Ta có: \({\overline M _Y} = \frac{{{m_{hh}}}}{{{n_{hh}}}} = \frac{{30x + 46y}}{{x + y}} = 19.2 = 38\) → 8x = 8y → x = y Áp dụng định luật bảo toàn e để xác định x, y. Lời giải chi tiết: Đặt nFe = nCu = a mol → 56a + 64a = 12 gam → a = 0,1 mol Đặt nNO = x mol ; nNO2 = y mol Ta có: → 8x = 8y → x = y Các quá trình cho - nhận e:
Theo định luật bảo toàn e: ne cho = ne nhận ↔ 0,3 + 0,2 = 3x + y = 3x + x → x = 0,125 = y → V = (x+ y).22,4 = 5,6 lít Đáp án C Câu hỏi 15 : Đun nóng m gam hỗn hợp Cu và Fe có tỉ lệ khối lượng tương ứng 7:3 với một lượng dung dịch HNO3. Khi các phản ứng kết thúc, thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít hỗn hợp khí (đktc) gồm NO và NO2 (không có sản phẩm khử khác của N+5). Biết lượng HNO3 đã phản ứng là 44,1 gam. Giá trị của m là:
Đáp án: D Phương pháp giải: Ta có: mCu = 0,7m và mFe = 0,3m Khối lượng chất rắn sau khi kết thúc các phản ứng là 0,75m → Chất rắn này gồm 0,7m gam Cu và 0,05m gam Fe → mFe pứ = 0,3m - 0,05m = 0,25m Ta có: nNO+ nNO2 = 0,25 mol (1) Quá trình nhận electron: NO3-+ 1e+ 2H+ → NO2+ H2O NO3-+ 3e+ 4H+ → NO+ 2H2O Ta có: nH+ = 2.nNO2+ 4.nNO = 0, 7 mol (2) Giải hệ (1) và (2) ta có: nNO và nNO2 Quá trình cho electron là: Fe → Fe2++ 2e Áp dụng định luật bảo toàn electron ta có: 2.nFe = nNO2+ 3.nNO → nFe pứ = 0,25m/56 → Tính được giá trị m. Lời giải chi tiết: Ta có: nHNO3 = 44,1: 63 = 0,7 mol Ta có: mCu = 0,7m và mFe = 0,3m Khối lượng chất rắn sau khi kết thúc các phản ứng là 0,75m → Chất rắn này gồm 0,7m gam Cu và 0,05m gam Fe → mFe pứ = 0,3m- 0,05m = 0,25m Ta có: nNO+ nNO2 = 0,25 mol (1) Quá trình nhận electron: NO3-+ 1e+ 2H+ → NO2+ H2O NO3-+ 3e+ 4H+ → NO+ 2H2O Ta có: nH+ = 2.nNO2+ 4.nNO = 0, 7 mol (2) Giải hệ (1) và (2) ta có: nNO = 0,1 mol và nNO2 = 0,15 mol Do sau phản ứng vẫn còn Fe dư và Cu nên quá trình cho electron là: Fe → Fe2++ 2e Áp dụng định luật bảo toàn electron ta có: 2.nFe = nNO2+ 3.nNO = 0,15 + 3.0,1 = 0,45 mol → nFe pứ = 0,225 mol = 0,25m/56 (mol) → m = 50,4 gam Đáp án D Câu hỏi 16 : Hòa tan hoàn toàn 100 gam hỗn hợp X gồm Fe, Cu, Ag trong dung dịch HNO3 (dư).Kết thúc phản ứng thu được 13,44 lít (đktc) hỗn hợp khí Y gồm NO2, NO, N2O theo tỉ lệ số mol tương ứng là 3:2:1 và dung dịch Z (không chứa muối NH4NO3). Cô cạn dung dịch Z thu được m gam muối khan. Giá trị của m và số mol HNO3 đã phản ứng lần lượt là:
Đáp án: C Phương pháp giải: Từ thể tích và tỉ lệ mol ta tính được số mol NO2, NO, N2O Quá trình nhận electron: NO3- + 1e + 2H+ → NO2 + H2O NO3- + 3e + 4H+ → NO + 2H2O 2NO3- + 8e + 10H+ → N2O+ 5H2O Ta có: nH+ = 2.nNO2 + 4.nNO + 10.nN2 = nHNO3 Để tìm khối lượng muối khan ta dùng định luật bảo toàn khối lượng: mX + mHNO3 = mmuối khan + mH2O + mkhí Y → Giá trị của m. Lời giải chi tiết: Ta đặt số mol NO2, NO, N2O lần lượt là 3x, 2x, x mol → 3x + 2x + x = 13,44/22,4 → x = 0,1 mol → số mol NO2, NO, N2O lần lượt là 0,3; 0,2; 0,1 mol Quá trình nhận electron: NO3- + 1e + 2H+ → NO2 + H2O NO3- + 3e + 4H+ → NO + 2H2O 2NO3- + 8e + 10H+ → N2O+ 5H2O Ta có: nH+ = 2.nNO2 + 4.nNO + 10.nN2O = 2.0,3 + 4.0,2 + 10. 0,1 = 2,4 mol = nHNO3 Bảo toàn nguyên tố H ta có: nH2O = ½ . nHNO3 = 1,2 mol Áp dụng bảo toàn khối lượng ta có: mX + mHNO3 = mmuối khan + mH2O + mkhí Y → m = mmuối khan = mX + mHNO3 - mH2O - mkhí Y = 100 + 2,4.63 - 1,2.18 - 0,3.46 - 0,2.30 - 0,1.44 = 205,4 gam Đáp án C Câu hỏi 17 : Hòa tan hoàn toàn 8,4 gam Mg vào 1 lít dung dịch HNO3 vừa đủ.Sau phản ứng thu được 0,672 lít khí N2 (đktc) và dung dịch Y. Cô cạn dung dịch Y thu được 55,8 gam muối khan. Nồng độ mol của dung dịch HNO3 đã dùng là?
Đáp án: B Phương pháp giải: Nếu dung dịch Y chỉ chứa Mg(NO3)2 thì mMg(NO3)2 < 55,8 gam → Dung dịch Y phải chứa NH4NO3 → mNH4NO3 = 55,8- mMg(NO3)2 → nNH4NO3 Quá trình nhận e: 2NO3- + 10e + 12H+ → N2 + 6H2O NO3- + 8e + 10H+ → NH4+ + 3H2O Theo 2 bán phản ứng trên ta có: nH+ = 12.nN2 + 10.nNH4+ = nHNO3 → Nồng độ của HNO3. Lời giải chi tiết: Ta có: nN2 = 0,03 mol; nMg = 0,35 mol Nếu dung dịch Y chỉ chứa Mg(NO3)2 thì mMg(NO3)2 = 0,35. 148 = 51,8 gam < 55,8 gam →Dung dịch Y phải chứa NH4NO3 → mNH4NO3 = 55,8- mMg(NO3)2 = 4 gam → nNH4NO3 = 4/ 80 = 0,05 mol Quá trình nhận e: 2NO3- + 10e + 12H+ → N2 + 6H2O NO3- + 8e + 10H+ → NH4+ + 3H2O Theo 2 bán phản ứng trên ta có: nH+ = 12.nN2 + 10.nNH4+ = 12.0,03 + 10. 0,05 = 0,86 mol = nHNO3 → CM HNO3 = 0,86/1 = 0,86 M Đáp án B Câu hỏi 18 : Hòa tan hoàn toàn m gam Cu trong dung dịch HNO3 dư thu được dung dịch X không chứa muối amoni và 4,48 lít hỗn hợp khí Y gồm NO và NO2 (đktc), tỉ khối của Y so với H2 là 17. Giá trị của m là
Đáp án: D Phương pháp giải: Bảo toàn electron Lời giải chi tiết: Đặt số mol NO là a mol; số mol NO2 là b mol Suy ra a + b = 0,2 mol; 30a + 46b = 0,2.17.2 = 6,8 gam Giải hệ trên ta có a = 0,15 và b = 0,05 Quá trình cho e : Cu → Cu2++ 2e Quá trình nhận e : N+5 + 3e → N+2 N+5 + 1e → N+4 Áp dụng định luật bảo toàn e : 2.nCu = 3.nNO + 1.nNO2 → nCu = (3.nNO+ nNO2) : 2 = 0,25 mol Suy ra m = 0,25.64 = 16 gam Đáp án D Câu hỏi 19 : Đốt cháy 6,72 gam kim loại M có hóa trị không đổi với oxi dư thu được 8,4 gam oxit. Nếu cho 5,04 gam M tác dụng hết với dung dịch HNO3 dư thu được dung dịch X và khí NO (là sản phẩm khử duy nhất). Thể tích khí NO (đktc) thu được l̀à:
Đáp án: A Phương pháp giải: Bảo toàn khối lượng, bảo toàn electron Lời giải chi tiết: Cách giải: Bảo toàn khối lượng : moxit = mM + mO2 => nO2 = 0,0525 mol => ne nhường = ne nhận = 4nO2 = 0,21 mol Cứ 6,72g M nhường 0,21 mol e => 5,04g M nhường 0,1575 mol e. => nNO = 0,1575/3 = 0,0525 mol => VNO = 1,176 lit Đáp án A Câu hỏi 20 : Cho 2,7g Al tác dụng với 150 ml dung dịch X chứa Fe(NO3)3 0,5M và Cu(NO3)2 0,5M. Sau khi phản ứng kết thúc thu được m gam chất rắn. Giá trị của m là :
Đáp án: A Phương pháp giải: Bảo toàn e Lời giải chi tiết: nAl = 0,1 mol nFe(NO3)3 = 0,075 mol nCu(NO3)2 = 0,075 mol Thứ tự các phản ứng: Al + 3Fe(NO3)3 → Al(NO3)3 + 3Fe(NO3)2 0,025dư 0,075← 0,075 → 0,075 2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu 0,05dư 0,025 ← 0,075 → 0,075 2Al + 3Fe(NO3)2 → 2Al(NO3)3 + 3Fe 0,025 → 0,0375 → 0,0375 → m chất rắn = 0,075.64 + 0,0375.56 = 6,9 gam Đáp án A Quảng cáo
|