30 bài tập về ôn tập chương Halogen có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Dung dịch NaCl bị lẫn NaI. Để làm sạch dung dịch NaCl có thể dùng:
Đáp án: C Phương pháp giải: Dựa vào tính chất hóa học của các halogen: Phi kim mạnh đẩy phi kim yếu ra khỏi dung dịch muối. Lời giải chi tiết: Dùng Cl2 sẽ có phản ứng: Cl2 + 2NaI → 2NaCl + I2 => sau phản ứng chỉ có NaCl mà không có muối khác. I2 không tan trong nước cũng dễ lọc tách. Đáp án C Câu hỏi 2 : Phương pháp hóa học dùng để phân biệt 4 dung dịch trong các lọ riêng biệt đựng HCl, HNO3, KCl, KNO3 là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Quỳ tím và AgNO3 Khi cho quỳ tím vào các lọ ta thấy hiện tượng: HCl, HNO3 cho màu đỏ (axit) (nhóm 1) KCl, KNO3 không làm đổi màu (muối) (nhóm 2) Cho AgNO3 vào từng nhóm ta thấy Nhóm 1: lọ cho kết tủa trắng là HCl (tủa AgCl) Nhóm 2: lọ cho kết tủa trắng là KCl (tửa AgCl) Đáp án C Câu hỏi 3 : Dãy axit nào sau đây được sắp xếp theo chiều tăng dần tính axit?
Đáp án: B Phương pháp giải: Lời giải chi tiết: Bán kính nguyên tử của F < Cl < Br < I => Độ dài liên kết H-X: F<Cl<Br<I Liên kết càng dài càng dễ bị đứt, tính axit tăng Vậy tính axit: HF<HCl<HBr<HI Đáp án B Câu hỏi 4 : Để thu được Brom nguyên chất từ hỗn hợp Brom, clo cần làm theo cách nào sau đây?
Đáp án: A Phương pháp giải: Dựa vào phản ứng phi kim mạnh đẩy phi kim yếu ra khỏi dung dịch muối của nó (trừ F2 vì F2 phản ứng mạnh với H2O) Lời giải chi tiết: Cl2 có khả năng đẩy Br ra khỏi muối bromua: 2NaBr + Cl2 → 2NaCl + Br2 Ta chọn chất chỉ phản ứng với Clo không được phản ứng với Brom Đáp án A Câu hỏi 5 : Thuốc thử để nhận biết dung dịch NaF, KCl, NaBr, KI là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Khi cho AgNO3 vào thì: NaF không phản ứng NaCl cho kết tủa AgCl màu trắng NaBr cho kết tủa AgBr màu vàng nhạt NaI cho kết tủa AgI màu vàng đậm Đáp án D Câu hỏi 6 : Phương trình: NaX (khan) + H2SO4 ( đặc, nóng) → NaHSO4 + HX↑. Không dùng để điều chế halogen nào?
Đáp án: D Phương pháp giải: Lời giải chi tiết: HBr và HI vừa sinh ra có tính khử sẽ nên sẽ tác dụng với axit H2SO4 đặc nóng tạo ra sản phẩm khác Đáp án D Câu hỏi 7 : Cho 15,2 gam hỗn hợp X gồm Mg và Ca phản ứng vừa đủ với 8,96 lít (đktc) hỗn hợp khí Y gồm Cl2 và O2 thu được 39,7 gam chất rắn Z chỉ gồm các muối clorua và các oxit kim loại. Khối lượng của Mg trong 15,2 gam X là
Đáp án: B Phương pháp giải: Bảo toàn khối lượng, bảo toàn e. Lời giải chi tiết: Đặt nCl2 = x; nO2 = y (mol) BTKL: mY= mZ – mX = 39,7 – 15,2 = 24,5 (g) Ta có hệ: \(\left\{ \begin{gathered} Đặt nMg = a; nCa = b (mol) Ta có hệ: \(\left\{ \begin{gathered} => mMg = 0,3.24 = 7,2 (g) Đáp án B Câu hỏi 8 : Dãy nào sau đây được sắp xếp theo chiều tăng dần tính axit ?
Đáp án: B Phương pháp giải: Phân tử càng dễ dàng phân li cho ra H+ thì tính axit càng mạnh Lời giải chi tiết: Tính axit tăng dần theo thứ tự: HF < HCl < HBr <HI do đi từ F đến I bán kính nguyên tử tăng dần làm cho liên kết H-X càng phân cực do vậy tính axit càng mạnh Đáp án B Câu hỏi 9 : Phản ứng nào sau đây không xảy ra?
Đáp án: A Phương pháp giải: Dựa vào tính chất hóa học của các hợp chất để chọn ra phản ứng không xảy ra. Lời giải chi tiết: Phản ứng hóa học không xảy ra là: 2HCl + H2SO4 (đặc) \(\xrightarrow{{{t^o}}}\) SO2 + Cl2 + H2O. Đáp án A Câu hỏi 10 : Chất nào sau đây có độ tan tốt nhất?
Đáp án: D Phương pháp giải: Dựa vào tính tan của các muối bạc halogenua. Lời giải chi tiết: AgF là muối tan nhiều trong nước. Còn các muối AgCl, AgBr và AgI đều là kết kết tủa trong nước. Đáp án D Câu hỏi 11 : Cho các phát biểu sau: (1) Khả năng oxi hoá của các đơn chất halogen giảm dần từ flo đến iot. (2) Trong các hợp chất, các halogen đều có thể có số oxi hoá: -1, +1, +3, +5, +7. (3) Các nguyên tử halogen có cấu hình e lớp ngoài cùng là np5ns2. (4) Có thể nhận biết ion F-, Cl-, Br-, I- trong các dung dịch riêng biệt chỉ bằng dung dịch AgNO3. (5) Clo được dùng để sát trùng nước sinh hoạt. Số phát biểu đúng là
Đáp án: B Phương pháp giải: Lời giải chi tiết: (1) đúng (2) sai vì trong các hợp chất F chỉ thể hiện số oxi hóa là -1 (3) sai vì cấu hình e lớp ngoài cùng của các nguyên tố halogen là ns2np5 (4) đúng (5) đúng Vậy có 3 phát biểu đúng Đáp án B Câu hỏi 12 : Dùng loại bình nào sau đây để đựng dung dịch HF?
Đáp án: B Phương pháp giải: Lựa chọn loại bình mà thành phần của nó không tác dụng được với dung dịch HF. Lời giải chi tiết: Dùng loại bình nhựa teflon (chất dẻo) để đựng dung dịch HF vì dung dịch HF không tác dụng với nhựa teflon. Không dùng bình thủy tinh hoặc bình gốm vì thành phần các loại bình này có SiO2 mà HF lại tác dụng được với SiO2. Không dùng bình nhôm vì HF tác dụng được với nhôm. Đáp án B Câu hỏi 13 : Cho chuỗi phản ứng: KMnO4 + (A) → X2 ↑+ (B) + (C) + H2O (C) + H2O \(\buildrel {dpmn} \over\longrightarrow \)X2 ↑ + (D) + (I) X2 + (D) → (A) X2 + (I) → (C) + (E) + H2O Các chất A, X2, C, D, E lần lượt là:
Đáp án: C Phương pháp giải: Lý thuyết về tính chất hóa học các chất vô cơ Lời giải chi tiết: 2KMnO4 + 16HClđ → 2KCl + 5Cl2 + 2MnCl2 + 8H2O (A) (X2) KCl + H2O \(\buildrel {dpmn} \over\longrightarrow \)Cl2 + KOH + H2 (C) (D) Cl2 + KOH → KCl + KClO + H2O (I) (E) Đáp án C Câu hỏi 14 : Cho bốn đơn chất F2 ; Cl 2 ; Br2 ; I2. Chất có nhiệt độ sôi cao nhất là:
Đáp án: C Phương pháp giải: Tính chất vật lý của các nguyên tố nhóm Halogen Lời giải chi tiết: Khối lượng phân tử: I2 > Br2 > Cl2 > F2 Nhiệt độ sôi càng cao khi khối lượng phân tử càng lớn => I2 có nhiệt độ sôi cao nhất. Đáp án C Câu hỏi 15 : Phương pháp sunfat là phương pháp dùng axit khó bay hơi (H2SO4 đặc) đẩy axit dễ bay hơi ra khỏi dung dịch muối. Phương pháp sunfat không điều thể điều chế được:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Câu hỏi 16 : Tại sao người ta điều chế được nước clo mà không điều chế được nước flo?
Đáp án: C Phương pháp giải: - Dựa vào đặc điểm phản ứng giữa flo với nước Lời giải chi tiết: Vì flo tác dụng mãnh liệt với nước, bốc cháy sinh ra khí O2 và HF Đáp án C Câu hỏi 17 : Điện phân nóng chảy 20,6 gam một muối halogenua NaX người ta thu được 2,24 lít khí (đktc). Nguyên tố X là:
Đáp án: C Phương pháp giải: Tính toán theo PTHH: 2NaX → 2Na + X2 Lời giải chi tiết: \({n_{{X_2}}} = \frac{{2,24}}{{22,4}} = 0,1(mol)\) 2NaX → 2Na + X2 (mol) 0,2 ← 0,2 \( \Rightarrow {M_{NaX}} = \frac{{20,6}}{{0,2}} = 103(g/mol) \Rightarrow {M_X} = 103 - 23 = 80(g/mol) \Rightarrow X:Brom\) Đáp án C Câu hỏi 18 : Nguyên tố R là phi kim thuộc phân nhóm chính trong bảng tuần hoàn. Tỷ lệ % R trong oxit cao nhất với %R trong hợp chất khí với hidro là 0,5955. Vậy R là:
Đáp án: C Phương pháp giải: Gọi công thức của R với oxi là R2Ox (x = 4, 5, 6, 7) Suy ra công thức của R với hidro là RH8 – x Lập phương trình với tỉ lệ 0,5955 ra được mối quan hệ giữa R và x. Từ đó biện luận tìm được nghiệm thỏa mãn. Lời giải chi tiết: Gọi công thức của R với oxi là R2Ox (x = 4, 5, 6, 7) Suy ra công thức của R với hidro là RH8 – x Theo bài ta có: \(\begin{array}{l}\frac{{\frac{{2R}}{{2R + 16x}}}}{{\frac{R}{{R + 8 - x}}}} = 0,5955 \Rightarrow \frac{{2(R + 8 - x)}}{{2R + 16x}} = 0,5955\\ \Rightarrow 2R + 16 - 2x = 1,191R + 9,528x\\ \Rightarrow 0,809R = 11,528x - 16\end{array}\) Chạy giá trị x từ 4 đến 7 ta thấy x = 7 thì R = 79,97 ≈ 80 → R là Brom Đáp án C Câu hỏi 19 : Cho 35,6 gam hỗn hợp 2 muối NaX, NaY với X,Y là hai halogen ở hai chu kì liên tiếp vào dung dịch AgNO3 dư thu được 61,1 gam kết tủa.X và Y là:
Đáp án: C Phương pháp giải: Chia 2 trường hợp TH1: Hai halogen là F và Cl → kết tủa thu được chỉ là AgCl; TH2: Hai halogen X và Y đều tạo kết tủa AgX và AgY. Lời giải chi tiết: TH1: 2 muối là NaF và NaCl. Khi phản ứng với dd AgNO3 dư chỉ thu được kết tủa là AgCl (vì AgF tan) PTHH: NaCl + AgNO3 → NaNO3 + AgCl↓ \({n_{AgCl}} = \frac{{61,1}}{{143,5}} = 0,4258\,(mol)\) Theo PTHH: nNaCl = nAgCl = 0,4258 (mol) → mNaCl = 0,4258×58,5 ≈ 24,9 (g) → mNaF = 35,6 - 24,9 = 10,7 (g) → TH này thỏa mãn. TH2: 2 muối NaX và NaY cùng tạo kết tủa với dd AgNO3 Đặt công thức chung của 2 muối là \(Na\overline X \) PTHH:\(Na\overline X + AgN{O_3}\buildrel {} \over\longrightarrow Ag\overline X + NaN{O_3}\) Theo PTHH có: \(\begin{array}{l}Na\overline X = Ag\overline X \\ \Rightarrow \frac{{35,6}}{{23 + \overline X }} = \frac{{61,1}}{{108 + \overline X }}\\ \Rightarrow 3844,8 + 35,6\overline X = 1405,3 + 61,1\overline X \\ \Rightarrow 25,5\overline X = 2439,5\\ \Rightarrow \overline X = 95,66\end{array}\) X, Y ở hai chu kì liên tiếp nên X, Y là Brom và Iot Đáp án C Câu hỏi 20 : Cho 1,03 gam muối natri halogen A tác dụng với dung dịch AgNO3 dư thì thu được một kết tủa, kết tủa này sau khi bị thủy phân hoàn toàn cho 1,08 gam bạc.Xác định tên muối A.
Đáp án: B Phương pháp giải: Gọi công thức muối A là NaX PTHH: NaX + AgNO3 → AgX + NaNO3 2AgX → 2Ag + X2 Tính mol NaX theo mol Ag. Từ đó tính được MNaX = mNaX : nNaX =? Lời giải chi tiết: Gọi công thức muối A là NaX PTHH: NaX + AgNO3 → AgX + NaNO3 2AgX → 2Ag + X2 nAg = 1,08: 108 = 0,01 (mol) → nNaX = nAgX = nAg = 0,01 (mol) MNaX = mNaX : nNaX = 1,03 : 0,01 = 103 → MX = 103 - 23 = 80 → X là Brom. Đáp án B Câu hỏi 21 : Chất A là muối canxi halogennua. Cho dung dịch chứa 0,2g A tác dụng với lượng dư dung dịch AgNO3 thì thu được 0,376g kết tủa halogennua. Công thức của A là:
Đáp án: C Phương pháp giải: Đặt công thức muối halogen là CaX2 PTHH: CaX2 + 2AgNO3 → Ca(NO3)2 + 2AgX↓ Theo PTHH có: nAgX = 2nCaX2 \( \Rightarrow \frac{{0,376}}{{108 + X}} = 2.\frac{{0,2}}{{40 + 2X}} \Rightarrow X = ?\) Lời giải chi tiết: Đặt công thức muối halogen là CaX2 PTHH: CaX2 + 2AgNO3 → Ca(NO3)2 + 2AgX↓ Theo PTHH có: nAgX = 2nCaX2 \(\begin{array}{l} \Rightarrow \frac{{0,376}}{{108 + X}} = 2.\frac{{0,2}}{{40 + 2X}}\\ \Rightarrow 15,04 + 0,752X = 43,2 + 0,4X\\ \Rightarrow 0,352X = 28,16\\ \Rightarrow X = 80\end{array}\) → X là Br → Công thức muối là CaBr2 Đáp án C Câu hỏi 22 : Cho dung dịch chứa 2,08 gam muối bari của một halogen (muối A) tác dụng với dung dịch chứa AgNO3 vừa đủ thu được 2,87 gam kết tủa.Công thức của muối A là
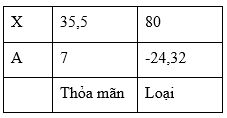
Đáp án: A Phương pháp giải: Đặt công thức muối A là BaX2 với X là halogen PTHH: BaX2 + 2AgNO3 → Ba(NO3)2 + 2AgX↓ Theo ĐB: \(\frac{{2,08}}{{137 + 2X}}\) → \(\frac{{2,88}}{{108 + X}}\) Theo PT có: \(\begin{array}{l}{n_{AgX}} = 2{n_{Ba{X_2}}}\\ \Rightarrow \frac{{2,87}}{{108 + X}} = 2.\frac{{2,08}}{{137 + 2X}} \Rightarrow X = ?\end{array}\) Lời giải chi tiết: Đặt công thức muối A là BaX2 với X là halogen PTHH: BaX2 + 2AgNO3 → Ba(NO3)2 + 2AgX↓ Theo ĐB: \(\frac{{2,08}}{{137 + 2X}}\) → \(\frac{{2,88}}{{108 + X}}\) Theo PT có: \(\begin{array}{l}{n_{AgX}} = 2{n_{Ba{X_2}}}\\ \Rightarrow \frac{{2,87}}{{108 + X}} = 2.\frac{{2,08}}{{137 + 2X}}\\ \Rightarrow 393,19 + 5,74X = 449,28 + 4,16X\\ \Rightarrow 1,58X = 56,09\\ \Rightarrow X = 35,5\,(g/mol)\end{array}\) → X là Cl → Công thức muối: BaCl2 Đáp án A Câu hỏi 23 : Hòa tan 4,25 gam 1 muối halogen của kim loại kiềm vào dung dịch AgNO3 dư thu được 14,35g kết tủa. Công thức của muối là
Đáp án: B Phương pháp giải: Đặt công thức muối halogen là AX (với A là kim loại kiềm, X là nguyên tố halogen) PTHH: AX + AgNO3 → ANO3 + AgX↓ Theo PT có: \({n_{{\rm{AX}}}} = {n_{AgX}} \Rightarrow \frac{{4,25}}{{A + X}} = \frac{{14,35}}{{108 + X}}\) → Mối quan hệ giữa A và X, từ đó chạy giá trị của X ta tìm được A thỏa mãn. Lời giải chi tiết: Đặt công thức muối halogen là AX (với A là kim loại kiềm, X là nguyên tố halogen) PTHH: AX + AgNO3 → ANO3 + AgX↓ Theo ĐB: \(\frac{{4,25}}{{A + X}}\) → \(\frac{{14,35}}{{108 + X}}\) Theo PT có: \(\begin{array}{l}{n_{{\rm{AX}}}} = {n_{AgX}}\\ \Rightarrow \frac{{4,25}}{{A + X}} = \frac{{14,35}}{{108 + X}}\\ \Rightarrow 459 + 4,25X = 14,35A + 14,35X\\ \Rightarrow 14,35A + 10,1X = 459\end{array}\) Kẻ bảng ta có:
Vậy X là Cl, A là Li. Công thức muối là LiCl Đáp án B Câu hỏi 24 : Khi cho m gam kim loại canxi tác dụng hoàn toàn với 17,92 lít khí X2 (đktc) thì thu được 88,8 gam muối halogennua.Giá trị của m và công thức của X2 là:
Đáp án: B Phương pháp giải: PTHH: Ca + X2 \(\xrightarrow{{{t^0}}}\) CaX2 Tính mol CaX2 theo mol X2. Có khối lượng và số mol suy ra được phân tử khối, từ đó tìm được X Lời giải chi tiết: nX2(đktc) = 17,92 : 22,4 = 0,8 (mol) PTHH: Ca + X2 \(\xrightarrow{{{t^0}}}\) CaX2 0,8 ← 0,8 → 0,8 (mol) Theo PTHH: nCa = nX2 = 0,8 (mol) → mCa = 0,8×40 = 32 (g) Theo PTHH: nCaX2 = nX2 = 0,8 (mol) \(\begin{array}{l} \Rightarrow M_{Ca{X_2}}^{} = \frac{{{m_{Ca{X_2}}}}}{{{n_{Ca{X_2}}}}} = \frac{{88,8}}{{0,8}} = 111\,(g/mol)\\ \Rightarrow 40 + 2{M_X} = 111\\ \Rightarrow {M_X} = 35,5\,(g/mol)\end{array}\) → X là Clo. Vậy công thức muối là CaCl2. Đáp án B Câu hỏi 25 : X, Y là hai halogen thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Hỗn hợp A chứa 2 muối của X, Y với natri. Để kết tủa hoàn toàn 2,2 gam hỗn hợp A cần dùng 150 ml dung dịch AgNO3 0,2M. Hai nguyên tố X, Y là
Đáp án: A Phương pháp giải: Đặt công thức chung của hai muối là:\(Na\overline X \) \(\eqalign{ Lời giải chi tiết: nAgNO3 = 0,15×0,2 = 0,03 (mol) Đặt công thức chung của hai muối là: \(Na\overline X \) \(\eqalign{ Vì X, Y là 2 halogen thuộc 2 chu kì liên tiếp nhau trong dãy BTH → 2 nguyên tố là Cl và Br Đáp án A Câu hỏi 26 : Có 4 lọ mất nhãn đựng 4 dung dịch riêng biệt không màu là NaF, NaCl, NaBr và NaI. Có thể dùng dung dịch nào trong các dung dịch cho dưới đây để phân biệt được 3 dung dịch trên ?
Đáp án: B Phương pháp giải: NaF, NaCl, NaBr và NaI đều là muối tạo kim loại Na và các gốc axit khác nhau → chọn thuốc thử để phân biệt các gốc axit. Lời giải chi tiết: Dùng dd AgNO3 để phân biệt được 4 dd trên, vì khi cho dd AgNO3 vào các dd này thì: + Không có hiện tượng gì là dd NaF + Xuất hiện kết tủa trắng là dd NaCl PTHH: NaCl + AgNO3 → AgCl↓ (trắng) + NaNO3 + Xuất hiện kết tủa vàng nhạt là dd NaBr PTHH: NaBr + AgNO3 → AgBr↓ (vàng nhạt) + NaNO3 + Xuất hiện kết tủa vàng đậm là dd NaI PTHH: NaI+ AgNO3 → AgI↓ (vàng đậm) + NaNO3 Đáp án B Câu hỏi 27 : Cho các chất: CaCO3; KOH; KI; KMnO4; Si; Na ; FeSO4; MnO2; Mg; Cl2. Trong các chất trên có bao nhiêu chất có khả năng phản ứng được với dung dịch HBr mà trong đó HBr đóng vai trò là chất khử?
Đáp án: B Phương pháp giải: Viết PTHH xảy ra, chọn các chất mà HBr sau phản ứng số oxh tăng lên thì HBr sẽ đóng vai trò là chất khử. Lời giải chi tiết: Các phản ứng trao đổi CaCO3 + 2HBr → CaBr2 + CO2↑ + H2O KOH + KBr → KBr + H2O Các phản ứng HBr đóng vai trò là chất oxi hóa 2Na + 2HBr → 2NaBr + H2↑ Các phản ứng HBr đóng vai trò là chất khử \(\eqalign{ => có 3 chất phản ứng với HBr mà HBr đóng vai trò là chất khử. Đáp án B Câu hỏi 28 : Cho 6,96 gam hỗn hợp rắn X gồm Zn, Mg, Al (số mol mỗi kim loại bằng nhau) tác dụng với Cl2 thu được 14,06 gam hỗn hợp rắn Y. Cho Y tác dụng hết với dung dịch HCl thu được V lít khí (đktc). Giá trị của V là
Đáp án: C Phương pháp giải: Bảo toàn khối lượng; bảo toàn electron. Lời giải chi tiết: Đặt số mol mỗi kim loại là a mol: mX = 65a + 24b + 27c = 6,96 => a = 0,06 mol - Xét phản ứng của X với Cl2: BTKL: mCl2 = mY - mX = 14,06 - 6,96 = 7,1 gam => nCl2 = 7,1 : 71 = 0,1 mol - Xét tổng thể toàn quá trình: Zn tạo Zn+2, Mg tạo Mg+2, Al tạo Al+3, Cl- tạo Cl2, H+ tạo H2 BT eletron ta có: 2nZn + 2nMg + 3nAl = 2nCl2 + 2nH2 => 0,06.2 + 0,06.2 + 0,06.3 = 0,1.2 + 2nH2 => nH2 = 0,11 mol => V = 0,11.22,4 = 2,464 lít Đáp án C Câu hỏi 29 : Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Phần trăm khối lượng của NaY trong hỗn hợp ban đầu là
Đáp án: B Phương pháp giải: +) TH1: Nếu hỗn hợp đầu là NaF và NaCl => kết tủa chỉ có AgCl (Vì AgF tan) +) TH2: Nếu không có NaF Lời giải chi tiết: +) TH1: Nếu hỗn hợp đầu là NaF và NaCl => kết tủa chỉ có AgCl (Vì AgF tan) => nAgCl = 0,06 mol = nNaCl => nNaF = 0,06 mol => %mNaCl = 58,2% +) TH2: Nếu không có NaF Gọi số mol của NaX và NaY lần lượt là x và y => mmuối Na = x.(23 + X) + y.(23 + Y) = 6,03g Và mKết tủa = x.(108 + X) + y.(108 + Y) = 8,61g Trừ vế với vế ta được: (x + y).85 = 2,58g => x + y = 0,0304 mol => Mtrung bình muối Na = 198,66 => Mhalogen trung bình = 175,66 => Không có các giá trị thỏa mãn. Đáp án B Câu hỏi 30 : Hỗn hợp X gồm NaBr và NaI. Cho hỗn hợp X tan trong nước thu được dung dịch A. Nếu cho brom dư vào dung dịch A, sau phản ứng hoàn toàn, cô cạn thấy khối lượng muối khan thu được giảm 7,05 gam. Nếu sục khí clo dư vào dung dịch A, phản ứng hoàn toàn, cô cạn dung dịch thấy khối lượng muối khan giảm 22,625 gam. Thành phần % khối lượng của một chất trong hỗn hợp X là:
Đáp án: C Phương pháp giải: - Khi A phản ứng với Br2: 2NaI + Br2 → 2NaBr + I2 - Khi A phản ứng với Cl2: 2NaBr + Cl2 → 2NaCl + Br2 2NaI + Cl2 → 2NaCl + I2 Lời giải chi tiết: Gọi số mol NaBr và NaI trong X lần lượt là x và y - Khi A phản ứng với Br2: 2NaI + Br2 → 2NaBr + I2 => mmuối giảm = 127y – 80y = 7,05 => y = 0,15 mol - Khi A phản ứng với Cl2: 2NaBr + Cl2 → 2NaCl + Br2 2NaI + Cl2 → 2NaCl + I2 => mgiảm = (80x + 127y) – 35,5(x + y) = 22,625 => x = 0,2 mol Vậy %mNaBr = 47,8% và %mNaI = 52,2% Đáp án C Quảng cáo
|