30 bài tập lý thuyết về clo có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Cho dãy các chất sau: Al, Fe, KOH, KBr, Au, NaI, dung dịch SO2, C, S. Số chất trong dãy clo tác dụng được là:
Đáp án: C Phương pháp giải: Dựa vào tính chất hóa học của Cl2. Lời giải chi tiết: Al + 1,5 Cl2 → AlCl3 Fe+ 1,5 Cl2 → FeCl3 2KOH + Cl2 → KCl + KClO + H2O Cl2 +2 KBr → 2 NaCl + Br2 Cl2 +2 NaI → 2 NaCl + I2 Cl2 + SO2 +2H2O → 2 HCl + H2SO4 Cl2 + S \(\xrightarrow{{{t^o}}}\) S2Cl2 Vậy có 7 chất tác dụng được với clo Đáp án C
Câu hỏi 2 : Nước Javen được điều chế bằng phương pháp nào dưới đây?
Đáp án: D Phương pháp giải: Khi dẫn Cl2 vào dung dịch NaOH ta thu được dung dịch nước Giaven. Lời giải chi tiết: Ở nhiệt độ thường, khi dẫn Cl2 vào dung dịch NaOH ta thu được dung dịch nước Giaven (gồm NaCl và NaClO): Cl2 + 2 NaOH → NaClO + NaCl + H2O Nếu có nhiệt độ ta ko thu được NaClO mà thu được NaClO3 Đáp án D Câu hỏi 3 : Trong phản ứng: Cl2 + H2O HCl + HClO clo đóng vai trò
Đáp án: B Phương pháp giải: Xác định số oxi hóa của Cl trước và sau phản ứng từ đó xác định vai trò của Cl. + Chất khử là chất nhường e => số oxi hóa tăng + Chất oxi hóa là chất nhận e => số oxi hóa giảm Lời giải chi tiết: Xét sự thay đổi số oxi hóa của Cl: Tăng từ 0 lên +1 (trong HClO) Giảm từ 0 xuống -1 (trong HCl) => vừa là chất khử vừa là chất oxi hóa Đáp án B Câu hỏi 4 : Trong phòng thí nghiệm clo được điều chế bằng cách oxi hóa hợp chất nào sau đây?
Đáp án: C Phương pháp giải: Dựa vào nguyên tắc điều chế Cl2 trong phòng thí nghiệm: Dùng những chất có tính oxi hóa mạnh (KMnO4, MnO2, KClO3, …) để oxi hóa HCl đặc. Lời giải chi tiết: Dùng những chất có tính oxi hóa mạnh (KMnO4, MnO2, KClO3, …) để oxi hóa HCl đặc. Đáp án C Câu hỏi 5 : Nước clo có màu:
Đáp án: A Phương pháp giải: Dựa vào tính chất vật lí của Cl2. Lời giải chi tiết: Dung dịch nước clo là dung dịch hỗn hợp giữa Cl2, HCl và HClO nên có màu vàng lục, mùi hắc của Cl2 Đáp án A Câu hỏi 6 : Hiện tượng xảy ra khi cho dây sắt nóng đỏ vào bình đựng khí clo là:
Đáp án: B Phương pháp giải: Dựa vào phản ứng giữa Fe và Cl2 để nêu hiện tượng của phản ứng. Lời giải chi tiết: Fe + Cl2 → FeCl3 (có màu nâu) Đáp án B Câu hỏi 7 : Kim loại nào sau đây khi tác dụng với HCl và Clo cho cùng một muối clorua kim loại:
Đáp án: D Phương pháp giải: Dựa vào tính chất hóa học của các chất. Chú ý: Khi cho Fe phản ứng với Cl2 thu được muối Fe3+ còn khi phản ứng với HCl thu được muối Fe2+ Lời giải chi tiết: Cu, Ag ko tác dụng được với HCl => loại A và B Fe có 2 hóa trị khi tác dụng vs HCl cho FeCl2 còn tác dụng với Cl2 cho FeCl3 => loại C Zn tác dụng với Cl2 và HCl đều cho ZnCl2 => chọn D Đáp án D Câu hỏi 8 : Khí clo nặng hơn không khí
Đáp án: C Phương pháp giải: Tỉ khối của khí X so với không khí: dX/kk = MX: 29 Lời giải chi tiết: M Cl2 = 35,5.2 = 71 M KK = 29 =>Tỉ khối của Cl2 so với không khí: dCl2/kk = 71: 29 = 2,45 Đáp án C Câu hỏi 9 : Nguyên tố Clo có số oxi hóa +7 trong hợp chất
Đáp án: C Phương pháp giải: Dựa vào cách xác định số oxi hóa của một nguyên tố trong hợp chất: +) Trong một hợp chất, tổng số oxi hóa của từng nguyên tố nhân với hệ số của từng nguyên tố đó bằng 0. +) Trong hầu hết các hợp chất, O có số oxi hóa -2 và H có số oxi hóa +1. Lời giải chi tiết: Dựa vào quy tắc xác định số oxi hóa của Cl trong các hợp chất ta có: A. Cl có số oxi hóa là +5 B. Cl có số oxi hóa là +3 C. Cl có số oxi hóa là +7 D. Cl có số oxi hóa là +1 Đáp án C Câu hỏi 10 : Trong phòng thí nghiệm, người ta điều chế clo bằng cách
Đáp án: B Phương pháp giải: Điều chế Cl2 trong phòng thí nghiệm: Cho HCl tác dụng với các chất có tính oxh mạnh Lời giải chi tiết: Điều chế Cl2 trong phòng thí nghiệm: phương pháp: Cho HCl tác dụng với các chất có tính oxh mạnh 4HCl + MnO2 \(\buildrel {{t^0}} \over\longrightarrow \) MnCl2 + Cl2 + 2H2O Đáp án B Câu hỏi 11 : Khí Clo không tác dụng được với chất nào sau đây?
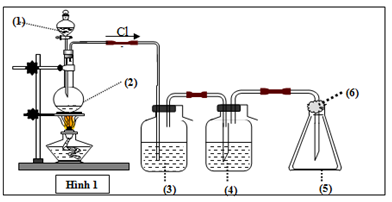
Đáp án: C Phương pháp giải: Lời giải chi tiết: Cl2 không tác dụng trực tiếp được với O2 Đáp án C Câu hỏi 12 : Cho sơ đồ thí nghiệm điều chế và thu khí clo trong phòng thí nghiệm từ các chất ban đầu là MnO2 và dung dịch HCl đặc . Thí nghiệm được thực hiện trong điều kiện đun nóng, sẽ có 1 phần khí HCl bị bay hơi. Để thu được khí clo sạch thì bình số (3); (4) sẽ chứa lần lượt các chất nào trong các phương án sau?
Đáp án: D Phương pháp giải: Lý thuyết điều chế khí clo trong phòng thí nghiệm sgk hóa 10 Lời giải chi tiết: - Phản ứng: MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O => khí Cl2 có lẫn HCl và H2O - Bình (3) : NaOH bão hòa (NaOH + HCl → NaCl + H2O) - Bình (4) : H2SO4 đặc (Hút nước) Đáp án D Câu hỏi 13 : Cho hình vẽ mô tả thí nghiệm điều chế Cl2 từ MnO2 và dung dịch HCl.
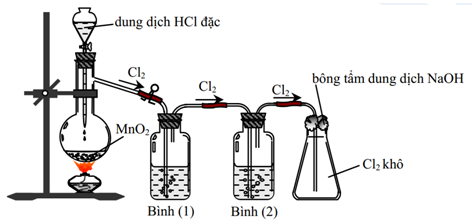
Khí Cl2 sinh ra thường có lẫn hơi nước và hidroclorua. Để thu được khí Cl2 khô thì bình (1) đựng dung dịch
Đáp án: A Phương pháp giải: Dựa vào phương pháp điều chế Cl2 trong phòng thí nghiệm. Lời giải chi tiết: MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O Khí đi ra khỏi bình cầu là Cl2, HCl và hơi H2O Bình 1 giữ HCl sử dụng dung dịch NaCl Bình 2 giữ nước sử dụng H2SO4 đặc Đáp án A Câu hỏi 14 : Cho Cl2 lần lượt tác dụng với HF, HBr, O2, H2. Số trường hợp có xảy ra phản ứng hóa học là
Đáp án: B Phương pháp giải: Dựa vào tính chất hóa học của Cl2. Lời giải chi tiết: Cl2 có thể phản ứng được với các chất: HBr, H2 PTHH: Cl2 + 2HBr → 2HCl + Br2 Cl2 + H2 \(\xrightarrow{a/s}\) 2HCl Vậy có 2 trường hợp xảy ra phản ứng hóa học Đáp án B Câu hỏi 15 : Clo có các số oxi hóa là
Đáp án: D Phương pháp giải: Lời giải chi tiết: Clo có các số oxi hóa là -1; 0; +1; +3; +5; +7. Đáp án D Câu hỏi 16 : Trong các khí sau, khí có màu vàng lục, mùi xốc, rất độc là
Đáp án: A Phương pháp giải: Dựa vào tính chất vật lí của các khí để chọn ra đáp án đúng. Lời giải chi tiết: Khí có màu vàng lục, mùi xốc, rất độc là Cl2. Đáp án A Câu hỏi 17 : Trong công nghiệp, khí clo thường được điều chế bằng cách:
Đáp án: C Phương pháp giải: Dựa vào phương pháp điều chế khí clo để chọn đáp án phù hợp. Lời giải chi tiết: Trong công nghiệp, khí clo thường được điều chế bằng cách: điện phân dung dịch NaCl có màng ngăn \(2NaCl + 2{H_2}O\xrightarrow{{dpcmn}}2NaOH + C{l_2} + H{}_2\) Đáp án C Câu hỏi 18 : Sục khí clo vào lượng dung dịch NaOH ở nhiệt độ thường sản phẩm là:
Đáp án: C Phương pháp giải: Dựa vào tính chất hóa học của clo để viết phương trình. Lời giải chi tiết: Phương trình hóa học xảy ra: Cl2 + 2NaOH → NaCl + NaClO + H2O Vậy sản phẩm thu được có NaCl, NaClO. Đáp án C Câu hỏi 19 : Thành phần của nước clo có chứa những chất sau:
Đáp án: A Phương pháp giải: Dựa vào phản ứng của Cl2 với nước để xác định thành phần của nước clo. Lời giải chi tiết: PTHH: \(C{l_2} + {\text{ }}{H_2}O{\text{ }} \rightleftarrows {\text{ }}HCl{\text{ }} + {\text{ }}HClO\) Do phản ứng thuận nghịch nên thành phần của nước clo gồm Cl2, H2O, HCl và HClO (Cl2 tuy là khí nhưng vẫn tan một phần trong nước). Đáp án A Câu hỏi 20 : Trong PTN, khí clo thường được điều chế bằng cách oxi hóa hợp chất nào sau đây?
Đáp án: C Phương pháp giải: Phương pháp điều chế halogen Lời giải chi tiết: Trong phòng thí nghiệm, Cl2 được điều chế bằng cách dùng những chất có tính oxi hóa mạnh (MnO2, KClO3, KMnO4, ...) để oxi hóa HCl đặc: 4HCl đặc + MnO2 → MnCl2 + Cl2 + 2H2O (đun nóng) Đáp án C Câu hỏi 21 : Để làm sạch khí clo khi điều chế từ MnO2 và HCl đặc, cần dẫn khí thu được lần lượt qua các bình rửa khí:
Đáp án: C Phương pháp giải: Lời giải chi tiết: MnO2 + 4HClđặc \(\buildrel {{t^0}} \over\longrightarrow \)MnCl2 + Cl2 + 2H2O Ban đầu khí Cl2 có lẫn H2O và HCl - Cần loại bỏ HCl trước (dung dịch NaCl) - Sau đó làm khô Cl2 – loại bỏ H2O (H2SO4 đặc) (không làm ngược lại vì: khi đi qua dung dịch NaCl thì Cl2 sẽ lẫn hơi nước) Đáp án C Câu hỏi 22 : Chất nào không được dùng để làm khô khí clo ?
Đáp án: C Phương pháp giải: Nguyên tắc chọn hóa chất để làm khô khí: - Chất làm khô có tính háo nước - Chất làm khô không được phản ứng với chất cần làm khô Lời giải chi tiết: Nguyên tắc chọn hóa chất để làm khô khí: - Chất làm khô có tính háo nước - Chất làm khô không được phản ứng với chất cần làm khô Trong số 4 chất thì CaO phản ứng với H2O để tạo Ca(OH)2 sau đó Ca(OH)2 phản ứng với Cl2 nên không dùng CaO để làm khô khí Cl2. PTHH: CaO + H2O → Ca(OH)2 Ca(OH)2 + Cl2 → CaOCl2 + H2O Đáp án C Câu hỏi 23 : Hiện tượng xảy ra trong thí nghiệm bên là:
Đáp án: D Phương pháp giải: Viết PTHH từ đó suy ra hiện tượng của phản ứng. Lời giải chi tiết: Phản ứng: MnO2 + 4HClđ \(\buildrel {{t^0}} \over\longrightarrow \)MnCl2 + Cl2↑ + 2H2O => Hiện tượng của phản ứng: Có khí màu vàng, MnO2 tan dần Đáp án D Câu hỏi 24 : Ứng dụng nào sau đây không phải của Cl2 ?
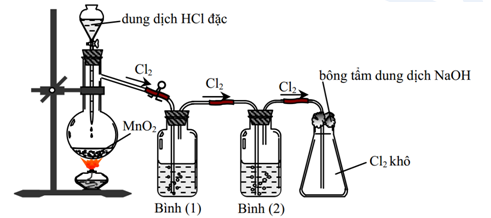
Đáp án: A Phương pháp giải: Lý thuyết về ứng dụng của Clo Lời giải chi tiết: Cl2 không được dùng để sản xuất H2SO4. Đáp án A Câu hỏi 25 : Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl:
Cho các phát biểu sau: (a) Bình (1) để hấp thụ khí HCl, bình (2) để hấp thụ hơi nước (b) Có thể đổi vị trí bình (1) và bình (2) cho nhau (c) Sử dụng bông tẩm kiềm để tránh khí Cl2 thoát ra môi trường (d) Chất lỏng sử dụng trong bình (1) lúc đầu là nước cất (e) Có thể thay thế HCl đặc bằng H2SO4 đặc, khi đó chất rắn là NaCl và KMnO4 (f) Bình (2) đựng dung dịch H2SO4 đặc, có thể thay thế bằng bình đựng CaO (viên) Số phát biểu không đúng là:
Đáp án: A Phương pháp giải: Lý thuyết về điều chế khí Cl2 Lời giải chi tiết: (a) Bình (1) để hấp thụ khí HCl, bình (2) để hấp thụ hơi nước => Đúng (b) Có thể đổi vị trí bình (1) và bình (2) cho nhau => Sai. Bình hấp thu nước luôn để sau cùng vì các quá trình khác luôn có hơi nước lẫn vào (c) Sử dụng bông tẩm kiềm để tránh khí Cl2 thoát ra môi trường => Đúng (d) Chất lỏng sử dụng trong bình (1) lúc đầu là nước cất => Sai. Dùng dung dịch MCl bão hòa (NaCl) vì NaCl hấp thụ tốt HCl Giải thích: Cl2 phản ứng với H2O theo cân bằng: Cl2 + H2O ↔ HCl + HClO. Trong dung dịch NaCl bão hòa thì nồng độ của ion Cl- rất lớn => cân bằng dịch chuyển theo chiều nghịch => giảm độ tan của Cl2 (e) Có thể thay thế HCl đặc bằng H2SO4 đặc, khi đó chất rắn là NaCl và KMnO4 => Đúng. [KMnO4 + HCl (H2SO4 + NaCl) ] (f) Bình (2) đựng dung dịch H2SO4 đặc, có thể thay thế bằng bình đựng CaO (viên) => Sai. Vì CaO + H2O tạo ra Ca(OH)2 có thể phản ứng với Cl2 Vậy có 3 phát biểu không đúng Đáp án A Câu hỏi 26 : Chất khí có màu vàng lục là
Đáp án: A Phương pháp giải: Lời giải chi tiết: Chất khí có màu vàng lục là Cl2 Đáp án A Câu hỏi 27 : Kim loại tác dụng được với axit HCl loãng và khí clo cho cùng một loại muối clorua kim loại là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: 2Fe + 3Cl2 → 2FeCl3; Fe + 2HCl → FeCl2 + H2 Zn+ Cl2 → ZnCl2; Zn+ 2HCl → ZnCl2 + H2 Cu + Cl2 → CuCl; Cu không tác dụng với dd HCl 2Ag + Cl2 → 2AgCl; Ag không tác dụng với dd HCl Đáp án D Câu hỏi 28 : Cho phản ứng: Cl2+ 2 NaBr \( \to \) 2 NaCl + Br2. Nguyên tố clo
Đáp án: B Phương pháp giải: - Xác định số oxi hóa của nguyên tố Clo trước và sau phản ứng để rút ra kết luận Lời giải chi tiết: \(\eqalign{ Số oxi hóa của clo giảm sau phản ứng → Cl2 đóng vai trò chất oxi hóa → trong phản ứng Cl2 chỉ bị khử Đáp án B Chú ý: Chất đóng vai trò là chất khử thì bị oxi hóa Chất đóng vai trò là chất oxi hóa thì sẽ bị khử
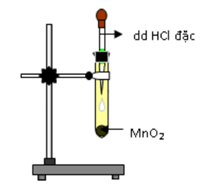
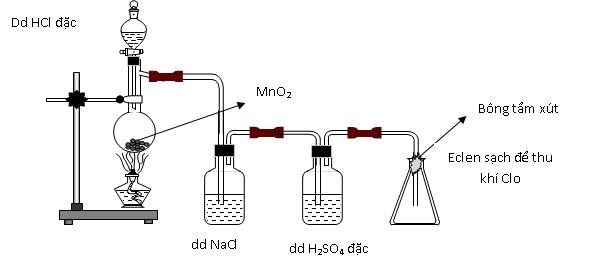
Câu hỏi 29 : Thực hiện thí nghiệm điều chế clo theo sơ đồ sau:
Cho các nhận định sau: (a) Bình chứa dung dịch NaCl dùng để giữ khí HCl. (b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước. (c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước. (d) Có thể thay chất rắn trong bình cầu thành thuốc tím. Số nhận định chính xác là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: (a) Bình chứa dung dịch NaCl dùng để giữ khí HCl. => đúng (b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước. => đúng (c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước. => sai vì nước không giữ được khí clo vì nước phản ứng rất yếu với clo (d) Có thể thay chất rắn trong bình cầu thành thuốc tím. => đúng vì thuốc tím cũng là một chất oxi hóa mạnh tương tự như MnO2 Vậy có 3 phát biểu đúng. Đáp án C Câu hỏi 30 : Trong các phản ứng dưới đây, phản ứng nào chứng tỏ nguyên tố clo vừa là chất khử, vừa là chất oxi hóa ?
Đáp án: B Phương pháp giải: Chất cho e => chất khử (số oxi hóa tăng) Chất nhận e => chất oxi hóa (số oxi hóa giảm) Chất vừa có khả năng cho và nhận e => vừa là chất khử vừa là chất oxi hóa (số oxi hóa vừa tăng và giảm) Lời giải chi tiết: A. Số oxi hóa của Cl giảm từ 0 xuống -1 => chất oxi hóa B. Cl0 → Cl-1 (trong HCl) đóng vai trò là chất oxy hóa Cl0 → Cl-+1 (trong HClO) đóng vai trò là chất khử C. Số oxi hóa của Cl giảm từ 0 xuống -1 => chất oxi hóa D. Số oxi hóa của Cl giảm từ 0 xuống -1 => chất oxi hóa Đáp án B Quảng cáo
|