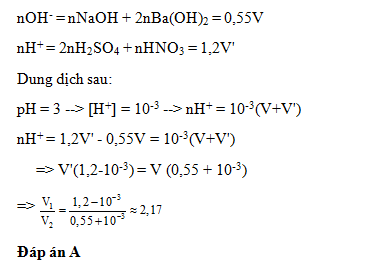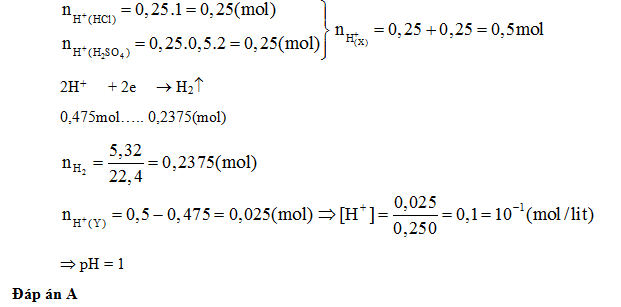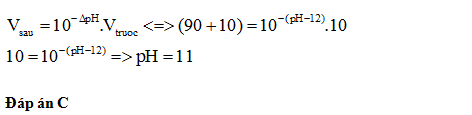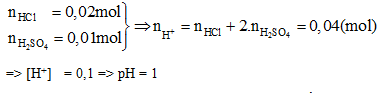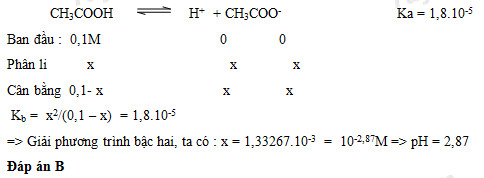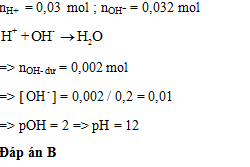20 bài tập vận dụng về tính pH có lời giải (phần 1)Làm bàiQuảng cáo
Câu hỏi 1 : Trộn 50ml dung dịch NaOH 0,1M với 50ml dung dịch HCl 0,1M. pH của dung dịch thu được sau phản ứng là:
Đáp án: C Phương pháp giải: So sánh số mol NaOH và HCl từ đó xác định pH của dung dịch thu được sau phản ứng. Lời giải chi tiết: Ta thấy: nNaOH = nHCl = 0,005 mol => NaOH phản ứng vừa đủ với HCl => Sau phản ứng thì dung dịch chỉ có NaCl => pH = 7 Đáp án C Câu hỏi 2 : Trộn 100ml dung dịch HCl 0,1M với V ml dung dịch Ba(OH)2 0,1M, sau phản ứng thu được dung dịch có pH = 12,7. Giá trị của V là:
Đáp án: B Phương pháp giải: pHsau = 12,7 > 7 => OH- dư Tính toán theo phương trình ion: H+ + OH- → H2O Lời giải chi tiết: nH+ = nHCl = 0,01 mol; nOH- = 2nBa(OH)2 = 0,2V mol pHsau = 12,7 > 7 => OH- dư => pOH = 14 - 12,7 = 1,3 => [OH-] = 10-1,3 H+ + OH- → H2O Bđ: 0,01 0,2V Pư: 0,01 → 0,01 Sau: 0 0,2V - 0,01 \(\left[ {O{H^ - }} \right] = \frac{{{n_{O{H^ - }}}}}{V} \to {10^{ - 1,3}} = \frac{{0,2V - 0,01}}{{0,1 + V}}\) => V = 0,1 lít Đáp án B Câu hỏi 3 : Cho dung dịch A chứa H2SO4 0,1M; HNO3 0,2M và HCl 0,3M. Trộn 300 ml dung dịch A với V lít dung dịch B gồm NaOH 0,2M và KOH 0,29M thu được dung dịch C có pH = 2. Giá trị của V là
Đáp án: D Phương pháp giải: Lời giải chi tiết: Trong A : nH+ = 2nH2SO4 + nHNO3 + nHCl = 2.0,1.0,3 + 0,2.0,3 + 0,3.0,3 = 0,21 mol Trong B : nOH- = nNaOH + nKOH = 0,2V + 0,29V = 0,49V mol Dung dịch sau khi trộn có pH = 2 => MT axit => H+ dư, OH- hết H+ + OH- → H2O Bđ: 0,21 0,49V Pư: 0,49V ← 0,49V Sau: 0,21 - 0,49V 0 pH = 2 => [H+] = 10-2 => \(\frac{{0,21 - 0,49V}}{{0,3 + V}} = {10^{ - 2}}\) => V = 0,414 lít = 414 ml Đáp án D Câu hỏi 4 : Hòa tan m gam Na vào nước được 100 ml dung dịch có pH = 13. Giá trị của m bằng
Đáp án: A Phương pháp giải: Lời giải chi tiết: pH = 13 => pOH = 1 => [OH-] = 0,1 M => nNaOH = 0,01 mol = nNa ( BT nguyên tố ) => m = 0,23g Đáp án A Câu hỏi 5 : Dung dịch X chứa hỗn hợp NaOH 0,25M và Ba(OH)2 0,15M dung dịch Y chứa hỗn hợp H2SO4 0,5M và HNO3 0,2M.Trộn V lít dung dịch X với V’ lit dung dịch Y thu được dung dịch Z có pH =3. Tỉ lệ V/V’ là
Đáp án: A Phương pháp giải: Lời giải chi tiết:
Câu hỏi 6 : Cho m gam hỗn hợp Mg, Al vào 250 ml dung dịch X chứa hỗn hợp axit HCl 1 M và axit H2SO4 0,5 M thu được 5,32 lít H2 (ở đktc) và dung dịch Y (coi thể tích dung dịch không đổi). Dung dịch Y có pH là:
Đáp án: A Phương pháp giải: Lời giải chi tiết:
Câu hỏi 7 : Trộn 100ml dung dịch (gồm Ba(OH)2 0,1M và NaOH 0,1M với 400 ml dung dịch (gồm H2SO4 0,0375 M và HCl 0,0125 M) thu được dung dịch X, giá trị pH của dung dịch X là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: \(\begin{gathered} Khi trộn xảy ra phản ứng trung hoà dạng ion là: H+ + OH-à H2O 0,035 0,03 nH+ (dư) = 0,035 - 0,03 = 0,005 (mol) => [H+] = 0,005/(0,1+0,4) = 0,01 [H+] = 0,01 = 10-2 (mol/lít) Þ pH = 2 Đáp án B Câu hỏi 8 : Trộn 200 ml dd hỗn hợp gồm HNO3 0,3M và HClO4 0,5M với 200 ml dd Ba(OH)2 a mol/lit thu được dd có pH = 3. Vậy a có giá trị là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Ta có: ∑nH+ = 0,2(0,3+ 0,5) = 0,16 mol; nOH- = 0,4.a Sau khi phản ứng xảy ra dung dịch thu được có pH= 3 chứng tỏ axit dư. [H+] sau phản ứng = (0,16-0,4a)/ 0,4 = 10-3 Vậy a = 0,399 Đáp án C Câu hỏi 9 : Thể tích của nước cần thêm vào 15 ml dung dịch axit HCl có pH=1 để được dung dịch axit có pH=3 là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Gọi thể tích nước cần thêm là Vml. Số mol H+ không đổi trước và sau pha loãng nên: 15.10-1 = (15+ V).10-3 V= 1485ml = 1,485 lít Đáp án D Câu hỏi 10 : Thêm 90 ml nước vào 10 ml dung dịch NaOH có pH=12 thì thu được dung dịch có pH là:
Đáp án: C Phương pháp giải: Lời giải chi tiết:
Câu hỏi 11 : Tính pH của dung dịch dd HCl 2.10-7M
Đáp án: B Phương pháp giải: Lời giải chi tiết: Ta thấy: Ca = 2.10-7 ≈ \(\sqrt {{K_{{H_2}O}}} = {10^{ - 7}}\)nên không thể bỏ qua sự phân li của H2O. HCl → H+ + Cl- 2.10-7→ 2.10-7 H2O \(\underset{{}}{\overset{{}}{\longleftrightarrow}}\) H+ + OH- KH2O = 10-14 Bđ: 2.10-7 Pli: x x x Sau: x + 2.10-7 x => KH2O = [H+][OH-] = (x + 2.10-7).x = 10-14 => x = 4,142.10-8 => [H+] = x + 2.10-7 = 4,142.10-8 + 2.10-7 = 2,4142.10-7 => pH = -log[H+] = 6,617 Đáp án B Câu hỏi 12 : Tính pH của dung dịch HNO2 0,2M biết Ka = 4.10--4
Đáp án: D Phương pháp giải: Các quá trình điện li của HNO2 \(\overset {} \leftrightarrows \) H+ + NO2- Ka = 4.10-4 H2O\(\overset {} \leftrightarrows \) H+ + OH- Kw = 10-14 Để tính pH của dung dịch thì ta phải đi tìm nồng độ H+ có trong dung dịch. Mà nồng độ H+ này có thể do HNO2 và H2O phân li ra. Để xét xem có bỏ qua sự điện li của H2O tạo ra H+ hay không ta so sánh tích số Ka.Ca với Kw Nếu Ka. Ca >> Kw thì bỏ qua sư điện li của H2O Nếu Ka. Ca ≈ Kw thì tính đến sự điện li của H2O Lời giải chi tiết: Các quá trình điện li: HNO2 \(\overset {} \leftrightarrows \) H+ + NO2- Ka = 4.10-4 H2O \(\overset {} \leftrightarrows \) H+ + OH- Kw = 10-14 Ta thấy: Ka.Ca = 0,2.4.10-4 = 8.10-5 > > Kw = 10-14. Do vậy sự phân li của H2O tạo ra H+ là không đáng kể. Vì vậy bỏ qua sự điện li của H2O. Dung dịch chỉ có sự điện li của HNO2 HNO2 \(\overset {} \leftrightarrows \) H+ + NO2- Ka = 4.10-4 ban đầu: 0,2 phân li: x x x cân bằng: (0,2 - x) x x Ta có:\(Ka = {{{\rm{[}}{H^ + }{\rm{]}}.{\rm{[}}N{O_2}^ - {\rm{]}}} \over {{\rm{[}}HN{O_2}]}} = {{{x^2}} \over {0,2 - x}} = {4.10^{ - 4}}(*)\) Cách 1: Giải phương trình bậc 2 → x2 + 4.10-4x - 0,2.4.10-4 = 0 → x = 8,7465.10-3 (M) → [H+] = x = 8,7465.10-3 (M) → pH = -lg[H+] = -lg(8,7465.10-3) = 2,058 Cách 2: Ta thấy \({{Ca} \over {Ka}} = {{0,2} \over {{{4.10}^{ - 4}}}} = 500\) (Chỉ cần Ca lớn gấp 100 lần Ka là coi như x rất nhỏ) → x << 0,2 → coi 0,2 - x ≈ 0,2 Từ phương trình (*) →\({{{x^2}} \over {0,2}} = {4.10^{ - 4}} \Rightarrow x = \sqrt {0,{{2.4.10}^{ - 4}}} = 8,{944.10^{ - 3}}(M)\) → [H+] = x = 8,944.10-3 (M) → pH = -lg[H+] = -lg(8,944.10-3) = 2,048 ≈ 2,05 Đáp án D Câu hỏi 13 : Tính pH của 400 ml dung dịch (gồm H2SO4 0,025 M và HCl 0,05 M) ?
Đáp án: A Phương pháp giải: Lời giải chi tiết:
Câu hỏi 14 : Tính pH của dung dịch CH3COOH 0,1M biết Ka = 1,8.10-5 ?
Đáp án: B Phương pháp giải: Lời giải chi tiết:
Câu hỏi 15 : Trộn V1 lít dung dịch HCl (pH = 5) với V2 lít dung dịch NaOH (pH = 9)thu được dung dịch có pH = 8. Tỉ lệ V1/ V2 là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: pH của HCl = 5 => [HCl]= 10-5 => nHCl = CM. V1 = 10-5V1 pH của NaOH = 9 => pOH = 14 – 9 = 5 => [NaOH]= 10-5 => nNaOH = CM.V2= 10-5.V2 Vì dd sau phản ứng thu được có pH = 8 > 7 => môi trường bazo => dư OH- => pOH = 14 – 8 = 6 => [NaOH] dư = 10-6 H+ + OH- → H2O Ban đầu(mol) 10-5V1 10-5.V2 Phản ứng (mol) 10-5V1 10-5V1 Sau pư (mol) 0 10-6(V1+ V2) Ta có: nOH- ban đầu = nOH- pư + nOH- dư => 10-5.V2 = 10-5V1 + 10-6(V1+ V2) => 10-5.V2 – 10-6V2 = 10-5V1 + 10-6V1 => 9.10-6V2 = 1,1.10-5V1 \( = > \frac{{{V_1}}}{{{V_2}}} = \frac{{{{9.10}^{ - 6}}}}{{1,{{1.10}^{ - 5}}}} = \frac{9}{{11}}\) Đáp án C Câu hỏi 16 : Trộn lẫn 50 ml dung dịch HCl 0,12M với 50 ml dung dịch NaOH 0,1M. Vậy pH của dung dịch thu được bằng bao nhiêu?
Đáp án: A Phương pháp giải: Lời giải chi tiết: nH+ = 6.10-3 mol ; nOH- = 5.10-3 mol H+ + OH- → H2O Bđ: 6.10-3 5.10-3 (mol) Pư: 5.10-3 ← 5.10-3 (mol) Sau: 10-3 0 (mol) Mà V dd sau pư = 50 + 50 = 100 ml = 0,1 lít => [H+] = 10-3 : 0,1 = 10-2M => pH = 2 Đáp án A Câu hỏi 17 : Cho 40 ml dung dịch HCl 0,75M vào 160 ml dung dịch chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M. pH của dung dịch thu được:
Đáp án: B Phương pháp giải: Lời giải chi tiết:
Câu hỏi 18 : Dung dịch axit fomic HCOOH 0,007 M có độ điện li = 0,1. Tính pH của dung dịch HCOOH:
Đáp án: A Phương pháp giải: Lời giải chi tiết:
Câu hỏi 19 : Dung dịch NaOH 0,001M có giá trị pH là:
Đáp án: C Phương pháp giải: Tính pOH = -log[OH-] => pH = 14 - pOH Lời giải chi tiết: NaOH là chất điện li mạnh => [OH-] = CM NaOH = 0,001M => pOH = -log[OH-] = -log(0,001) = 3 => pH = 14 - pOH = 14 - 3 = 11 Đáp án C Câu hỏi 20 : Cho 100 ml dung dịch X chứa: 0,07 mol Na+; 0,02 mol SO42- và x mol OH-. 100 ml dung dịch Y có chứa y mol H+, Cl-, NO3- và 0,01 mol Na+ (tổng số mol Cl- và NO3- là 0,042). Trộn 100 ml dung dịch X với 100 ml dung dịch Y thu được dung dịch Z. Dung dịch Z có pH là
Đáp án: B Phương pháp giải: Bảo toàn điện tích. Lời giải chi tiết: - Bảo toàn điện tích cho dung dịch X: nOH- = nNa+ - 2nSO42- = 0,07 - 2.0,02 = 0,03 mol - Bảo toàn điện tích cho dung dịch Y: nH+ = (nCl- + nNO3-) - nNa+ = 0,042 - 0,01 = 0,032 mol Khi trộn 100 ml X với 100 ml Y có phản ứng: H+ + OH- → H2O => nH+ dư = nH+ - nOH- = 0,032 - 0,03 = 0,002 mol => [H+] = \(\frac{{{n_{{H^ + }}}}}{{{V_{{\rm{dd}}\,sau\,pu}}}}\) = \(\frac{{0,002}}{{0,1 + 0,1}}\) = 0,01M => pH = -log[H+] = 2 Đáp án B Quảng cáo
|