Đề tham khảo thi THPT môn Hóa - Đề số 1 (hay, chi tiết)Cho phản ứng oxi hóa – khử:Đề bài
Phần 1. Trắc nghiệm nhiều đáp án lựa chọn
Câu 1 :
Cho phản ứng oxi hóa – khử: SO2 + Br2 + 2H2O → 2HBr + H2SO4. Chất đóng vai trò chất khử là:
Câu 2 :
Thành phần chính của soda là Na2CO3. Tên của hợp chất này là
Câu 3 :
Tơ nitron dai, bền với nhiệt và giữ nhiệt tốt, thường được dùng để dệt vải may quần áo hoặc bện thành sợi len đan áo rét. Tơ nitron được điều chế bằng phản ứng trùng hợp chất nào sau đây?
Câu 4 :
Trong định nghĩa về liên kết kim loại: “ Liên kết kim loại là liên kết hình thành do lực hút tĩnh điện giữa các electron …(1)… với các ion …(2)… kim loại ở các nút mạng. Các từ cần điện vào vị trí (1), (2) lần lượt là
Câu 5 :
Cấu hình electron của ion R+ là 1s22s22p63s23p6. Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố R thuộc
Câu 6 :
Hai chất nào sau đây được dùng để làm mềm nước có tính cứng vĩnh cửu?
Câu 7 :
Phản ứng xảy ra với tốc độ rất lớn kèm theo sự tăng thể tích đột ngột và tỏa nhiệt lượng lớn là phản ứng
Câu 8 :
Trong phân tử chất nào sau đây có 2 nhóm amino (NH2) và 1 nhóm carboxyl (COOH)?
Câu 10 :
Ester X có mùi đặc trưng giống mùi táo và có công thức phân tử C5H10O2. Thủy phân X trong dung dịch NaOH, thu được sodium butanoate và một alcohol. Công thức của X là
Câu 11 :
Hợp chất CH3 – NH – CH2 – CH3 có tên thay thế là
Câu 12 :
Chất nào sau đây thuộc loại polysaccharide?
Câu 13 :
Nhóm những kim loại có độ dẫn điện tốt nhất là
Câu 14 :
Tên gọi của ester CH3COOC6H5 là
Câu 15 :
Nhóm peptide có cấu tạo là
Câu 16 :
Kết quả phân tích nguyên tố của một amino acid X như sau: %C = 46,60%; %H = 8,74%; %N = 13,59% (về khối lượng); còn lại là oxygen. Bằng phổ khối lượng (MS), xác định được phân tử khối của X là 103. Phát biểu nào sau đây là không đúng?
Sử dụng thông tin ở bảng dưới đây để trả lời các câu hỏi 17 - 18 Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
Câu 17
Trong số các ion kim loại trên, ở điều kiện chuẩn ion nào có tính oxi hóa mạnh nhất?
Câu 18
Sức điện động chuẩn lớn nhất của pin Galvani thiết lập từ hai cặp oxi hóa - khử trong số các cặp trên là
Phần 2. Câu hỏi đúng, sai
Câu 1 :
Tinh luyện bạc (Ag) bằng phương pháp điện phân được tiến hành như sau: - Các khối bạc có độ tinh khiết thấp được gắn với cực dương của nguồn điện - Các tấm bạc mỏng có độ tinh khiết cao được gắn với cực âm của nguồn điện. Dung dịch điện phân là dung dịch AgNO3. a) Tại anode chủ yếu xảy ra quá trình oxi hóa H2O thành khí O2 và H+
Đúng
Sai
b) Nồng độ ion Ag+ trong dung dịch không đổi trong quá trình điện phân
Đúng
Sai
c) Khi kết thúc quá trình điện phân, môi trường dung dịch có pH = 7
Đúng
Sai
d) Biết rằng lượng bạc sinh ra trong quá trình điện phân có thể dùng để mạ bạc lên các đồ vật dùng làm trang sức. Để mạ 5,0 g bạc lên một vòng tay bằng đồng khi điện phân dung dịch chứa ion [Ag(NH3)2]+ với dòng điện có cường độ 1,5 A không đổi cần thời gian là khoảng 2 giờ. Cho biết: - Quá trình khử tại cathode: [Ag(NH3)2]+ + le \( \to \) Ag + 2NH3. - Điện lượng q = It = ne.F, F = 96 500 C/mol.
Đúng
Sai
Câu 2 :
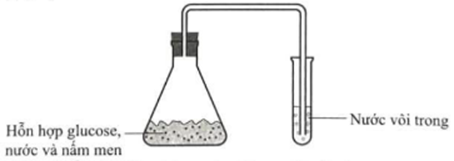
Trong quá trình sản xuất rượu vang, người ta sử dụng nấm men Saccharomyces cerevisiae để lên men glucose và fructose (cố trong dịch ép trái nho) tạo thành ethanol. Một học sinh thực hiện thí nghiệm thử tính chất của sản phẩm từ quá trình lên men này trong phòng thí nghiệm bằng dụng cụ như ở bên dưới
a) Sau thí nghiệm thì ống nghiệm chứa nước vôi trong bị vẩn đục
Đúng
Sai
b) Khí sinh ra trong quá trình lên men này là carbon dioxide.
Đúng
Sai
c) Nếu thay nấm men bằng sữa chua lên men thì hiện tượng thí nghiệm vẫn xảy ra tương tự
Đúng
Sai
d) Sau thí nghiệm thì trong bình tam giác có chứa X là thành phần của xăng E5.
Đúng
Sai
Câu 3 :
Tinh bột là polymer thiên nhiên gồm amylose và amylopectin. Tinh bột có công thức phân tử là (C6H10O5)n. Một học sinh tiến hành thí nghiệm đối với tinh bột theo các bước sau: Bước 1: Cho khoảng 5 mL dung dịch hồ tinh bột vào ống nghiệm. Sau đó thêm khoảng 1 mL dung dịch HCl 1 M vào, lắc đều. Bước 2: Đặt ống nghiệm trong một cốc thuỷ tinh chứa nước nóng, đun cách thuỷ trong 10 phút. Sau đó để nguội. Bước 3: Thêm từ từ sodium hydrogencarbonate vào ống nghiệm đến khi ngừng sủi bọt khí. Bước 4: Cho khoảng 2 mL dung dịch thu được vào ống nghiệm chứa copper (II) hydroxide (được điều chế bằng cách cho 0,5mL dung dịch copper (II) sulfate vào 2 mL dung dịch sodium hydroxide, lắc nhẹ). Sau đó đặt ống nghiệm trong cốc thuỷ tinh chứa nước nóng khoảng 5 phút. a) Sau bước 1, thu được hai loại monosaccharide.
Đúng
Sai
b) Trong bước 2 đã xảy ra phản ứng thủy phân tinh bột tạo glucose.
Đúng
Sai
c) Trong bước 3, sodium hydrogencarbonate được thêm vào nhằm mục đích làm tăng tốc độ phản ứng thủy phân ở bước 2.
Đúng
Sai
d) Sau bước 4, thu được dung dịch màu xanh lam.
Đúng
Sai
Câu 4 :
Muối Mohr có công thức (NH4)2Fe(SO4)2.6H2O. Để xác định độ tinh khiết của một loại muối Mohr (cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 mL dung dịch X. Lấy chính xác 10 mL dung dịch X, thêm 10 mL dung dịch H2SO4 10%, được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn KMnO4 0,023M. Thực hiện chuẩn độ 3 lần. Kết quả đạt được như sau:
a) Dung dịch H2SO4 được thêm vào dung dịch chuẩn độ để tạo thành môi trường acid, giúp phản ứng xảy ra theo hướng tạo thành Mn2+.
Đúng
Sai
b) Có thể thay dung dịch H2SO4 bằng dung dịch acid mạnh như HCl, HNO3 nhưng phải đảm bảo lượng H+ dư sau phản ứng.
Đúng
Sai
c) Trong mỗi lần chuẩn độ, dung dịch KMnO4 được xem là phản ứng vừa đủ với muối Mohr (điểm dừng) khi giọt dung dịch KMnO4 cuối cùng nhỏ vào dung dịch Y không mất màu.
Đúng
Sai
d) Theo kết quả chuẩn độ ở trên, trong số các giá trị: 93,32; 98,45; 97,36; 99,87 độ tinh khiết (% khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr có giá trị gần nhất với 98,45.
Đúng
Sai
Phần 3. Trả lời ngắn
Câu 1 :
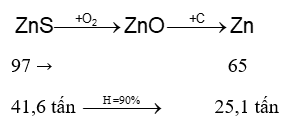
Một nhà máy luyện kim sản xuất Zn từ 52 tấn quặng sphalerite (chứa 80% ZnS về khối lượng, còn lại là tạp chất không chứa kẽm (zinc)) với hiệu suất cả quá trình đạt 90% theo sơ đồ:
Toàn bộ lượng kẽm (zinc) tạo ra được đúc thành k tấm kẽm (zinc) hình hộp chữ nhật; chiều dài 600 cm, chiều rộng 150 cm và chiều cao 1 cm. Biết khối lượng riêng của kẽm là 7,14 g/cm3. Giá trị của k là bao nhiêu? Đáp án:
Câu 2 :
Đun nóng một loại dầu dừa với dung dịch NaOH, sản phẩm thu được có chứa muối sodium panmitate (C15H31COONa). Phân tử khối của sodium panmitate là bao nhiêu? Đáp án:
Câu 3 :
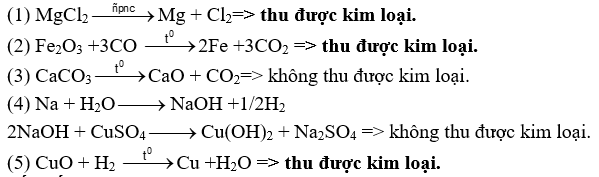
Tiến hành các thí nghiệm sau: (1) Điện phân MgCl2 nóng chảy. (2) Cho CO qua Fe2O3 đun nóng (3) Nhiệt phân hoàn toàn CaCO3. (4) Cho kim loại Na vào dung dịch CuSO4 dư. (5) Dẫn khí H2 dư đi qua bột CuO nung nóng. Sau khi các phản ứng kết thúc, các thí nghiệm thu được kim loại được sắp xếp theo trình tự từ nhỏ đến lớn là bao nhiêu? Đáp án:
Câu 4 :
Cho các chất: saccharose, glucose, fructose, ethyl formate, formic acid và acetic aldehyde. Trong các chất trên, số chất vừa có khả năng tham gia phản ứng tráng bạc vừa có khả năng phản ứng với Cu(OH)2 ở điều kiện thường là? Đáp án:
Câu 5 :
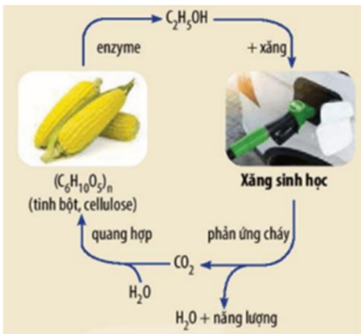
Từ tinh bột (có trong các loại ngũ cốc như ngô, lúa mì, đậu tương,…) có thể chuyển hóa thành ethanol dùng để phối trộn với xăng thông thường theo một tỉ lệ nhất định tạo ra xăng sinh học như: xăng E5RON92 (gồm 5% ethanol và 95% xăng RON 92 về thể tích), xăng E10RON92 (gồm 10% ethanol và 90% xăng RON 92 về thể tích). Việc sử dụng ethanol trong xăng sinh học diễn ra theo chu trình khép kín giúp giảm thải khí độc thoát ra ngoài, góp phần bảo vệ môi trường.
Tính độ giảm (%) phát thải khí nhà kính đối với một động cơ đốt trong sử dụng xăng sinh học E5RON92 so với việc động cơ ấy sử dụng xăng truyền thống RON92. Giả thiết: xăng RON92 là hỗn hợp isooctane và heptane với tỉ lệ tương ứng 92:8 về thể tích; quá trình đốt cháy các nhiên liệu trong động cơ đốt trong là hoàn toàn, sinh ra nước và carbon dioxde. Khối lượng riêng của ethanol, isooctane và heptane lần lượt là 0,8g/ml, 0,688 g/ml và 0,684 g/ml. Đáp án:
Câu 6 :
Ion Ca+2 cần thiết cho máu của người hoạt động bình thường. Nồng độ ion calcium không bình thường là dấu hiệu của bệnh. Để xác định nồng độ ion calcium, người ta lấy mẫu máu, sau đó kết tủa ion calcium dưới dạng calcium oxalate (CaC2O4) rồi cho calcium oxalate tác dụng với dung dịch potassium permanganate trong môi trường acid theo phản ứng sau: KMnO4 + CaC2O4 + H2SO4 → CaSO4 + K2SO4 + MnSO4 + CO2 + H2O Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 2,05 mL dung dịch potassium permanganate (KMnO4) 4,88.10-4M. Xác định nồng độ ion calcium trong máu người đó bằng đơn vị mg Ca+2/100 mL máu. Đáp án: Lời giải và đáp án
Phần 1. Trắc nghiệm nhiều đáp án lựa chọn
Câu 1 :
Cho phản ứng oxi hóa – khử: SO2 + Br2 + 2H2O → 2HBr + H2SO4. Chất đóng vai trò chất khử là:
Đáp án : A Phương pháp giải :
Chất khử là chất nhường electron. Lời giải chi tiết :
SO2 đóng vai trò là chất khử vì: S+4 → S+6 + 2e Đáp án A
Câu 2 :
Thành phần chính của soda là Na2CO3. Tên của hợp chất này là
Đáp án : B Phương pháp giải :
Dựa vào một số hợp chất thông dụng của nguyên tố nhóm IA Lời giải chi tiết :
Na2CO3: sodium carbonate Đáp án B
Câu 3 :
Tơ nitron dai, bền với nhiệt và giữ nhiệt tốt, thường được dùng để dệt vải may quần áo hoặc bện thành sợi len đan áo rét. Tơ nitron được điều chế bằng phản ứng trùng hợp chất nào sau đây?
Đáp án : B Phương pháp giải :
Dựa vào một số loại tơ thông dụng. Lời giải chi tiết :
Tơ nitron có công thức (- CH2 – C(CH) -)n được điều chế bằng phản ứng trùng hợp CH2=CHCN Đáp án B
Câu 4 :
Trong định nghĩa về liên kết kim loại: “ Liên kết kim loại là liên kết hình thành do lực hút tĩnh điện giữa các electron …(1)… với các ion …(2)… kim loại ở các nút mạng. Các từ cần điện vào vị trí (1), (2) lần lượt là
Đáp án : B Phương pháp giải :
Dựa vào khái niệm liên kết kim loại. Lời giải chi tiết :
Liên kết kim loại là liên kết hình thành do lực hút tĩnh điện giữa các electron tự do với các ion dương kim loại ở các nút mạng. Đáp án B
Câu 5 :
Cấu hình electron của ion R+ là 1s22s22p63s23p6. Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố R thuộc
Đáp án : A Phương pháp giải :
Từ cấu hình electron của ion R+ sau đó viết cấu hình electron của R. Lời giải chi tiết :
Cấu hình electron của R là: 1s22s22p63s23p64s1 Trong bảng tuần hoàn, nguyên tố R thuộc nhóm IA, chu kì 4 Đáp án A
Câu 6 :
Hai chất nào sau đây được dùng để làm mềm nước có tính cứng vĩnh cửu?
Đáp án : B Phương pháp giải :
Dựa vào phương pháp làm mềm nước cứng. Lời giải chi tiết :
Nước cứng vĩnh cửu chứa ion Cl-; SO42-; Ca2+ và Mg2+ Có thể dùng Na2CO3 và Na3PO4 để làm mềm nước vĩnh cửu vì Ca2+ và Mg2+ tạo kết tủa với CO32- và PO43- Đáp án B
Câu 7 :
Phản ứng xảy ra với tốc độ rất lớn kèm theo sự tăng thể tích đột ngột và tỏa nhiệt lượng lớn là phản ứng
Đáp án : D Phương pháp giải :
Dựa vào các loại phản ứng. Lời giải chi tiết :
Phản ứng xảy ra với tốc độ rất lớn kèm theo sự tăng thể tích đột ngột và tỏa nhiệt lượng lớn là phản ứng nổ. Đáp án D
Câu 8 :
Trong phân tử chất nào sau đây có 2 nhóm amino (NH2) và 1 nhóm carboxyl (COOH)?
Đáp án : D Phương pháp giải :
Dựa vào các loại amino acid thông dụng. Lời giải chi tiết :
Trong phân tử lysine có 2 nhóm (NH2) và 1 nhóm carboxyl (COOH) Đáp án D
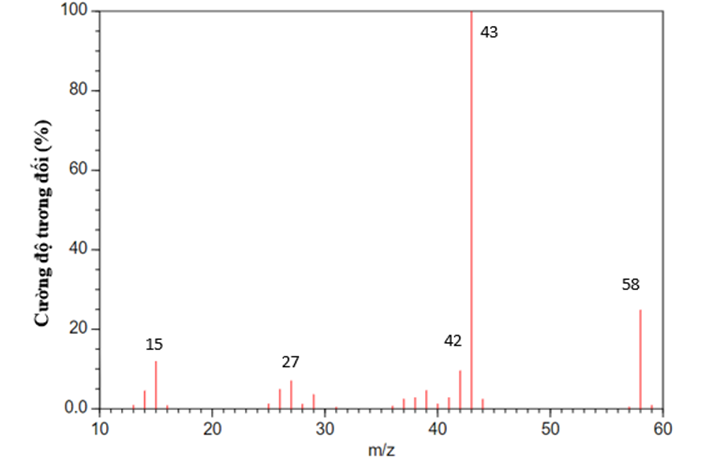
Đáp án : A Phương pháp giải :
Dựa vào phổ khối lượng MS Lời giải chi tiết :
Hợp chất hữu cơ A có phân tử khối là 58 amu. Vậy A có thể là acetone. Đáp án A
Câu 10 :
Ester X có mùi đặc trưng giống mùi táo và có công thức phân tử C5H10O2. Thủy phân X trong dung dịch NaOH, thu được sodium butanoate và một alcohol. Công thức của X là
Đáp án : C Phương pháp giải :
Dựa vào cấu tạo của ester. Lời giải chi tiết :
Khi thủy phân X trong dung dịch NaOH thu được sodium butanoate nên gốc RCOO- là CH3CH2CH2COO- Vậy gốc R’ là – CH3 Công thức X là CH3CH2CH2COOCH3 Đáp án C
Câu 11 :
Hợp chất CH3 – NH – CH2 – CH3 có tên thay thế là
Đáp án : C Phương pháp giải :
Dựa vào cách đọc tên của amine bậc hai: N – tên gốc hydrocarbon + tên hydrocarbon + amine Lời giải chi tiết :
CH3 – NH – CH2 – CH3 có tên thay thế là: N – methyethanamine Đáp án C
Câu 12 :
Chất nào sau đây thuộc loại polysaccharide?
Đáp án : C Phương pháp giải :
Dựa vào phân loại carbohydrate. Lời giải chi tiết :
Polysaccharide gồm tinh bột và cellulose. Đáp án C
Câu 13 :
Nhóm những kim loại có độ dẫn điện tốt nhất là
Đáp án : B Phương pháp giải :
Dựa vào tính chất vật lí của kim loại. Lời giải chi tiết :
Ag, Cu, Al có tính dẫn điện tốt nhất. Đáp án B
Câu 14 :
Tên gọi của ester CH3COOC6H5 là
Đáp án : B Phương pháp giải :
Dựa vào tên gọi của ester: tên gốc R’ + tên gốc acid RCOO- Lời giải chi tiết :
CH3COOC6H5: phenyl acetate Đáp án B
Câu 15 :
Nhóm peptide có cấu tạo là
Đáp án : B Phương pháp giải :
Dựa vào khái niệm của peptide Lời giải chi tiết :
Liên kết petide có công thức – CO – NH – Đáp án B
Câu 16 :
Kết quả phân tích nguyên tố của một amino acid X như sau: %C = 46,60%; %H = 8,74%; %N = 13,59% (về khối lượng); còn lại là oxygen. Bằng phổ khối lượng (MS), xác định được phân tử khối của X là 103. Phát biểu nào sau đây là không đúng?
Đáp án : D Phương pháp giải :
Xác định công thức của X dựa vào thành phần % các nguyên tố. Lời giải chi tiết :
Số nguyên tử C = \(\frac{{46,60\% .103}}{{12}} = 4\) Số nguyên tử H = \(\frac{{103.8,74\% }}{1} = 9\) Số nguyên tử N = \(\frac{{13,59\% .103}}{{14}} = 1\) Số nguyên tử O = \(\frac{{103.31,07\% }}{{16}} = 2\) Công thức phân tử X là: C4H9NO2 Vì X là một amino acid nên công thức cấu tạo α – amino acid của X là:
D sai, vì khi đặt X vào pH = 6,0 hầu như X không di chuyển. Đáp án D Sử dụng thông tin ở bảng dưới đây để trả lời các câu hỏi 17 - 18 Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
Câu 17
Trong số các ion kim loại trên, ở điều kiện chuẩn ion nào có tính oxi hóa mạnh nhất?
Đáp án : D Phương pháp giải :
Dựa vào ý nghĩa thế điện cực chuẩn của kim loại. Lời giải chi tiết :
Cặp oxi hóa – khử Ag+/Ag có giá trị lớn nhất nên Ag+ có tính oxi hóa mạnh nhất Đáp án D Câu 18
Sức điện động chuẩn lớn nhất của pin Galvani thiết lập từ hai cặp oxi hóa - khử trong số các cặp trên là
Đáp án : B Phương pháp giải :
Để tạo ra pin có sức điện động chuẩn lớn nhất tạo bởi từ 2 cực có tính khử và tính oxi hóa mạnh nhất Lời giải chi tiết :
Pin Galvani Zn – Ag có sức điện động lớn nhất = 0,8 – (-0,76) = 1,56V Đáp án B
Phần 2. Câu hỏi đúng, sai
Câu 1 :
Tinh luyện bạc (Ag) bằng phương pháp điện phân được tiến hành như sau: - Các khối bạc có độ tinh khiết thấp được gắn với cực dương của nguồn điện - Các tấm bạc mỏng có độ tinh khiết cao được gắn với cực âm của nguồn điện. Dung dịch điện phân là dung dịch AgNO3. a) Tại anode chủ yếu xảy ra quá trình oxi hóa H2O thành khí O2 và H+
Đúng
Sai
b) Nồng độ ion Ag+ trong dung dịch không đổi trong quá trình điện phân
Đúng
Sai
c) Khi kết thúc quá trình điện phân, môi trường dung dịch có pH = 7
Đúng
Sai
d) Biết rằng lượng bạc sinh ra trong quá trình điện phân có thể dùng để mạ bạc lên các đồ vật dùng làm trang sức. Để mạ 5,0 g bạc lên một vòng tay bằng đồng khi điện phân dung dịch chứa ion [Ag(NH3)2]+ với dòng điện có cường độ 1,5 A không đổi cần thời gian là khoảng 2 giờ. Cho biết: - Quá trình khử tại cathode: [Ag(NH3)2]+ + le \( \to \) Ag + 2NH3. - Điện lượng q = It = ne.F, F = 96 500 C/mol.
Đúng
Sai
Đáp án
a) Tại anode chủ yếu xảy ra quá trình oxi hóa H2O thành khí O2 và H+
Đúng
Sai
b) Nồng độ ion Ag+ trong dung dịch không đổi trong quá trình điện phân
Đúng
Sai
c) Khi kết thúc quá trình điện phân, môi trường dung dịch có pH = 7
Đúng
Sai
d) Biết rằng lượng bạc sinh ra trong quá trình điện phân có thể dùng để mạ bạc lên các đồ vật dùng làm trang sức. Để mạ 5,0 g bạc lên một vòng tay bằng đồng khi điện phân dung dịch chứa ion [Ag(NH3)2]+ với dòng điện có cường độ 1,5 A không đổi cần thời gian là khoảng 2 giờ. Cho biết: - Quá trình khử tại cathode: [Ag(NH3)2]+ + le \( \to \) Ag + 2NH3. - Điện lượng q = It = ne.F, F = 96 500 C/mol.
Đúng
Sai
Phương pháp giải :
Dựa vào ứng dụng của phương pháp điện phân. Lời giải chi tiết :
a. đúng, vì ion NO3- không bị điện phân nên tại anode xảy ra quá trình oxi hóa H2O thành O2 và H+ b. sai, nồng độ ion Ag+ bị giảm dần trong quá trình điện phân Ag+ → Ag c. sai, khi kết thúc quá trình điện phân, môi trường dung dịch có pH < 7 do bên anode tạo ra ion H+ d. sai vì nAg = \(\frac{5}{{108}}mol\) t = \(\frac{{ne.F}}{I} = \frac{{\frac{5}{{108}}.96500}}{{1,5}} = 2978,4s = 0,8h\)
Câu 2 :
Trong quá trình sản xuất rượu vang, người ta sử dụng nấm men Saccharomyces cerevisiae để lên men glucose và fructose (cố trong dịch ép trái nho) tạo thành ethanol. Một học sinh thực hiện thí nghiệm thử tính chất của sản phẩm từ quá trình lên men này trong phòng thí nghiệm bằng dụng cụ như ở bên dưới
a) Sau thí nghiệm thì ống nghiệm chứa nước vôi trong bị vẩn đục
Đúng
Sai
b) Khí sinh ra trong quá trình lên men này là carbon dioxide.
Đúng
Sai
c) Nếu thay nấm men bằng sữa chua lên men thì hiện tượng thí nghiệm vẫn xảy ra tương tự
Đúng
Sai
d) Sau thí nghiệm thì trong bình tam giác có chứa X là thành phần của xăng E5.
Đúng
Sai
Đáp án
a) Sau thí nghiệm thì ống nghiệm chứa nước vôi trong bị vẩn đục
Đúng
Sai
b) Khí sinh ra trong quá trình lên men này là carbon dioxide.
Đúng
Sai
c) Nếu thay nấm men bằng sữa chua lên men thì hiện tượng thí nghiệm vẫn xảy ra tương tự
Đúng
Sai
d) Sau thí nghiệm thì trong bình tam giác có chứa X là thành phần của xăng E5.
Đúng
Sai
Phương pháp giải :
Dựa vào quá trình lên men glucose Lời giải chi tiết :
a. đúng vì quá trình lên men glucose tạo ethanol và carbon dioxide làm ống nghiệm chứa vôi trong bị vẩn đục. b. đúng c. sai, vì nếu dùng sữa chua sản phẩm thu được sẽ là acid lactic d. đúng vì lên men tạo ethanol.
Câu 3 :
Tinh bột là polymer thiên nhiên gồm amylose và amylopectin. Tinh bột có công thức phân tử là (C6H10O5)n. Một học sinh tiến hành thí nghiệm đối với tinh bột theo các bước sau: Bước 1: Cho khoảng 5 mL dung dịch hồ tinh bột vào ống nghiệm. Sau đó thêm khoảng 1 mL dung dịch HCl 1 M vào, lắc đều. Bước 2: Đặt ống nghiệm trong một cốc thuỷ tinh chứa nước nóng, đun cách thuỷ trong 10 phút. Sau đó để nguội. Bước 3: Thêm từ từ sodium hydrogencarbonate vào ống nghiệm đến khi ngừng sủi bọt khí. Bước 4: Cho khoảng 2 mL dung dịch thu được vào ống nghiệm chứa copper (II) hydroxide (được điều chế bằng cách cho 0,5mL dung dịch copper (II) sulfate vào 2 mL dung dịch sodium hydroxide, lắc nhẹ). Sau đó đặt ống nghiệm trong cốc thuỷ tinh chứa nước nóng khoảng 5 phút. a) Sau bước 1, thu được hai loại monosaccharide.
Đúng
Sai
b) Trong bước 2 đã xảy ra phản ứng thủy phân tinh bột tạo glucose.
Đúng
Sai
c) Trong bước 3, sodium hydrogencarbonate được thêm vào nhằm mục đích làm tăng tốc độ phản ứng thủy phân ở bước 2.
Đúng
Sai
d) Sau bước 4, thu được dung dịch màu xanh lam.
Đúng
Sai
Đáp án
a) Sau bước 1, thu được hai loại monosaccharide.
Đúng
Sai
b) Trong bước 2 đã xảy ra phản ứng thủy phân tinh bột tạo glucose.
Đúng
Sai
c) Trong bước 3, sodium hydrogencarbonate được thêm vào nhằm mục đích làm tăng tốc độ phản ứng thủy phân ở bước 2.
Đúng
Sai
d) Sau bước 4, thu được dung dịch màu xanh lam.
Đúng
Sai
Phương pháp giải :
Dựa vào tính chất hóa học của tinh bột. Lời giải chi tiết :
a) Sai, sau bước 1 chưa xảy ra phản ứng thủy phân. Sau bước 2, thu được 1 loại monosaccharide là glucose. b) Đúng: (C6H10O5)n + nH2O → nC6H12O6 c) Sai, NaHCO3 dùng để trung hòa chất xúc tác HCl. d) Sai, sau bước 4, thu được kết tủa đỏ gạch (Cu2O).
Câu 4 :
Muối Mohr có công thức (NH4)2Fe(SO4)2.6H2O. Để xác định độ tinh khiết của một loại muối Mohr (cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 mL dung dịch X. Lấy chính xác 10 mL dung dịch X, thêm 10 mL dung dịch H2SO4 10%, được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn KMnO4 0,023M. Thực hiện chuẩn độ 3 lần. Kết quả đạt được như sau:
a) Dung dịch H2SO4 được thêm vào dung dịch chuẩn độ để tạo thành môi trường acid, giúp phản ứng xảy ra theo hướng tạo thành Mn2+.
Đúng
Sai
b) Có thể thay dung dịch H2SO4 bằng dung dịch acid mạnh như HCl, HNO3 nhưng phải đảm bảo lượng H+ dư sau phản ứng.
Đúng
Sai
c) Trong mỗi lần chuẩn độ, dung dịch KMnO4 được xem là phản ứng vừa đủ với muối Mohr (điểm dừng) khi giọt dung dịch KMnO4 cuối cùng nhỏ vào dung dịch Y không mất màu.
Đúng
Sai
d) Theo kết quả chuẩn độ ở trên, trong số các giá trị: 93,32; 98,45; 97,36; 99,87 độ tinh khiết (% khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr có giá trị gần nhất với 98,45.
Đúng
Sai
Đáp án
a) Dung dịch H2SO4 được thêm vào dung dịch chuẩn độ để tạo thành môi trường acid, giúp phản ứng xảy ra theo hướng tạo thành Mn2+.
Đúng
Sai
b) Có thể thay dung dịch H2SO4 bằng dung dịch acid mạnh như HCl, HNO3 nhưng phải đảm bảo lượng H+ dư sau phản ứng.
Đúng
Sai
c) Trong mỗi lần chuẩn độ, dung dịch KMnO4 được xem là phản ứng vừa đủ với muối Mohr (điểm dừng) khi giọt dung dịch KMnO4 cuối cùng nhỏ vào dung dịch Y không mất màu.
Đúng
Sai
d) Theo kết quả chuẩn độ ở trên, trong số các giá trị: 93,32; 98,45; 97,36; 99,87 độ tinh khiết (% khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr có giá trị gần nhất với 98,45.
Đúng
Sai
Phương pháp giải :
Dựa vào phương pháp chuẩn độ muối sắt (II). Lời giải chi tiết :
a. Đúng, \(MnO_4^ - \) (tím) bị khử thành Mn2+ (không màu) trong môi trường acid giúp người chuẩn độ nhận biết điểm dừng. b. Sai, nếu thay bằng HCl thì Cl- khử\(MnO_4^ - \)/H+ nếu thay bằng HNO3 thì \(NO_3^ - \)/H+ oxi hóa Fe2+ làm ảnh hưởng đến kết quả chuẩn độ. c. Đúng, giọt dung dịch KMnO4 cuối cùng không bị mất màu chứng tỏ Fe2+ trong dung dịch đã hết. d. Sai, độ tinh khiết gần nhất với 99,87%. V trung bình = \(\frac{{16 + 16,1 + 16}}{3} = 16,0333mL\)→ n KMnO4 = 3,6877.10-4 mol Phản ứng chuẩn độ: 5Fe2+ + 8H+ + \(MnO_4^ - \)→ 5Fe3+ + Mn2+ + 4H2O => nFe2+ = 5. n\(MnO_4^ - \)=1,8439.10-3 => %(NH4)2Fe(SO4)2.6H2O = (10.1,8439.10-3.392): 7,237 = 99,8769%
Phần 3. Trả lời ngắn
Câu 1 :
Một nhà máy luyện kim sản xuất Zn từ 52 tấn quặng sphalerite (chứa 80% ZnS về khối lượng, còn lại là tạp chất không chứa kẽm (zinc)) với hiệu suất cả quá trình đạt 90% theo sơ đồ:
Toàn bộ lượng kẽm (zinc) tạo ra được đúc thành k tấm kẽm (zinc) hình hộp chữ nhật; chiều dài 600 cm, chiều rộng 150 cm và chiều cao 1 cm. Biết khối lượng riêng của kẽm là 7,14 g/cm3. Giá trị của k là bao nhiêu? Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào quá trình tách kim loại. Lời giải chi tiết :
Khối lượng ZnS có trong quặng là: 52.80% = 41,6 tấn
Thể tích tấm kẽm là: 600.150.1 = 9000 cm3 Khối lượng kẽm trong 1 tấm là: m = D.V = 9000.7,14 = 642600g Số tấm kẽm tạo thành là: \(\frac{{25,{{1.10}^6}}}{{642600}} = 39\)
Câu 2 :
Đun nóng một loại dầu dừa với dung dịch NaOH, sản phẩm thu được có chứa muối sodium panmitate (C15H31COONa). Phân tử khối của sodium panmitate là bao nhiêu? Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào kiến thức về chất béo Lời giải chi tiết :
Phân tử khối của sodium panmitate là: 278
Câu 3 :
Tiến hành các thí nghiệm sau: (1) Điện phân MgCl2 nóng chảy. (2) Cho CO qua Fe2O3 đun nóng (3) Nhiệt phân hoàn toàn CaCO3. (4) Cho kim loại Na vào dung dịch CuSO4 dư. (5) Dẫn khí H2 dư đi qua bột CuO nung nóng. Sau khi các phản ứng kết thúc, các thí nghiệm thu được kim loại được sắp xếp theo trình tự từ nhỏ đến lớn là bao nhiêu? Đáp án: Đáp án
Đáp án: Lời giải chi tiết :
Câu 4 :
Cho các chất: saccharose, glucose, fructose, ethyl formate, formic acid và acetic aldehyde. Trong các chất trên, số chất vừa có khả năng tham gia phản ứng tráng bạc vừa có khả năng phản ứng với Cu(OH)2 ở điều kiện thường là? Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào tính chất của nhóm chức – OH và – CHO Lời giải chi tiết :
Glucose, frutose và formic acid có phản ứng tráng bạc và phản ứng với Cu(OH)2 ở điều kiện thường Đáp án 3
Câu 5 :
Từ tinh bột (có trong các loại ngũ cốc như ngô, lúa mì, đậu tương,…) có thể chuyển hóa thành ethanol dùng để phối trộn với xăng thông thường theo một tỉ lệ nhất định tạo ra xăng sinh học như: xăng E5RON92 (gồm 5% ethanol và 95% xăng RON 92 về thể tích), xăng E10RON92 (gồm 10% ethanol và 90% xăng RON 92 về thể tích). Việc sử dụng ethanol trong xăng sinh học diễn ra theo chu trình khép kín giúp giảm thải khí độc thoát ra ngoài, góp phần bảo vệ môi trường.
Tính độ giảm (%) phát thải khí nhà kính đối với một động cơ đốt trong sử dụng xăng sinh học E5RON92 so với việc động cơ ấy sử dụng xăng truyền thống RON92. Giả thiết: xăng RON92 là hỗn hợp isooctane và heptane với tỉ lệ tương ứng 92:8 về thể tích; quá trình đốt cháy các nhiên liệu trong động cơ đốt trong là hoàn toàn, sinh ra nước và carbon dioxde. Khối lượng riêng của ethanol, isooctane và heptane lần lượt là 0,8g/ml, 0,688 g/ml và 0,684 g/ml. Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào thành phần của các loại xăng sinh học. Lời giải chi tiết :
Giả sử có 100ml E5RON 92 và xăng truyền thống RON 92. Ta có: 100ml E5RON 92 gồm: 5ml C2H5OH và 95ml xăng RON 92 (87,4ml isooctane và 7,6ml heptane) 100 ml xăng RON 92 gồm: 92ml isooctane và 8 ml heptane Khối lượng ethanol là: 5.0,8 = 4g → n C2H5OH = 0,087 mol Khối lượng isooctane trong E5RON92: 87,4.0,688 = 60,1312g → n C8H18 = 0,53 mol Khối lượng heptane trong E5RON92: 7,6.0,684 = 5,1984g → n C7H16 = 0,052 mol Khối lượng isooctane trong xăng RON 92: 92.0,688 = 63,296g → n C8H18 = 0,555 mol Khối lượng heptane trong xăng RON 92: 8.0,684 = 5,472g → n C7H16 = 0,055 mol Khi đốt cháy 100ml xăng E5RON92 thu được tổng n CO2 (1) = 0,087.2 + 0,53.8 + 0,052.7 = 4,778 mol Khi đốt cháy 100ml xăng RON92 thu được tổng n CO2 (2) = 0,555.8 + 0,055.7 = 4,825 Độ giảm % phát thải khí CO2 là: \(\frac{{{n_{C{O_2}(2)}} - {n_{C{O_2}(1)}}}}{{{n_{C{O_2}(2)}}}}.100\% = \frac{{4,825 - 4,778}}{{4,825}}.100\% = 0,97\% \)
Câu 6 :
Ion Ca+2 cần thiết cho máu của người hoạt động bình thường. Nồng độ ion calcium không bình thường là dấu hiệu của bệnh. Để xác định nồng độ ion calcium, người ta lấy mẫu máu, sau đó kết tủa ion calcium dưới dạng calcium oxalate (CaC2O4) rồi cho calcium oxalate tác dụng với dung dịch potassium permanganate trong môi trường acid theo phản ứng sau: KMnO4 + CaC2O4 + H2SO4 → CaSO4 + K2SO4 + MnSO4 + CO2 + H2O Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 2,05 mL dung dịch potassium permanganate (KMnO4) 4,88.10-4M. Xác định nồng độ ion calcium trong máu người đó bằng đơn vị mg Ca+2/100 mL máu. Đáp án: Đáp án
Đáp án: Phương pháp giải :
Cần cân bằng phản ứng bằng phương pháp thăng bằng electron. Dựa vào kiến thức về chuẩn độ để xác định nồng độ ion calcium. Lời giải chi tiết :
2KMnO4 + 5CaC2O4 + 8H2SO4 5CaSO4 + K2SO4 + 2MnSO4 + 10CO2 + 8H2O n KMnO4 = 4,88.10-4.2,05.10-3 = 1,0004.10-6 mol theo phương trình hóa học: n CaSO4 = 2,501.10-6 mol Nồng độ ion Ca2+ có trong máu người đó là: 2,501.10-6.40.103.100 = 10mg/100ml máu
|













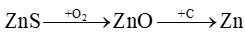
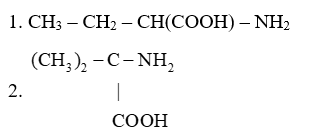










Danh sách bình luận