Đề số 1 - Đề kiểm tra học kì 2 - Hóa học 10Đáp án và lời giải chi tiết Đề số 1 - Đề kiểm tra học kì 2 (Đề thi học kì 2) - Hóa học 10 Quảng cáo
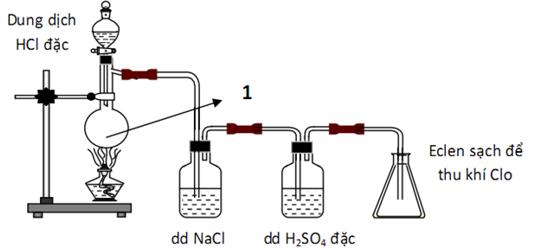
Đề bài Câu 1. Chỉ ra nhân định không đúng trong các câu sau? A.Cho H2SO4 đặc dư vào cốc đựng đường saccarozơ thì thấy đường chuyển sang màu đen. B.Hiđro sunfua bị oxi hóa bởi nước clo ở nhiệt độ thường. C.Khí SO2 làm mất màu dung dịch brom, dung dịch kalipemanganat. D.Khi pha loãng axit sunfuric đặc, ta có thể rót từ từ nước vào axit rồi dùng đũa thủy tinh khuấy đều. Câu 2. Dùng bình sắt có thể chứa được tất cả các dung dịch axit trong dãy nào dưới đây? A.H2SO4 đặc, nguội; HNO3 đặc nguội. B.H2SO4 đặc nguội; HNO3 loãng. C.HCl, HNO3 đặc, nóng. D.HCl loãng, H2SO4 loãng. Câu 3. Dãy các chất nào sau đây đều tác dụng được với HCl loãng? \(\eqalign{ & A.CuO,NaOH,FeC{l_3},AgN{O_3}. \cr & B.AgN{O_3},Ag,Fe{\left( {OH} \right)_3},N{a_2}C{O_3}. \cr & C.NaOH,Fe,CuO,N{a_2}C{O_3}. \cr & D.Al{\left( {OH} \right)_3},Zn,BaS{O_4},Cu. \cr} \) Câu 4. Cho các phát biểu sau: (1) Cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoành toàn. (2) Khi thay đổi trạng thái cân bằng của phản ứng thuận nghịch, cân bằng sẽ chuyển dịch về phía chống lại sự thay đổi đó. (3) Chất xúc tác làm tăng tốc độ của phản ứng thuận bao nhiêu lần thì làm giảm tốc độ của phản ứng nghịch bấy nhiêu lần. (4) Khi tăng nhiệt độ cân bằng chuyển dịch theo chiều phản ứng thu nhiệt. (5) Khi tăng áp suất chung của hệ thì cân bằng luôn chuyển dịch theo chiều thuận. (6) Trong hệ cân bằng có chất rắn, thì việc thêm hoặc bớt lượng chất rắn cũng không ảnh hưởng đến cân bằng. Số phát biểu sai là A.2. B.3. C.4. D.5. Câu 5. Đun nóng 22,12 gam KMnO4 thu được 21,16 gam hỗn hợp chất rắn. Cho hỗn hợp chất rắn tác dụng với dung dịch HCl đặc thì lượng khí clo thoát ra là A.0,17 mol. B.0,29 mol. C.0,24 mol. D.0,26 mol. Câu 6. Muối NaBrO có tên là A.natri hipobromat. B.natri hipobromo. C.natri hipobromit. D.natri bromua. Câu 7. Cho hình vẽ mô tả thí nghiệm điều chế clo trong phòng thí nghiệm như sau: Hóa chất được dùng trong bình cầu (1) là
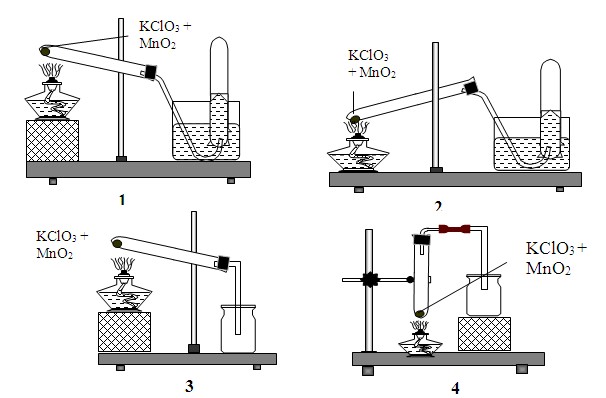
A.MnO2. B.KMnO4. C.K2SO4. D.Cả A và B đều thỏa mãn. Câu 8. Hòa tan hoàn toàn 2,72 gam hỗn hợp CaC2 và Al4C3 vào dung dịch HCl 2M ta thu được một lượng hỗn hợp khí có tỷ khối so với H2 là 10. Số mol CaC2 và Al4C3 lần lượt là A.0,03; 0,02. B.0,01; 0,02. C.0,015; 0,01. D.0,02; 0,01. Câu 9. Để nhận biết dung dịch NaCl và dung dịch NaNO3 người ta dùng thuốc thử A.AgNO3. B.H2SO4. C.AgCl. D.quỳ tím. Câu 10. Khi sục khí clo vào dung dịch NaOH ở nhiệt đọ thường ta được một dung dịch có tên gọi là nước Javen. Nó có tên gọi như vậy vì lần đầu tiên được Bectôlê điều chế ở thành phố Javen gần Paris (Pháp). Nước Javen có tính oxi hóa mạnh được dùng để tẩy trắng sợi, vải, giấy. nó cũng được dùng để sát trùng và tẩy uế nhà vệ sinh hoặc nhũng khu vực bị ô nhiễm khác. Thành phần của nước Javen là \(\eqalign{ & A.NaCl,NaClO,{H_2}O. \cr & B.NaCl,{H_2}O. \cr & C.NaCl,NaCl{O_3},{H_2}O. \cr & D.NaClO,{H_2}O. \cr} \) Câu 11. Cho các phát biểu sau (1) Oxi và ozon là hai đồng phân của nhau vì đều được cấu tạo từ nguyên tố oxi. (2) Trong công nghiệp, oxi được điều chế theo phương pháp chưng cất phân đoạn không khí lỏng. (3) Ozon được thêm vào trong kem đánh răng để chống sâu răng. (4) Oxi là một khí không màu, không mùi còn ozon là khí có màu xanh nhạt và có mùi đặc trưng riêng. (5) Oxi và ozon đều có tính oxi hóa mạnh nhưng tính oxi hóa của ozon mạnh hơn oxi. Số phát biểu đúng là A.2. B.3. C.4. D.5. Câu 12. Sục 7,84 lít khí SO2 ở đktc vào 500 ml dung dịch KOH 2M thu được dung dịch X. Nồng độ mol/l của các chất trong dung dịch X là A. 0,6M K2SO3 và 0,6M KHSO3. B. 0,6M K2SO3 và 0,7M KHSO3. C. 0,6M K2SO3 và 0,8M KHSO3. D. 0,7M K2SO3 và 0,6M KOH. Câu 13. Ozon được tạo thành trong khí quyển khi có sự phóng điện ( tia chớp, sét). Không khí chưa một lượng rất nhỏ ozon ( dưới 1 phần triệu theo thể tích) có tác dụng làm cho không khí trong lành và có lợi cho sức khỏe con người, nhứng với nồng độ lớn hơn lại có hại. Trên thực tế, người ta dùng ozon để diệt trùng nước uống ở thành phố. Ngoài ra, ozon còn được sử dụng trong phản ứng ozon hóa các hợp chất hữu cơ. Những ứng dụng của ozon là dựa vào A.khả năng tan trong nước của nó. B.tính oxi hóa mạnh của nó. C.độ âm điện của nguyên tố oxi trong phân tử. D.trạng thái tồn tại của ozon ở thể khí. Câu 14. Cho cân bằng trong bình khí như sau: \(C\left( r \right) + {H_2}O\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} CO\left( k \right) + {H_2}\left( k \right),\Delta H > 0\) Trong các yếu tố : (1) tăng nhiệt độ, (2) thêm một lượng hơi nước, (3) thêm một lượng H2, (4) tăng áp suất chung của hệ, (5) dùng chất xúc tác. Dãy gồm các yếu tố đều làm cân bằng chuyển dịch theo chiều thuận là A.18,256 lít. B.8,064 lít. C.4,032 lít. D.9,178 lít. Câu 16. Cho các bước tiến hành thí nghiệm SO2 từ Na2SO3 và H2SO4 đặc như sau (1) Cho vào ống nghiệm có nhánh một lượng nhỏ Na2SO3. (2) Nối ống của ống nghieemj có nhánh với ống dẫn thủy tinh thẳng bằng ống dẫn cao su. (3) Bóp nhẹ quả bóp cao su cho H2SO4 đặc chảy xuống và tác dụng với Na2SO3. (4) Đậy ống nghiệm bằng nút cao su có kèm ống nhỏ giọt chứa H2SO4 đặc. (5) Kẹp ống nghiệm lên giá. (6) Nhúng đầu ống dẫn thủy tinh vào eclen khô dùng để thu khí SO2, đậy miệng eclen bằng bông tẩm dung dịch NaOH. Thứ tự các bước tiến hành thí nghiệm là \(\eqalign{ & A.\left( 1 \right),\left( 2 \right),\left( 5 \right),\left( 6 \right),\left( 4 \right),\left( 3 \right). \cr & B.\left( 2 \right),\left( 4 \right),\left( 3 \right),\left( 6 \right),\left( 1 \right),\left( 5 \right). \cr & C.\left( 2 \right),\left( 6 \right),\left( 5 \right),\left( 1 \right),\left( 4 \right),\left( 3 \right). \cr & D.\left( 2 \right),\left( 5 \right),\left( 1 \right),\left( 6 \right),\left( 4 \right),\left( 3 \right). \cr} \) Câu 17. Trong phòng thí nghiệm, để điều chế một lượng nhỏ khí oxi tinh khiết, người ta thường nhiệt phân các hợp chất giàu oxi và kém bền với nhiệt như KMnO4, KClO3... và có thể thu được bằng cách đẩy nước hay không khí. Mô hình điều chế oxi đúng nhất là A.hình 1. B.hình 2. C.hình 3. D.hình 4. Câu 18. Cho các phát biểu sau: (a) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa. (b) Axit flohiđric là axit yếu. (c) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng. (d) Trong hợp chất, các halogen (F,Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5 và +7. (e) Tính khử của các ion halogenua tăng dần theo thứ tự: F-, Cl-, Br-, I-. Số phát biểu đúng là A.2. B.4. C.3. D.5. Câu 19. Hòa tan hoàn toàn 8,8g hỗn hợp Mg và CuO vào dung dịch HCl dư. Sau phản ứng thu được 4,48 lít khí H2 (đktc). Số mol axit HCl đã tham gia phản ứng là A.0,4 mol. B.0,5 mol. C.0,2 mol. D.0,3 mol. Câu 20. Cho phương trình hóa học: \({N_2} + {O_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2NO\left( k \right);\Delta H > 0.\) Những yếu tố ảnh hưởng tới cân bằng là A.nhiệt độ và nồng độ. B.chất xúc tác và nhiệt độ. C.nồng độ và chất xúc tác. D.áp suất hệ phản ứng và nhiệt độ. Câu 21. Sản phẩm thu được khi điện phân dung dịch KCl ( điện cực trơ, màng ngăn xốp) là \(\eqalign{ & A.KOH,{O_2},HCl. \cr & B.KOH,{H_2},C{l_2}. \cr & C.K,C{l_2}. \cr & D.K,{H_2},C{l_2}. \cr} \) Câu 22. Nhận xét nào dưới đây không đúng ? A.Axit HCl được dùng để khắc chữ trên thủy tinh. B.Dung dịch NaF loãng dùng làm chất chống sâu răng. C.Dung dịch 5% iot trong etanol dùng sát trùng vết thương. D.KI hoặc KIO3 được dùng sản xuất muối iot. Câu 23. Hòa tan 22,8 gam hỗn hợp A gồm Mg và Fe vào dung dịch H2SO4 80% (đặc, nóng, vừa đủ). Sau khi phản ứng xảy ra hoàn toàn, thấy thoát ra 15,68 lít khí SO2 là sản phẩm khử duy nhất (ở đktc) và dung dịch B. Thành phần phần % khối lượng của Mg trong hỗn hợp A là A.26,32%. B.73,68%. C.53,95%. D.46,05%. Câu 24. Chỉ ra phát biểu sai trong các câu sau A.Lưu huỳnh đioxit là chất khí không màu, mùi hắc. B.Hiđro sunfua là chất khí nặng hơn không khí. C.Liên kết trong phân tử oxi là liên kết cộng hóa trị không cực. D.Ozon không hoạt động hóa học ở nhiệt độ thường giống oxi. Câu 25. Cho m gam hỗn hợp gồm Mg, Zn, Fe tác dụng hết với dung dịch HCl loãng thu được 6,72 lít khí (đktc). Cô cạn dung dịch sau phản ứng thu được 43,3 gam muối khan. Giá trị của m là A.13,9g. B.14,5g. C.22g. D.19,3g. Câu 26. Cho phản ứng: \(CaC{O_3}\buildrel {t^\circ } \over \longrightarrow CaO + C{O_2}.\) Để tăng hiệu suất của phản ứng thì biện pháp nào sau đây không phù hợp. A.Tăng nhiệt độ trong lò. B.Tăng áp suất trong lò. C.Đập nhỏ đá vôi. D.Giảm áp suất trong lò. Câu 27. Cho axit clohiđric tác dụng với kali pemanganat (rắn) để điều chế clo, khí clo sẽ thoát ra nhanh hơn khi A. dùng axit clohiđric đặc và đun nhẹ hỗn hợp. B. dùng axit clohiđric đặc và làm lạnh hỗn hợp. C. dùng axit clohiđric loãng và đun nhẹ hỗn hợp. D. dùng axit clohiđric loãng và làm lạnh hỗn hợp. Câu 28. Đặc điểm nào sau đây không phải là điểm giống nhau giữa oxi và lưu huỳnh? A.Đều là các phi kim hoạt động mạnh. B.Đều thuộc nhóm VIA. C.Đều thể hiện tính oxi hóa khi tác dụng với H2. D.Đều có khả năng thể hiện số oxi hóa -2 trong hợp chất. Câu 29. Trong các chất sau, tính chất nào không phải là tính chất của axit clohiđric và axit sunfuric loãng? A.Tác dụng với kim loại Cu giải phóng khí H2. B.Tác dụng với dung dịch NaOH. C.Làm đổi màu quỳ tím. D.Tác dụng với CaCO3 giải phóng CO2. Câu 30. Trong những món ăn dân dã của làng quê Việt Nam thì có lẽ cà pháo muối vẫn là món ăn hấp dẫn nhiều người thưởng thức vì hương vị thơm ngon của nó. Trong quá trình muối cà, người ta thường cho thêm một bát nước cà muối của lần trước và đem phơi nắng. Làm như vậy cà muối sẽ nhanh chua, ngon và giòn hơn. Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ của phản ứng trong cách làm trên? A. nồng độ, nhiệt độ. B. áp suất, nồng độ. C. chất xúc tác, nhiệt độ. D. chất xúc tác, áp suất. Lời giải chi tiết
Câu 4: (1) Cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoành toàn: Sai, vì cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch. (2) Khi thay đổi trạng thái cân bằng của phản ứng thuận nghịch, cân bằng sẽ chuyển dịch về phía chống lại sự thay đổi đó: Đúng. (3) Chất xúc tác làm tăng tốc độ của phản ứng thuận bao nhiêu lần thì làm giảm tốc độ của phản ứng nghịch bấy nhiêu lần: Sai, vì chất xúc tác làm tăng tốc độ của phản ứng thuận và tốc độ của phản ứng nghịch với số lần bằng nhau. (4) Khi tăng nhiệt độ cân bằng chuyển dịch theo chiều phản ứng thu nhiệt: Đúng. (5) Khi tăng áp suất chung của hệ thì cân bằng luôn chuyển dịch theo chiều thuận: Sai, vì áp suất ảnh hưởng đến cân bằng như thế nào tùy thuộc vào số mol khí ở hai bên. (6) Trong hệ cân bằng có chất rắn, thì việc thêm hoặc bớt lượng chất rắn cũng không ảnh hưởng đến cân bằng: Đúng. Vậy các phát biểu sai là (1), (3), (5) Đáp án B Câu 5: \(\eqalign{ & {\rm{ 2KMn}}{{\rm{O}}_4}\buildrel {t^\circ } \over \longrightarrow {K_2}Mn{O_4} + Mn{O_2} + {O_2} \cr & {n_{KMn{O_4}}} = 0,14\left( {mol} \right) \cr} \) Áp dụng định luật bảo toàn khối lượng ta có: \({m_{{O_2}}} = {m_{KMn{O_4}}} - \) mhh rắn = 22,12 – 21,16 = 0,96 (gam) \( \to {n_{{O_2}}} = {m \over M} = {{0,96} \over {32}} = 0,03\left( {mol} \right)\) Theo phương trình: \(\eqalign{ & {n_{KMn{O_4}}} = 2.{n_{{O_2}}} = 0,06\left( {mol} \right) \cr & \to {n_{KMn{O_4}\text{dư}}} = 0,1 - 0,06 = 0,08\left( {mol} \right) \cr & {n_{KMn{O_4}}} = {n_{Mn{O_2}}} = {n_{{O_2}}} = 0,03\left( {mol} \right) \cr} \) Khi đó hỗn hợp rắn tác dụng với dung dịch HCl đặc thì các phản ứng xảy ra là phản ứng oxi hóa khử. Cách 1: Viết phương trình hóa học và tính toán theo phương trình
Tổng số mol Cl2 thu được là: \(0,2 + 0,06 + 0,03 = 0,29\left( {mol} \right)\) Đáp án B. Cách 2: Dùng phương pháp bảo toàn electron Các quá trình xảy ra.
Câu 8: Gọi x, y lần lượt là số mol của CaC2 và Al4C3 trong hỗn hợp \( \to 64x + 144y = 2,72\left( 1 \right)\)
\(\Rightarrow \dfrac{x}{{3y}} = \dfrac{{20 - 16}}{{26 - 20}} = \dfrac{2}{3}\) \(\Leftrightarrow x = 2y\left( 2 \right)\) Từ (1) và (2) ta có: x = 0,02; y = 0,01 Đáp án D Câu 11: (1) Oxi và ozon là hai đồng phân của nhau vì đều được cấu tạo từ nguyên tố oxi: Sai, vì oxi và ozon được gọi là ạng thù hình của nhau, không phải là đồng phân. (2) Trong công nghiệp, oxi được điều chế theo phương pháp chưng cất phân đoạn không khí lỏng: Đúng. (3) Ozon được thêm vào trong kem đánh răng để chống sâu răng: Sai, vì ozon có thể dùng chữa sâu răng nhưng không phải là thành phần của kem đánh răng. (4) Oxi là một khí không màu, không mùi còn ozon là khí có màu xanh nhạt và có mùi đặc trưng riêng: Đúng. (5) Oxi và ozon đều có tính oxi hóa mạnh nhưng tính oxi hóa của ozon mạnh hơn oxi: Đúng. Đáp án B Câu 12: \({n_{S{O_2}}} = 0,35\left( {mol} \right),{n_{KOH}} = 1\left( {mol} \right)\) \(\dfrac{{{n_{KOH}}}}{{{n_{S{O_2}}}}} = \dfrac{1}{{0,35}} = 2,86 > 2\) nên phản ứng tạo muối trung hòa, KOH dư. Phương trình hóa học \(\eqalign{ & S{O_2} + 2KOH \to {K_2}S{O_3} + {H_2}O \cr & 0,35 \to 0,7{\rm{ }} \to 0,35mol \cr} \) Dung dịch sau phản ứng gồm K2SO3 (0,35 mol), và KOH dư (0,3 mol) \(\eqalign{ & {C_{{M_{{K_2}S{O_3}}}}} = {n \over V} = {{0,35} \over {0,5}} = 0,7\left( M \right) \cr & {C_{{M_{KOH}}}} = {n \over V} = {{0,3} \over {0,5}} = 0,6\left( M \right) \cr} \) Đáp án D Câu 14: Khi tác động một yếu tố ảnh hưởng đến cân bằng thì cân bằng chuyển dịch theo chiều chống lại sự ảnh hưởng đó \(Cr + {H_2}O\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} CO\left( k \right) + {H_2}\left( k \right),\Delta H > 0\) + Phản ứng thuận là phản ứng thu nhiệt, để cân băng chuyển dịch theo chiều thuận ta phải tăng nhiệt độ của phản ứng. + Thêm một lượng hơi nước \( \Rightarrow \) cân bằng chuyển dịch theo chiều thuận + Thêm một lượng H2 \( \Rightarrow \) cân bằng chuyên dịch theo chiều nghịch + Dùng chất xúc tác không ảnh hưởng đến cân bằng + Thêm C ở dạng rắn cân bằng không chuyển dịch Vậy các yếu tố làm cân bằng chuyển dịch theo chiều thuận là (1), (2) Đáp án A \(\eqalign{ & {m_{HCl}} = {{C\% .{m_{{\rm{dd}}}}} \over {100\% }} = {{36,5.36} \over {100}} = 13,14\left( {gam} \right) \cr & {n_{HCl}} = {m \over M} = {{13,14} \over {36,5}} = 0,36\left( {mol} \right) \cr & {m_{{H_2}O}} = {m_{{\rm{dd}}}} - {m_{ctHCl}} = 36 - 13,14 = 22,86\left( {gam} \right) \cr & {n_{{H_2}O}} = {m \over M} = {{22,86} \over {18}} = 1,27\left( {mol} \right) \cr} \) Các phương trình hóa học xảy ra
Chú ý: đề bài cho Na dư do đó nhiều bạn nhầm tưởng rằng số mol của H2 được tính theo số mol của axit HCl, \({n_{{H_2}}} = 0,18\left( {mol} \right) \to V = 4,032\) (lít) Câu 16: Thứ tự đúng của cách tiến hành thí nghiệm là: (2) Nối ống của ống nghieemj có nhánh với ống dẫn thủy tinh thẳng bằng ống dẫn cao su. (6) Nhúng đầu ống dẫn thủy tinh vào eclen khô dùng để thu khí SO2, đậy miệng eclen bằng bông tẩm dung dịch NaOH. (5) Kẹp ống nghiệm lên giá. (1) Cho vào ống nghiệm có nhánh một lượng nhỏ Na2SO3. (4) Đậy ống nghiệm bằng nút cao su có kèm ống nhỏ giọt chứa H2SO4 đặc. (3) Bóp nhẹ quả bóp cao su cho H2SO4 đặc chảy xuống và tác dụng với Na2SO3. Đáp án C Câu 17: Oxi là một khí không màu, hơi nhẹ hơn không khí và ít tan trong nước. Do vậy ta có thể thu khí oxi bằng phương pháp dời nước hoặc đẩy khí nhưng phải úp bình thu khí \( \Rightarrow \) loại C và D Vì hỗn hợp KClO3 + MnO2 ở dạng rắn, trong quá trình bảo quản có khả năng bị hút ẩm. Do đó trong quá trình nhiệt phân có thể sinh ra hơi nước. Để tránh cho việc hơi nước sinh ra chảy ngược xuống đáy ống nghiệm làm vỡ ống nghiệm, ta cần chú ý kẹp ống nghiệm sao cho miệng ống nghiệm hơi chúc xuống phía dưới. Hình vẽ mô tả cách điều chế oxi đúng nhất là hình 1 Đáp án A Câu 18: (a) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa: Đúng vì Flo có độ âm điện lớn nhất nên chỉ có khả năng thể hiện tính oxi hóa. (b) Axit flohiđric là axit yếu: Đúng. (c) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng: Đúng. (d) Trong hợp chất, các halogen (F,Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5 và +7: Sai vì F chỉ có oxi hóa -1 trong các hợp chất (e) Tính khử của các ion halogenua tăng dần theo thứ tự: F-, Cl-, Br-, I-: Đúng Các phát biểu đúng là (a), (b), (c), (e). Đáp án B Câu 19: \(\eqalign{ & {n_{{H_2}}} = {V \over {22,4}} = {{4,48} \over {22,4}} = 0,2\left( {mol} \right) \cr & {\rm{ Mg + 2HCl}} \to {\rm{MgC}}{{\rm{l}}_2} + {H_2} \cr & {\rm{ 0,2}} \leftarrow {\rm{0,4}} \leftarrow\;\;\;\;\;\;\;\;\;\;\; {\rm{ 0,2 mol}} \cr & {\rm{ CuO + HCl}} \to {\rm{CuC}}{{\rm{l}}_2} + {H_2}O \cr & {n_{CuO}} = 8,8 - 0,2.24 = 4\left( {gam} \right)\cr& \to {n_{CuO}} = 0,05\left( {mol} \right) \cr & \sum {{n_{HCl}}} = 0,4 + 2.0,05 = 0,5\left( {mol} \right) \cr} \) Đáp án B Câu 23: \({n_{S{O_2}}} = 0,7\left( {mol} \right)\) Gọi x, y lần lượt là số mol của Mg và Fe trong hỗn hợp A. Có: 24x + 56y = 22,8 (1) Các quá trình xảy ra:
Áp dụng định luật bảo toàn electron ta có: 2x + 3y = 1,4 (2) Từ (1) và (2) nên x = 0,25; y = 0,3 \( \Rightarrow \% Mg = \dfrac{{0,25.24}}{{22,8}}.100 = 26,32\% \) Đáp án A Câu 25: \({n_{{H_2} = 0,3\left( {mol} \right)}}\) \(\eqalign{ & Mg + 2HCl \to MgC{l_2} + {H_2}{\rm{ }}\left( 1 \right) \cr & Zn + 2HCl \to ZnC{l_2} + {H_2}{\rm{ }}\left( 2 \right) \cr & Fe + 2HCl \to FeC{l_2} + {H_2}{\rm{ }}\left( 3 \right) \cr} \) Cách 1: Áp dụng định luật bảo toàn khối lượng: Nhận thấy: \({n_{HCl}} = 2.{n_{{H_2}}}\) Áp dụng định luật bảo toàn khối lượng ta có: mhh + mHCl = mmuối + \({m_{{H_2}}}\) \( \to {m_{hh}} = 43,3 + 0,3.2 - 0,3.2.36,5 \)\(\,= 22gam\) Đáp án C Cách 2:Tính theo phương trình Gọi số mol của Mg, Zn, Fe lần lượt là x, y, z \({n_{{H_2}}} = x + y + z = 0,3\left( {mol} \right)\) mmuối = \({m_{MgC{l_2}}} + {m_{ZnC{l_2}}} + {m_{FeC{l_2}}}\) \( \Rightarrow 24x + 65y + 56z = 22\left( {gam} \right)\) Loigiaihay.com
|














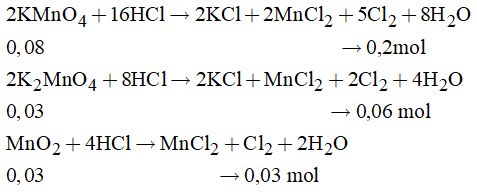
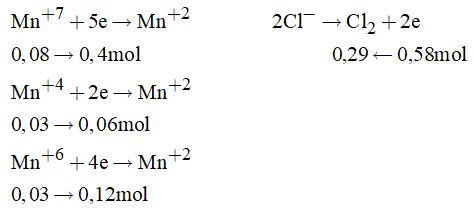

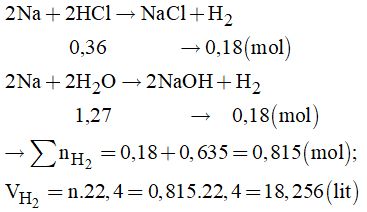
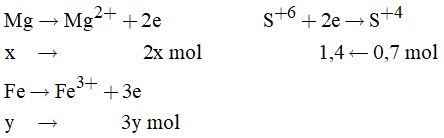






Danh sách bình luận