Câu hỏi:
Cho phản ứng:
Fe3O4 + HNO3→ Fe(NO3)3 + NxOy + H2O. Sau khi cân bằng, hệ số của HNO3 là:
- A 13x – 9y
- B 23x – 9y
- C 23x – 8y
- D 46x – 18y
Phương pháp giải:
Xác định số oxi hóa của các nguyên tố để tìm chất oxi hoá và chất khử.
Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron cho bằng tổng số electron nhận.
Đặt hệ số của các chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Từ đó xác định được hệ số của HNO3 sau khi cân bằng phương trình.
Lời giải chi tiết:
Xác định số oxi hóa của một số nguyên tố thay đổi trong phản ứng trên:
\({\mathop {Fe}\limits^{ + 8/3} _3}{O_4} + {\rm{ }}H\mathop N\limits^{ + 5} {O_3} \to \mathop {Fe}\limits^{ + 3} {\left( {N{O_3}} \right)_3} + {\rm{ }}{\mathop N\limits^{ + 2y/x} _x}{O_y} + {\rm{ }}{H_2}O\)
Quá trình oxi hóa và quá trình khử là:
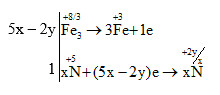
Vậy phương trình hóa học được cân bằng là:
(5x – 2y)Fe3O4 + (46x-18y)HNO3→ (15x-6y)Fe(NO3)3 + NxOy + (23x-9y)H2O.
Sau khi cân bằng, hệ số của HNO3 là (46x – 18y).
Đáp án D


















