Câu hỏi:
Cho các nguyên tố 4Be, 11Na, 12Mg, 19K. Chiều tăng dần tính bazơ của các hiđroxit là:
- A Be(OH)2 < Mg(OH)2 < NaOH < KOH
- B Be(OH)2 < Mg(OH)2 < KOH < NaOH
- C KOH < NaOH < Mg(OH)2 < Be(OH)2
- D Mg(OH)2 < Be(OH)2 < NaOH < KOH
Phương pháp giải:
Từ số hiệu nguyên tử suy ra vị trí của các nguyên tố trên trong bảng tuần hoàn.
Từ đó dựa vào quy luật biến đổi tuần hoàn tính bazơ của hidroxit theo chu kì và theo 1 nhóm A để sắp xếp dãy các chất theo chiều tăng dần tính bazơ của các hidroxit.
Lời giải chi tiết:
Ta có: cấu hình electron nguyên tử của các nguyên tố như sau:
4Be: 1s22s2 → Be thuộc chu kì 2, nhóm IIA
11Na: 1s22s22p63s1 → Na thuộc chu kì 3, nhóm IA
12Mg: 1s22s22p63s2→ Mg thuộc chu kì 3, nhóm IIA
19K: 1s22s22p63s23p64s1 → K thuộc chu kì 4, nhóm IA
Ta có bảng tuần hoàn dạng rút gọn như sau:
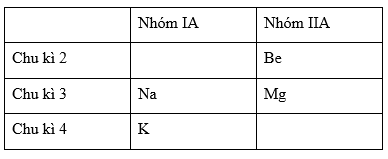
Trong một nhóm A, đi từ trên xuống dưới theo chiều tăng dần của điện tích hạt nhân: tính bazơ của hiđroxit tăng dần.
Do đó trong cùng nhóm IA, tính bazo của NaOH < KOH (1)
Trong cùng nhóm IIA, tính bazơ của Be(OH)2 < Mg(OH)2 (2)
Trong một chu kì, đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân: tính bazơ của hiđroxit giảm dần:
Do đó trong cùng chu kì 3, tính bazơ của NaOH > Mg(OH)2 (3)
Từ (1), (2) và (3) tính bazơ của Be(OH)2 <Mg(OH)2 < NaOH <KOH
Vậy, chiều tăng dần tính bazơ của các hiđroxit là: Be(OH)2 <Mg(OH)2 < NaOH <KOH
Đáp án A


















