Bài 9 trang 90 SGK Hóa học 10Cân bằng các phương trình phản ứng oxi hoá - khử sau đây bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hoá ở mỗi phản ứng : Quảng cáo
Đề bài Cân bằng các phương trình phản ứng oxi hoá - khử sau đây bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hoá ở mỗi phản ứng : a) Al + Fe3O4 \(\buildrel {{t^0}} \over\longrightarrow\) Al2O3 + Fe b) FeSO4 + KМnО4 + H2SO4 ⟶ Fe2(SO4)3 + MnSO4 + K2SO4 + H2O c) FeS2 + O2 \(\buildrel {{t^0}} \over\longrightarrow\) Fe2O3 + SO2 d) KClO3 \(\buildrel {{t^0}} \over\longrightarrow\) KCl + O2 e) Cl2+ KOH \(\buildrel {{t^0}} \over\longrightarrow\) KCl + KClO3 + H2O. Video hướng dẫn giải Phương pháp giải - Xem chi tiết Các bước để cân bằng phản ứng oxi hóa khử Bước 1: xác định số oxi hóa của các chất trước và sau phản ứng, để tìm chất khử và chất oxi hóa Bước 2: Viết quá trình oxi hóa khử, cân bằng mỗi quá trình Bước 3: Tìm hệ số thích hợp cho chất oxi hóa và chất khử, sao cho tổng số electron chất nhận = chất nhường Bước 4: Đặt các hệ số của chất khử và chất oxi hóa vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế Lời giải chi tiết a) 8Al + 3Fe3O4 ⟶ 4Al2O3 + 9Fe \(\left. \matrix{2{\rm{A}}{l^0} - 2.3{\rm{e}} \to {\rm{2A}}{l^{ + 3}} \hfill \cr 3F{{\rm{e}}^{ + {8 \over 3}}} + 3.{8 \over 3}e \to 3F{{\rm{e}}^0} \hfill \cr} \right|\matrix{{ \times 4} \cr { \times 3} \cr} \) Chất khử: Al Chất oxi hóa \(Fe_3O_4\) b) 10FeSO4 + 2KМnО4 + 8H2SO4 ⟶ 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O \(\left. \matrix{2F{{\rm{e}}^{ + 2}} - 2{\rm{e}} \to 2F{{\rm{e}}^{ + 3}} \hfill \cr M{n^{ + 7}} + 5{\rm{e}} \to M{n^{ + 2}} \hfill \cr} \right|\matrix{{ \times 5} \cr { \times 2} \cr} \) Chất khử: \(FeSO_4\) Chất oxi hóa: \(KMnO_4\) c) 4FeS2 + 11O2 ⟶ 2Fe2O3 + 8SO2↑ \(\matrix{ \(\left. \matrix{Fe{S_2} - 11e \to F{e^{ + 3}} + 2{S^{ + 4}} \hfill \cr O_2^0 - 2.2e \to 2{O_2} \hfill \cr} \right|\matrix{{ \times 4} \cr { \times 11} \cr} \) Chất khử: \(FeS_2\) Chất oxi hóa: \(O_2\) d) 2KClO3 ⟶ 2KCl + 3O2↑
e) 3Cl2 + 6KOH \(\buildrel {{t^0}} \over\longrightarrow\) 5KCl + KClO3 + 3H2O. \(\left. \matrix{Cl_2^0 - 10e \to 2C{l^{ + 5}} \hfill \cr Cl_2^0 + 2e \to 2C{l^{ - 1}} \hfill \cr} \right|\matrix{{ \times 1} \cr { \times 5} \cr} \) \(Cl_2\) vừa là chất khử, vừa là chất oxi hóa Loigiaihay.com
|














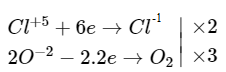






Danh sách bình luận