Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Kết nối tri thứcCác nguyên tố từ Sc (Z=21) đến Cu (Z = 29) được gọi là nguyên tố chuyển tiếp dãy thứ nhất. Quảng cáo
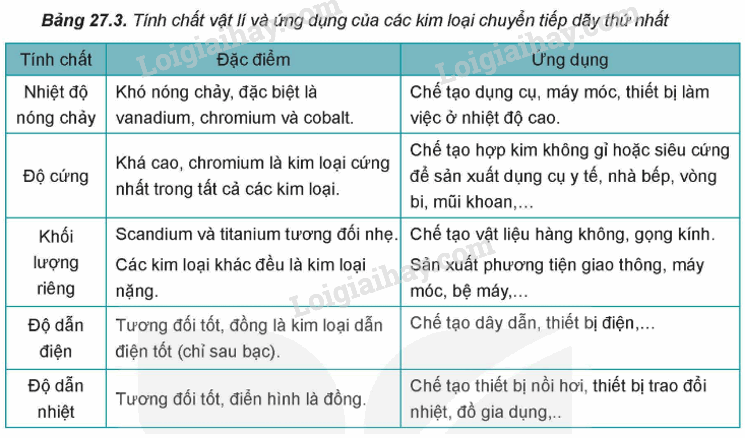
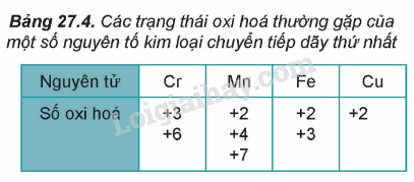
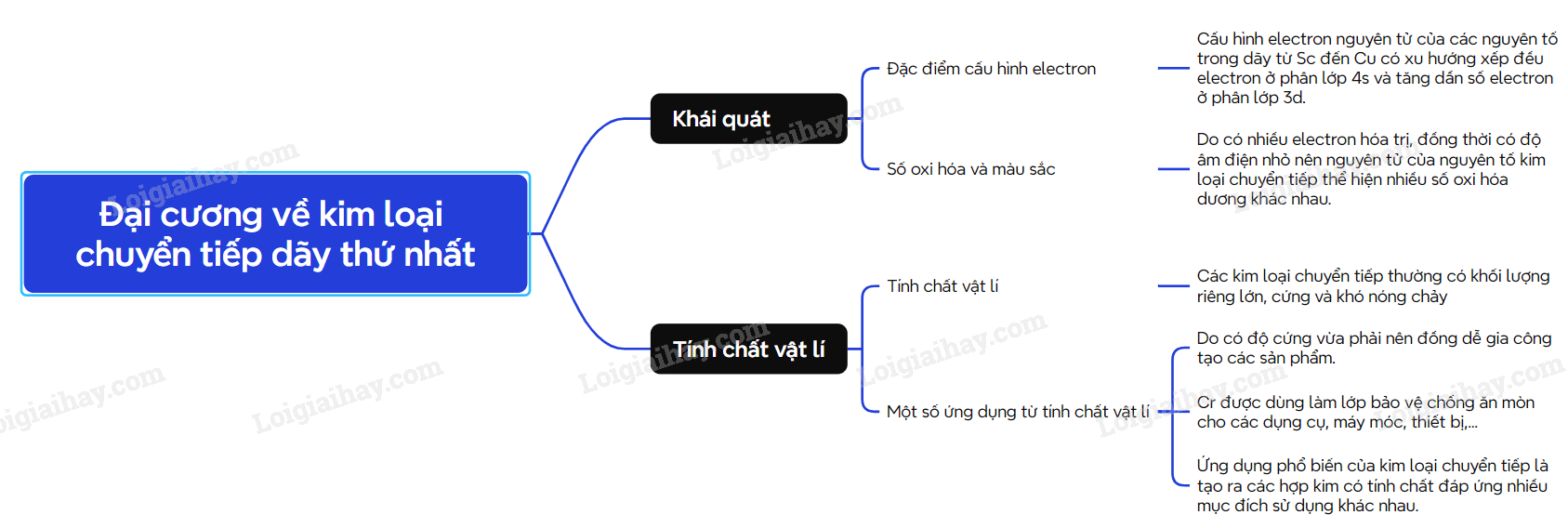
I. Đơn chất kim loại chuyển tiếp dãy thứ nhất 1. Đặc điểm cấu tạo nguyên tử - Các nguyên tố từ Sc (Z=21) đến Cu (Z = 29) được gọi là nguyên tố chuyển tiếp dãy thứ nhất. - Đặc điểm cấu hình electron trong nguyên tử của các kim loại chuyển tiếp dãy thứ nhất đều có lớp vỏ bên trong của khí hiếm Ar. - Số electron trên phân lớp 3d tăng dầu từ 1 đến 10. Trong khi đó trên phân lớp 4s, số electron thường bằng 2. - Nguyên tử của các kim loại chuyển tiếp dãy thứ nhất có nhiều electron hóa trị thuộc phân lớp 3d và 4s nên kim loại chuyển tiếp dãy thứ nhất thường tạo thành các hợp chất với nhiều số oxi hóa khác nhau. 2. Tính chất vật lí và ứng dụng của kim loại chuyển tiếp. II. Hợp chất của kim loại chuyển tiếp dãy thứ nhất 1. Số oxi hóa của nguyên tử kim loại chuyển tiếp dãy thứ nhất trong hợp chất. - Do có nhiều electron hóa trị (ở phân lớp 4s và 3d) nên các nguyên tố chuyển tiếp dãy thứ nhất có khả năng tạo ra các hợp chất với nhiều trạng thái oxi hóa khác nhau. - Khi tham gia phản ứng hóa học, nguyên tử kim loại chuyển tiếp dãy thứ nhất ưu tiên nhường electron ở phân lớp 4s trước rồi đến electron ở phân lớp 3d, tạo thành các cation tương ứng. 2. Màu sắc của các ion kim loại chuyển tiếp dãy thứ nhất Các ion kim loại chuyển tiếp dãy thứ nhất có màu sắc phong phú. 3. Chuẩn độ iron(II) sulfate bằng thuốc tím - Trong phòng thí nghiệm, nồng độ iron(II) sulfate có thể được xác định bằng phương pháp chuẩn độ với dung dịch thuốc tím trong môi trường sulfuric theo phương trình hóa học 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O 4. Nhận biết một số ion kim loại chuyển tiếp Trong hóa học, các ion kim loại chuyển tiếp thường được nhận biết dựa vào màu sắc đặc trưng của ion, của hợp chất ít tan hoặc của phức chất tương ứng. SƠ ĐỒ TƯ DUY
|




















Danh sách bình luận