50 câu hỏi lý thuyết mức độ thông hiểu và vận dụng về kim loại kiềm có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Để phân biệt dung dịch Na2SO4 với dung dịch NaCl, người ta dùng dung dịch
Đáp án: D Phương pháp giải: Lời giải chi tiết: Nhận biết nhở phản ứng : BaCl2 + Na2SO4 ® BaSO4↓ + 2NaCl Đáp án D Câu hỏi 2 : Cation M+ có cấu hình electron ở lớp ngoài cùng là 2s22p6. M+ là cation nào sau đây ?
Đáp án: C Phương pháp giải: Lời giải chi tiết: M+ có cấu hình electron ở lớp ngoài cùng là 2s22p6 => M có cấu hình e 2s22p63s1 => M là Na Đáp án C Câu hỏi 3 : Cho sơ đồ phản ứng: NaCl → (X) → NaHCO3 → (Y) → NaNO3. X và Y có thể là
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 4 : Trong quá trình điện phân dung dịch KBr, phản ứng nào sau đây xảy ra ở cực dương (anot) ?
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Câu hỏi 5 : Chỉ dùng thêm thuốc thử nào dưới đây có thể nhận biết được 3 lọ mất nhãn chứa các dung dịch: H2SO4, BaCl2, Na2SO4 ?
Đáp án: D Phương pháp giải: Lời giải chi tiết: - Dùng quỳ tím: + Quỳ tím chuyển đỏ => H2SO4 + Dùng H2SO4 nhận biết ra BaCl2 - Dùng Na2CO3: H2SO4: có khí bay lên BaCl2: xuất hiện kết tủa trắng Na2SO4: không có hiện tượng - Dùng bột Zn: + Có sủi bọt khí: H2SO4 + Dùng H2SO4 nhận biết ra BaCl2 Đáp án D
Câu hỏi 6 : Để điều chế Na2CO3 người ta dùng phương pháp nào sau đây?
Đáp án: B Phương pháp giải: Lời giải chi tiết: A. CO2 + NaOH → NaHCO3 B. H2O+ NaCl + NH3 + CO2 → NaHCO3 + NH4Cl 2NaHCO3 → H2O + Na2CO3 + CO2 C, D không phản ứng Đáp án B Câu hỏi 7 : X là một axit hữu cơ thỏa mãn điều kiện sau : m gam X + NaHCO3 ® x mol CO2 ; m gam X + O2 ® x mol CO2. Công thức cấu tạo của X là :
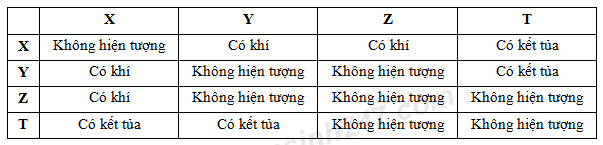
Đáp án: D Phương pháp giải: Lời giải chi tiết: nCO2 = nCOOH (Phản ứng với NaHCO3) nCO2 = nC(X) (phản ứng cháy) => nCOOH = nC(X) => X là (COOH)2 hoặc HCOOH Đáp án D Câu hỏi 8 : X, Y, Z, T là một trong các dung dịch sau: (NH4)2SO4, K2SO4, NH4NO3, KOH. Thực hiện thí nghiệm để nhận xét chúng và có được kết quả như sau:
Các dung dịch X, Y, Z, T lần lượt là
Đáp án: D Phương pháp giải: Lời giải chi tiết:
- Phương trình phản ứng: Ba(OH)2 + K2SO4 Ba(OH)2 + NH4NO3: không xảy ra Ba(OH)2 + (NH4)2SO4 Ba(OH)2 + 2NH4NO3 Đáp án D Câu hỏi 9 : Cho dãy các chất sau: CO2, CO, SiO2, NaHCO3, NH4Cl. Số chất trong dãy tác dụng với dung dịch NaOH loãng, ở nhiệt độ thường là
Đáp án: C Phương pháp giải: Lời giải chi tiết: Có 3 chất tác dụng với dung dịch NaOH loãng, ở nhiệt độ thường là: CO2, NaHCO3, NH4Cl Chú ý: SiO2, tác dụng với NaOH đặc ở nhiệt độ cao Đáp án C Câu hỏi 10 : Chất nào sau đây không tạo kết tủa khi tác dụng với dd Na3PO4
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án D Câu hỏi 11 : Có các chất sau: Na2O, NaCl, Na2CO3, NaNO3, Na2SO4. Có bao nhiêu chất mà bằng một phản ứng có thể tạo ra NaOH?
Đáp án: B Phương pháp giải: Lời giải chi tiết: Gồm: Na2O, NaCl (phản ứng điện phân dung dịch có màng ngăn), Na2CO3, Na2SO4 Đáp án B Câu hỏi 12 : Cho các phản ứng hóa học sau: (1) FeS + 2HCl → (2) 2KClO3 \(\xrightarrow{{{t^0}}}\)khí Y (3) NH4NO3 + NaOH → (4) Cu + 2H2SO4 ( đặc) (5) 2KMnO4 + 16HCl (đặc) → (6) NaCl (rắn) + H2SO4 ( đặc) \(\xrightarrow{{{t^0}}}\) Số phản ứng tạo chất khí khi tác dụng được với dung dịch NaOH là
Đáp án: C Phương pháp giải: Lời giải chi tiết: (1) FeS + 2HCl → FeCl2 + H2S↑ (2) 2KClO3 2KCl + O2↑ (3) NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O (4) Cu + 2H2SO4 ( đặc) \(\xrightarrow{{{t^0}}}\) CuSO4 + 2H2O + SO2↑ (5) 2KMnO4 + 16HCl (đặc) → 2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O (6) NaCl (rắn) + H2SO4 ( đặc) \(\xrightarrow{{{t^0}}}\) Na2SO4 + HCl↑ Vậy các phản ứng sinh ra khí tác dụng được với NaOH là (1), (4), (5), (6) => có 4 khí Đáp án C Câu hỏi 13 : Nhỏ từ từ dung dịch HCl vào dd Na2CO3 khuấy đều, hiện tượng xảy ra là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Ban đầu: H+ + CO32- → HCO3- Sau đó: H+ + HCO3- → CO2 + H2O Đáp án B Câu hỏi 14 : Cho NaOH đến dư vào dung dịch chứa MgSO4, CuSO4, Al2(SO4)3 được kết tủa X. Nung X được chất rắn Y. Cho CO dư đi qua Y nung nóng sẽ thu được chất rắn là
Đáp án: D Phương pháp giải: Các oxit của KL đứng sau Al bị khử bởi CO. Lời giải chi tiết: X: Mg(OH)2, Cu(OH)2 Y: MgO, CuO Chất rắn: MgO, Cu Đáp án D Câu hỏi 15 : Thực hiện các thí nghiệm sau: (I) Cho dung dịch NaCl vào dung dịch KOH (II) Cho dụng dịch Na2CO3 vào dung dịch Ca(OH)2. (III) Điện phân dung dịch NaCl với điện cực trơ, có màng ngăn. (IV) Cho Cu(OH)2 vào dung dịch NaNO3. (V) Sục khí NH3 vào dung dịch Na2CO3. (VI) Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2. Các thí nghiệm điều chế được NaOH là
Đáp án: A Phương pháp giải: Lời giải chi tiết: (I) Không phản ứng (II) Na2CO3 + Ca(OH)2 → NaOH + CaCO3 (III) 2NaCl +2H2O \(\xrightarrow{{dp{\text{dd}}}}\) 2 NaOH + H2 + Cl2 (IV) Không phản ứng (V) Không phản ứng (VI) Na2SO4 + Ba(OH)2 → BaSO4 + 2NaOH Như vậy các thí nghiệm điều chế được NaOH là: II, III và VI Đáp án A Câu hỏi 16 : Những đặc điểm nào sau đây phù hợp với tính chất của muối NaHCO3: (1) Chất lưỡng tính ; (2) Kém bền với nhiệt ; (3) Thuỷ phân cho môi trường kiềm mạnh ; (4) Thuỷ phân cho môi trường kiềm yếu ; (5) Thuỷ phân cho môi trường axit ; (6) Chỉ tác dụng với axit mạnh.
Đáp án: A Phương pháp giải: Lời giải chi tiết: (1) Chất lưỡng tính => đúng (2) Kém bền với nhiệt => đúng 2NaHCO3 Na2CO3 +CO2 +H2O (3) Thuỷ phân cho môi trường kiềm mạnh => sai (4) Thuỷ phân cho môi trường kiềm yếu => đúng HCO3- + H2O \( \rightleftarrows \) OH- + H2CO3 (5) Thuỷ phân cho môi trường axit => sai (6) Chỉ tác dụng với axit mạnh => sai Vậy các đặc điểm phù hợp là 1, 2, 4 Đáp án A Câu hỏi 17 : Dịch vị dạ dày thường có pH trong khoảng từ 2-3. Những người nào bị mắc bệnh viêm loét dạ dày, tá tràng thường có pH < 2. Để chữa căn bệnh này, người bệnh thường uống trước bữa ăn chất nào sau đây ?
Đáp án: A Phương pháp giải: Lời giải chi tiết: Dịch vị dạ dày thường có pH trong khoảng từ 2-3 => có môi trường axit => dùng dung dịch NaHCO3 để trung hòa axit trong dịch vị dạ dày Đáp án A Câu hỏi 18 : Có các nhận xét sau: (a) Kim loại mạnh luôn đẩy kim loại yếu hơn ra khỏi muối của nó (b) Những kim loại như Na, K, Ba, Ca chỉ có thể điều chế bằng cách điện phân nóng chảy (c) Tráng Sn lên sắt để sắt không bị ăn mòn là phương pháp bảo vệ kim loại bằng phương pháp điện hóA. (d) Các kim loại kiềm có cùng kiểu cấu trúc mạng tinh thể (e) Hầu hết các hợp chất của kim loại kiềm đều tan tốt trong nước (f) Các muối của kim loại kiềm đều có môi trường trung tính (g) Kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa Có bao nhiêu nhận xét đúng ?
Đáp án: B Phương pháp giải: Dựa vào kiến thức được học về kim loại để trả lời Lời giải chi tiết: (a) sai vì chỉ có từ kim loại Mg trở về sau trong dãy điện hóa, kim loại đứng trước mới đẩy được kim loại đứng sau ra khỏi dd muối (b) đúng (c) sai vì Sn đứng sau Fe trong dãy điện hóa nên không thể phủ Sn lên Fe để bảo vệ sắt được vì khi bị ăn mòn điện hóa Fe vẫn bị ăn mòn trước (d) đúng, tất cả các kim loại kiềm đều có cấu trúc lập phương tâm khối (e) đúng (f) sai vì vd: Na2CO3 có môi trường bazơ (g) đúng => có 4 nhận xét đúng Đáp án B Câu hỏi 19 : Cho các chất rắn: Al2O3, ZnO, NaOH, Al, Zn, Na2O, K2O, Li, Ba. Chất rắn nào có thể tan hoàn toàn trong dung dịch KOH dư ?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Tất cả các chất rắn Al2O3, ZnO, NaOH, Al, Zn, Na2O, K2O, Li, Ba đều có thể tan được trong KOH dư. + Al2O3, ZnO, Al, Zn: tan do tác dụng với KOH + NaOH, Na2O, K2O, Li, Ba: tan được do nước trong dung dịch KOH Đáp án D Câu hỏi 20 : Cho các dung dịch: NaOH, NaCl, H2SO4, Na2SO4, Ba(OH)2. Chỉ dùng thêm một thuốc thử nào sau đây để nhận biết ?
Đáp án: B Phương pháp giải: Lời giải chi tiết: Ta dùng quỳ tím để nhận biết các chất: - Dùng quỳ tím: + Nhóm I: Quỳ hóa xanh => NaOH, Ba(OH)2 + Nhóm II: Quỳ không đổi màu => NaCl, Na2SO4 + Quỳ hóa đỏ => H2SO4 - Dùng H2SO4 vừa nhận biết ra cho vào từng dung dịch của nhóm I: + Kết tủa trắng => Ba(OH)2 + Không hiện tượng => NaOH - Dùng Ba(OH)2 vừa nhận biết ra cho vào từng dung dịch của nhóm II: + Kết tủa trắng => Na2SO4 + Không hiện tượng => NaCl Đáp án B Câu hỏi 21 : Cho các chất CH2=CH-COOH, C6H5OH, C2H5OH, KOH, Ba(OH)2, Al(OH)3, AlCl3, HCl, BaSO4. Số chất tác dụng được với Na2CO3 là:
Đáp án: C Phương pháp giải: Lý thuyết tính chất hóa học của các chất Lời giải chi tiết: 2CH2=CH-COOH + Na2CO3 → 2CH2=CH-COONa + H2O + CO2 C6H5OH + Na2CO3 → C6H5ONa + NaHCO3 Ba(OH)2 + Na2CO3 → BaCO3 + 2NaOH 2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 6NaCl + 3CO2 2HCl + Na2CO3 → 2NaCl + CO2 + H2O Vậy tất cả có 5 chất phản ứng được với Na2CO3 Đáp án C Câu hỏi 22 : Một học sinh nghiên cứu một dung dịch X đựng trong một lo không dán nhãn và thu được kết quả sau: X có phản ứng với cả 3 dung dịch NaHSO4, Na2CO3 và AgNO3 X không phản ứng với cả 3 dung dịch NaOH, Ba(NO3)2, HNO3 Vậy dung dịch X là dung dịch nào sau đây
Đáp án: A Phương pháp giải: Thử các chất có trong đáp án, chất nào thỏa mãn tính chất đề bài yêu cầu thì chọn Lời giải chi tiết: A đúng vì BaCl2 thỏa mãn hết các tính chất của X B sai vì Mg(NO3)2 không tác dụng với NaHSO4 AgNO3 C sai vì FeCl2 không tác dụng với NaHSO4 D sai vì CuSO4 không tác dụng với NaHSO4 Đáp án A Câu hỏi 23 : Cho dung dịch NaOH vào lượng dư dung dịch chất X, thu được kết tủa màu trắng xanh, sau một thời gian chuyển sang nâu đỏ. Chất X là
Đáp án: D Phương pháp giải: Dựa vào dấu hiệu nhận biết màu sắc các sản phẩm kết tủa. Fe(OH)2 : trắng xanh; Fe(OH)3: nâu đỏ; Mg(OH)2: trắng; Cu(OH)2: xanh Lời giải chi tiết: Chất X là FeCl2 vì FeCl2 +NaOH → Fe(OH)2 (màu trắng xanh) + 2NaCl 4Fe(OH)2 +O2 +2H2O → 4Fe(OH)3 (nâu đỏ) Đáp án D Câu hỏi 24 : Thực hiện các thí nghiệm sau: (I) Cho dung dịch NaCl vào dung dịch KOH. (II) Cho dung dịch Na2CO3 vào dung dịch Ca(OH)2. (III) Điện phân dung dịch NaCl với điện cực trơ, có màng ngăn. (IV) Cho Cu(OH)2 vào dung dịch NaNO3. (V) Sục khí NH3 vào dung dịch Na2CO3. (VI) Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2. Các thí nghiệm đều điều chế được NaOH là
Đáp án: C Phương pháp giải: Lời giải chi tiết: Các thí nghiệm đều điều chế được NaOH là II, III, VI. (II) Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH (III) 2NaCl + 2H2O \(\buildrel {DPNC} \over\longrightarrow \) 2NaOH + H2 + Cl2 (VI) Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH Đáp án C Câu hỏi 25 : Cho dãy các chất: m-CH3COOC6H4CH3; m-HCOOC6H4OH; ClH3NCH2COONH4; p-C6H4(OH)2; p-HOC6H4CH2OH; H2NCH2COOCH3; CH3NH3NO3. Số chất trong dãy mà 1 mol chất đó phản ứng tối đa được với 2 mol NaOH là
Đáp án: B Phương pháp giải: Lời giải chi tiết: m-CH3COOC6H4CH3 + 2NaOH → CH3COONa + m-NaO-C6H4-CH3 + H2O m-HCOOC6H4OH + 3NaOH → HCOONa + m-NaO-C6H4-ONa + 2H2O ClH3NCH2COONH4 + 2NaOH → H2NCH2COONa + NH3 + NaCl + 2H2O p-C6H4(OH)2 + 2NaOH → p-C6H4(ONa)2 + 2H2O p-HOC6H4CH2OH + NaOH → p-NaOC6H4CH2OH + H2O H2NCH2COOCH3 + NaOH → H2NCH2COONa + CH3OH CH3NH3NO3 + NaOH → CH3NH2 + NaNO3 + H2O Vậy có 3 chất thỏa mãn đề bài là: m-CH3COOC6H4CH3; ClH3NCH2COONH4; p-C6H4(OH)2 Đáp án B Câu hỏi 26 : Hỗn hợp X gồm Na2O, BaCl2 và NaHCO3 (có cùng số mol). Cho X vào nước, sau khi kết thúc các phản ứng thu được dung dịch Y. Các chất tan trong Y gồm
Đáp án: C Phương pháp giải: Viết PTHH Lời giải chi tiết: X + H2O thì : Na2O + H2O → 2NaOH NaOH + NaHCO3 → Na2CO3 + H2O Na2CO3 + BaCl2 → BaCO3 + 2NaCl → Y có NaOH dư và NaCl Đáp án C Câu hỏi 27 : Cho từ từ đến dư kim loại Na vào dung dịch có chứa muối FeCl3. Số phản ứng xảy ra là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Thứ tự các phản ứng: Na + H2O → NaOH + ½ H2 3NaOH + FeCl3 → Fe(OH)3 + 3NaCl → Có 2 phản ứng xảy ra Đáp án B Câu hỏi 28 : Cho sơ đồ sau: NaCl → A → Na2CO3 → B → NaCl (với A, B là các hợp chất của natri). A và B lần lượt là
Đáp án: D Phương pháp giải: Lời giải chi tiết: - Na2CO3 không điều chế ra Na2O nên B không thể là Na2O → Loại A và C - Từ NaNO3 không điều chế được trực tiếp ra NaCl → Loại B → A là NaOH; B là Na2SO4 2NaCl + 2H2O \(\xrightarrow[co\,mang\,ngan]{dpdd}\) 2NaOH + H2 + Cl2 2NaOH + CO2 → Na2CO3 + H2O Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2 Na2SO4 + BaCl2 → BaSO4 + 2NaCl Đáp án D Câu hỏi 29 : Cho sơ đồ chuyển hoá sau: \(X\xrightarrow{{(1)}}C{l_2}\xrightarrow{{(2)}}X\xrightarrow{{(3)}}Y\xrightarrow{{(4)}}Z\xrightarrow{{(5)}}X\xrightarrow{{(6)}}NaN{{\text{O}}_3}\). Biết X, Y, Z đều là hợp chất của natri. Công thức hóa học của X, Y, Z lần lượt là
Đáp án: D Phương pháp giải: Dựa vào tính chất của các hợp chất của kim loại kiềm. Lời giải chi tiết: Theo sơ đồ ta có: X: NaCl; Y: NaOH; Z: Na2CO3 Các PTHH: (1) 2NaCl \(\xrightarrow{{dpnc}}\) 2Na + Cl2 (2) 2Na + Cl2 → 2NaCl (3) 2NaCl + 2H2O \(\xrightarrow[{co\,mang\,ngan}]{{dp{\text{dd}}}}\) 2NaOH + Cl2 + H2 (4) 2NaOH + CO2 → Na2CO3 + H2O (5) Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O (6) NaCl + AgNO3 → NaNO3 + AgCl ↓ Đáp án D Câu hỏi 30 : Cho sơ đồ các phản ứng sau: (1) Cu + HNO3 (đặc) → khí X. (2) KNO3 → khí Y. (3) NH4Cl + NaOH → khí Z. (4) CaCO3 → khí T. Cho lần lượt các khí X, Y, Z, T đi chậm qua bình đựng dung dịch NaOH dư. Số khí phản ứng với dung dịch NaOH là
Đáp án: C Phương pháp giải: Dựa vào tính chất hóa học để xác định các khí X, Y, Z, T. Lời giải chi tiết: (1) Cu + 4HNO3 (đặc) → Cu(NO3)2 + 2NO2 (khí X) + 2H2O. (2) 2KNO3 \(\xrightarrow{{{t^0}}}\) 2KNO2 + O2 (khí Y). (3) NH4Cl + NaOH \(\xrightarrow{{{t^0}}}\) NaCl + NH3 (khí Z) + H2O. (4) CaCO3 \(\xrightarrow{{{t^0}}}\) CaCO3 + CO2 (khí T). Cho lần lượt các khí X, Y, Z, T đi chậm qua bình đựng dung dịch NaOH dư thì NO2 và CO2 phản ứng với dung dịch NaOH: 2NaOH + 2NO2 → NaNO2 + NaNO3 + H2O CO2 + 2NaOH → Na2CO3 + H2O Vậy có 2 khí phản ứng với dung dịch NaOH. Đáp án C Câu hỏi 31 : Người ta thực hiện các phản ứng sau : (1) Điện phân NaOH nóng chảy. (2) Điện phân dung dịch NaCl có vách ngăn. (3) Điện phân NaCl nóng chảy. (4) Cho dung dịch NaOH tác dụng với dung dịch HCl. (5) Cho dung dịch NaOH tác dụng với kim loại K. Phản ứng chuyển ion Na+ thành Na là
Đáp án: D Phương pháp giải: Dựa vào phương trình phản ứng của các thí nghiệm. Lời giải chi tiết: Thí nghiệm 1: \(2NaOH\xrightarrow{{dpnc}}2Na + {O_2} + {H_2}\) Thí nghiệm 2: \(2NaCl + 2{H_2}O\xrightarrow[{co\,mang\,ngan}]{{dpdd}}2NaOH + C{l_2} + {H_2}\) Thí nghiệm 3: \(2NaCl\xrightarrow{{dpnc}}2Na + C{l_2}\) Thí nghiệm 4: \(NaOH + HCl \to NaCl + {H_2}O\) Thí nghiệm 5: \(2K + 2{H_2}O \to 2KOH + {H_2}\) Vậy thí nghiệm (1) và (3) chuyển ion Na+ thành Na. Đáp án D Câu hỏi 32 : Có các quá trình sau: 1) Điện phân NaOH nóng chảy. 2) Điên phân dung dịch NaCl có màng ngăn. 3) Điện phân NaCl nóng chảy. 4) Cho NaOH tác dụng với dung dịch HCl. Các quá trình mà ion Na+ bị khử thành Na là
Đáp án: C Phương pháp giải: Viết các PTHH xảy ra, chọn các phản ứng sinh ra kim loại Na Lời giải chi tiết: (1) 2NaOH \(\xrightarrow{{dpnc}}\) 2Na + H2 + O2 (2) 2NaCl + 2H2O \(\xrightarrow{{dpdd.cmn}}\) 2NaOH + Cl2 + H2↑ (3) 2NaCl \(\xrightarrow{{dpnc}}\) 2Na + Cl2 (4) NaOH + HCl → NaCl + H2O Vậy (1) và (3) Na+ bị khử thành Na Đáp án C
Câu hỏi 33 : Cho sơ đồ phản ứng sau: (a) Fe + X1 → FeSO4 + X2 + H2 (b) X1 + X3 → X2 + H2O Biết rằng X1, X2, X3 là các hợp chất của natri. Chất X2 là
Đáp án: A Phương pháp giải: Từ (a) sinh ra H2 nên X1 có tính axit ⟹ X1 Từ (b) ⟹ X3 là hợp chất có tính bazo ⟹ X3, X2 Lời giải chi tiết: Từ (a) sinh ra H2 nên X1 có tính axit ⟹ X1 là NaHSO4 Từ (b) ⟹ X3 là hợp chất có tính bazo ⟹ X3 là NaOH, X2 là Na2SO4 Các PTHH: (a) Fe + 2NaHSO4 → FeSO4 + Na2SO4 + H2 (b) NaHSO4 + NaOH → Na2SO4 + H2O Đáp án A Câu hỏi 34 : M có cấu hình electron ở phân lớp ngoài cùng là 3s1. Nguyên tử M là
Đáp án: A Phương pháp giải: Viết đầy đủ cấu hình electron của M, xác định được vị trí của M trong bảng tuần hoàn và suy ra được tên gọi. STT ô nguyên tố = số p = số e STT chu kỳ = số lớp e Số electron lớp ngoài cùng = số thứ tự nhóm electron cuối cùng điền vào phân lớp s,p thuộc nguyên tố nhóm A; điền vào phân lớp d,f thuộc nguyên tố nhóm B. Lời giải chi tiết: Cấu hình electron đầy đủ của M là: 1s22s22p63s1 → M thuộc ô thứ 11, chu kì 3, nhóm IA → M là Na Đáp án A Câu hỏi 35 : Trong các kim loại: Na, Mg, Al, Fe, Cu. Có bao nhiêu kim loại có thể tan hoàn toàn trong lượng dư dung dịch NaOH?
Đáp án: D Phương pháp giải: Các KL tan được trong NaOH: + KL phản ứng được với H2O tạo hợp chất tan + KL phản ứng được với NaOH tạo hợp chất tan Lời giải chi tiết: Kim loại tan được trong lượng dư dung dịch NaOH là: Na, Al → 2 kim loại 2Na + 2H2O → 2NaOH + H2 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 Đáp án D Câu hỏi 36 : Phát biểu nào sau đây sai?
Đáp án: A Phương pháp giải: Lý thuyết về kim loại kiềm Lời giải chi tiết: A sai vì Na phản ứng với H2O trước tạo thành NaOH, sau đó NaOH tác dụng với FeSO4 2Na + 2H2O → 2NaOH + H2 FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4 B đúng, các kim loại kiềm đều khử được H2O ở nhiệt độ thường C đúng, các kim loại kiềm đều có khối lượng riêng nhỏ D đúng Đáp án A Câu hỏi 37 : Sản phẩm thu được khi điện phân dung dịch KCl (điện cực trơ, màng ngăn xốp) là
Đáp án: D Phương pháp giải: Dựa vào kiến thức được học về điều chế kim loại. Lời giải chi tiết: PTHH: 2KCl + 2H2O \(\xrightarrow{{dien\,phan\,mang\,ngan}}\) 2KOH + H2↑+ Cl2↑ ⟹ sản phẩm thu được gồm: KOH, H2 và Cl2 Đáp án D Câu hỏi 38 : Chất X có vai trò quan trọng trong sản xuất nước Javen. Chất X được gọi là
Đáp án: D Phương pháp giải: Dựa vào kiến thức học trong chương kim loại kiềm và hợp chất của chúng trong sgk hóa 12 Lời giải chi tiết: muối ăn (NaCl) có vai trò quan trọng trong sản xuất nước Javen PTHH minh họa: 2NaCl + H2O \(\xrightarrow{{dp{\text{d}}d\,khong\,mang\,ngan}}\) NaCl + NaClO + H2↑ (dd nước Javen) Đáp án D Câu hỏi 39 : Nước muối sinh lí để sát trùng, rửa vết thương trong y học có nồng độ
Đáp án: A Phương pháp giải: Dựa vào ứng dụng của dung dịch nước muối Lời giải chi tiết: Nước muối sinh lý là hỗn hợp giữa nước và natri clorua được pha chế với tỷ lệ 0,9%, tức 1 lít nước với 9 gam natri clorua tinh khiết Đáp án A Câu hỏi 40 : trong y học, hợp chất nào sau đây của natri được dùng để làm thuốc trị bệnh dạ dày :
Đáp án: B Phương pháp giải: Muối này cần làm giảm axit tiết ra trong dạ dày làm đỡ đau => chọn muối có môi trường azo vừa phải với cơ thể người Lời giải chi tiết: Trong điều trị bệnh dạ dày người ta dùng thuốc chứa NaHCO3 để tác dụng với lượng aXit có trong dạ dày làm giảm bớt H+ gây đau HCO3 - + H+ → Na+ + H2O + CO2 Đáp án B Câu hỏi 41 : Thứ tự tăng dần độ hoạt động hóa học của kim loại kiềm là :
Đáp án: B Phương pháp giải: Sự biến đổi tính chất hóa học trong bảng hệ thống tuần hoàn Lời giải chi tiết: Trong 1 nhóm, từ trên xuống dưới, tính khử của các kim loại tăng dần, tức độ hoạt động hóa học của các kim loại tăng dần. Li < Na < K < Rb < Cs Đáp án B Câu hỏi 42 : Để nhận biết các dung dịch: NaOH, KCl, NaCl, KOH dùng:
Đáp án: C Phương pháp giải: - Chất chưa ion Na : đốt có ngọn lửu màu vàng - Chất chứa ion K : đốt có ngọn lửa màu tím Lời giải chi tiết: Ta nhận biết các chất bằng cách dùng quỳ tím và thử ngọn lửa bằng dây Pt: - Quỳ tím chuyển thành xanh: NaOH, KOH sau đó thử ngọn lửa bằng dây Pt + Ngọn lửa màu vàng => NaOH + Ngọn lửa màu tím => KOH - Quỳ tím không đổi màu: NaCl, KCl sau đó thử ngọn lửa bằng dây Pt + Ngọn lửa màu vàng => NaCl + Ngọn lửa màu tím => KCl Đáp án C Câu hỏi 43 : Phương trình hóa học nào sau đây viết sai?
Đáp án: A Phương pháp giải: Lời giải chi tiết: A. Sai, sửa lại \(2NaHC{O_3}\,\,\buildrel {{t^0}} \over\longrightarrow \,\,N{a_2}C{O_3} + C{O_2} + {H_2}O\) Đáp án A Câu hỏi 44 : Cho 4 dung dịch riêng biệt đựng một trong bốn muối sau: BaCl2, KHCO3, K2CO3 và NaHSO4. Được ký hiệu (không theo thứ tự) là X, Y, Z, T. Hiện tượng khi trộn lần lượt 4 dung dịch được cho dưới bảng sau:
Vậy Z là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: X tạo khí với 2 chất và tạo kết tủa với 1 chất => X là NaHSO4 Y tạo khí với NaHSO4 => Y có thể là KHCO3 hoặc K2CO3 Mà Y tạo kết tủa được với T => Y là K2CO3, T là BaCl2 => Z là KHCO3 Đáp án B Câu hỏi 45 : Cho dãy các chất sau: CO2, CO, SiO2, NaHCO3, NH4Cl. Số chất trong dãy tác dụng với dung dịch NaOH loãng ở nhiệt độ thường là
Đáp án: B Phương pháp giải: Dựa vào lí thuyết tổng hợp các chất vô cơ Lời giải chi tiết: Các chất tác dụng được với dd NaOH ở nhiệt độ thường là: CO2, NaHCO3, NH4Cl => có 3 chất CO2 + 2NaOH → Na2CO3 + H2O NaHCO3 + NaOH → Na2CO3 + H2O NH4Cl + NaOH → NaCl + NH3↑ + H2O Đáp án B Câu hỏi 46 : Cho sơ đồ biến hoá: Na → X → Y → Z → T → Na. Hãy chọn thứ tự đúng các chất X, Y, Z, T
Đáp án: C Phương pháp giải: Lời giải chi tiết: \(Na\xrightarrow{{{H_2}O}}NaOH\xrightarrow{{C{O_2}}}N{a_2}C{O_3}\;\xrightarrow{{{H_2}S{O_4}}}N{a_2}S{O_4}\;\xrightarrow{{BaC{l_2}}}NaCl\;\xrightarrow{{dpnc}}Na\) Đáp án C Câu hỏi 47 : Hỗn hợp X chứa Na2O, NH4NO3, NaHCO3 và Ba(NO3)2 có số mol mỗi chất đều bằng nhau. Cho hỗn hợp X vào H2O (dư), đun nóng, dung dịch thu được chứa
Đáp án: D Phương pháp giải: Các phản ứng xảy ra như sau: Na2O + H2O → 2NaOH NH4NO3 + NaOH → NaNO3 + NH3 +H2O NaHCO3 + NaOH → Na2CO3 + H2O Na2CO3 + Ba(NO3)2 → BaCO3 + 2NaNO3 Lời giải chi tiết: Na2O + H2O →2NaOH x 2x NH4NO3 + NaOH→NaNO3 + NH3 +H2O x x NaHCO3 +NaOH →Na2CO3 + H2O x x x Na2CO3 + Ba(NO3)2 →BaCO3 + 2NaNO3 x x Các phản ứng xảy ra vừa đủ => dd sau phản ứng: NaNO3 Đáp án D Câu hỏi 48 : Cho a mol CO2 vào dung dịch chứa b mol NaOH, thu được dung dịch X. Dung dịch X vừa tác dụng được với HCl vừa tác dụng được với KOH. Quan hệ giữa a và b là
Đáp án: D Phương pháp giải: - Lập tỉ lệ \( \dfrac{{n_{OH^-}}}{{n_{CO_2}}} = T\) - T ≤ 1 thu được muối HCO3- - 1 < T < 2 thu được đồng thời 2 muối HCO3- và CO32- - T ≥ 2 thu được muối CO32- Lời giải chi tiết: Dung dịch X vừa tác dụng được với HCl vừa tác dụng được với KOH => Dung dịch X chứa muối HCO3- => T ≤ 1 hoặc 1 < T < 2 => T < 2 Hay \(\frac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} < 2 \Leftrightarrow \frac{b}{a} < 2\) => b < 2a Đáp án D Câu hỏi 49 : Cho từ từ dung dịch chứa a mol HCl vào dung dịch chứa b mol Na2CO3 đồng thời khuấy đều, thu được khí X và dung dịch Y. Khi cho dư nước vôi trong vào dung dịch Y thấy xuất hiện m gam kết tủa. Biểu thức liên hệ giữa m với a và b là
Đáp án: A Phương pháp giải: - Tính số mol HCO3- - Tính số mol kết tủa Lời giải chi tiết: Khi cho từ từ HCl vào dd Na2CO3 ban đầu xảy ra phản ứng: H+ + CO32- → HCO3- (1) Do thu được khí nên ở (1) thì H+ dư, CO32- hết, ta có thêm phản ứng: H+ + HCO3- → CO2 + H2O (2) Vì dung dịch Y tác dụng với nước vôi trong có kết tủa nên có chứa HCO3-, suy ra ở (2) H+ hết, HCO3- dư. Cho Y tác dụng với nước vôi trong dư thì: Ca2+ + OH- + HCO3- → CaCO3 + H2O (3) Đặt mol vào các PTHH: H+ + CO32- → HCO3- (1) Bđ: a b Pư: b ← b → b Sau: a-b 0 b H+ + HCO3- → CO2 + H2O (2) Bđ: a-b b Pư: a-b → a-b Sau: 0 2b-a Ca2+ + OH- + HCO3- → CaCO3 + H2O (3) 2b-a → 2b-a → mkết tủa = \({m_{CaC{O_3}}}\) = 100(2b-a) (g) Đáp án A Câu hỏi 50 : Cho dãy các chất: FeCl2, CuSO4, BaCl2, KNO3. Số chất trong dãy phản ứng được với dung dịch NaOH là:
Đáp án: C Phương pháp giải: Lý thuyết về hợp chất của kim loại kiềm. Lời giải chi tiết: Các chất trong dãy phản ứng được với dung dịch NaOH là FeCl2, CuSO4 (có 2 chất): 2NaOH + FeCl2 → Fe(OH)2 ↓ + 2NaCl 2NaOH + CuSO4 → Cu(OH)2 ↓ + Na2SO4 Đáp án C Quảng cáo
|
















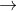 BaSO4¯ trắng + 2KOH
BaSO4¯ trắng + 2KOH