30 bài tập vận dụng về kim loại kiềm thổ và hợp chất có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Hoà tan hoàn toàn một lượng Ba vào dung dịch chứa a mol HCl thu được dung dịch X và a mol H2. Trong các chất sau: Na2SO4, Na2CO3,Al, Al2O3, AlCl3, Mg, NaOH, NaHCO3. Số chất tác dụng được với dung dịch X là
Đáp án: C Phương pháp giải: Lời giải chi tiết: nHCl = nH2 ; nH2 do HCl = ½ nHCl => có Ba(OH)2 ; BaCl2 Các chất phản ứng : Na2SO4 ; Na2CO3 ; Al ; Al2O3 ; AlCl3 ; NaHCO3 Đáp án C Câu hỏi 2 : Cho 6,88 gam hỗn hợp X gồm Mg và MgO vào dung dịch HCl dư, khi phản ứng xảy ra hoàn toàn thu đợc dung dịch Y và thoát ra 2,688 lít khí ( đo ở đktc). Khối lượng của MgO có trong 6,88 gam hỗn hợp X là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án A Ta có : \(n({H_2}O) = 0,12mol,\,MgO + 2HCl\xrightarrow{{}}MgC{l_2} + {H_2}O\) $Mg + 2HCl\xrightarrow{{}}MgC{l_2} + {H_2} \Rightarrow n(Mg) = n({H_2}) = 0,12 \Rightarrow m(Mg) = 2,88gam \Rightarrow m(MgO) = 4$ Câu hỏi 3 : Nung 13,4 gam hỗn hợp hai muối cacbonat của hai kim loại thuộc hai chu kì liên tiếp trong nhóm IIA thu đưuọc 6,8 gam hai oxit. Công thức của muối và phần trăm khối lượng mỗi muối trong hỗn hợp là
Đáp án: A Phương pháp giải: + Bảo toàn khối lượng Lời giải chi tiết: Gọi CT chung của 2 muối là:\(\overline M C{O_3}\) BTKL: mCO2 = mhh muối – moxit = 13,4 – 6,8 = 6,6 (mol) => nCO2 = 0,15 (mol) \(\begin{gathered} => 2 kim loại là Mg và Ca MgCO3: x mol; CaCO3 : y mol ∑ nCO2 = x + y = 0,15 ∑ m hh muối = 84x + 100y = 13,4 => x = 0,1 ; y = 0,05 % mMgCO3 = (0,1.84 : 13,4).100% = 62,69% => % mCaCO3 = 37,31% Đáp án A Câu hỏi 4 : Một cốc nước cứng có chứa 0,1 mol Ca2+ a mol K+; 0,15 mol Cl- và b mol HCO3-. Thêm vào cốc 0,1 mol Ca(OH)2 thì mất hoàn toàn tính cứng, dung dịch trong cốc nước chỉ chứa duy nhất một muối. Đun sôi cốc nước cứng trên đến cạn thu được lượng chất rắn khan là:
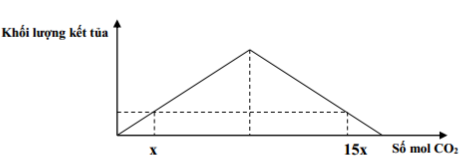
Đáp án: B Phương pháp giải: + Bảo toàn điện tích + Viết phương trình ion rút gọn Lời giải chi tiết: Bảo toàn điện tích: 2nCa2+ + nK+ = nCl- + nHCO3- => 0,2 + a = 0,15 + b => b – a = 0,05 ( mol) (1) Thêm vào cốc 0,1 mol Ca(OH)2 thì dung dịch thu được chỉ chứa 1 muối duy nhất => muối đó là KCl => nK+ = nCl- = 0,15 (mol) = a Từ (1) => b = nHCO3- = 0,05 + 0,15 = 0,2 (mol) Khi đun sôi nước cứng trên thì: 2HCO3- → CO32- + CO2 + H2O 0,2 → 0,1 (mol) => nCO3 2- = 0,1 (mol) => mrắn = mCa2+ + mCO32- + mK+ + mCl- = 0,1. 40 + 0,1.60 + 0,15.39 + 0,15. 35,5 = 21,175 (g) Đáp án B Câu hỏi 5 : Hòa tan hoàn toàn 11,2 gam CaO và H2O dư thu được dung dịch X. Sục từ từ khí CO2 vào dung dịch X, qua quá trình khảo sát người ta lập được đồ thị như sau:
Giá trị của x là:
Đáp án: A Phương pháp giải: - Bài toán cho CO2 hấp thụ vào dd Ca(OH)2 tại 2 số mol CO2 khác nhau cùng thu được 1 lượng kết tủa sẽ xảy ra 2 trường hợp sau: +TH1: Lượng CO2 ít, chỉ xảy ra pư tạo muối trung hòa. Tính toán theo nCO2 Ca(OH)2 + CO2 → CaCO3 + H2O +TH2: Lượng CO2 nhiều => tạo muối trung hòa, sau đó muối bị hòa tan 1 phần. CO2 và Ca(OH)2 đều pư hết Ca(OH)2 + CO2 → CaCO3 + H2O Ca(OH)2 + 2CO2 → Ca(HCO3)2 Tính toán theo nCO2 và nCaCO3 Lời giải chi tiết: CaO + H2O → Ca(OH)2 => nCa(OH)2 = nCaO = 11,2 : 56 = 0,2 (mol) Từ đồ thị ta thấy: + Tại thời điểm số mol CO2 bằng x và 1,5x thu được lượng kết tủa như nhau => TH1: nCO2 = x ( mol) xảy ra trường hợp chỉ tạo muối trung hòa, CO2 hết, Ca(OH)2 dư. Tính toán theo số mol CO2 Ca(OH)2 + CO2 → CaCO3 + H2O x → x (mol) TH2: nCO2 = 1,5x (mol) xảy ra trường hợp tạo 2 muối, CO2 và Ca(OH)2 đều phản ứng hết. Lượng CaCO3 thu được bằng với TH1 Ca(OH)2 + CO2 → CaCO3 + H2O x ← x ← x Ca(OH)2 + 2CO2 → Ca(HCO3)2 7x ←(15x – x) ∑ nCa(OH)2 = x + 7x = 0,2 (mol) => x = 0,025 (mol) Đáp án A Câu hỏi 6 : Hòa tan hoàn toàn 2,45 gam hỗn hợp X gồm hai kim loại kiềm thổ vào 200 ml dung dịch HCl 1,25M, thu được dung dịch Y chứa các chất tan có nồng độ mol bằng nhau. Hai kim loại trong X là:
Đáp án: D Phương pháp giải: Với bài toán này ta chia thành 2 trường hợp: - Trường hợp 1: HCl phản ứng hết thì chất tan chỉ chứa là 2 muối clorua của 2 kim loại kiềm thổ. - Trường hợp 2: HCl còn dư thì chất tan chứa 2 muối clorua và HCl dư Lời giải chi tiết: Với bài toán này ta chia thành 2 trường hợp: - Trường hợp 1: HCl phản ứng hết thì chất tan chỉ chứa là 2 muối clorua của 2 kim loại kiềm thổ. Gọi kim loại tương đương với 2 kim loại trên là R R + 2HCl → RCl2+ H2 Ta có: nR = ½ . nHCl = ½ . 0,25 = 0,125 mol → MR = mR/ nR = 2,45: 0,125 = 19,6 g/mol Mà số mol của 2 muối này bằng nhau nên tổng khối lượng mol của 2 kim loại này bằng 19,6.2 =39,2 → Loại - Trường hợp 2: HCl còn dư thì chất tan chứa 2 muối clorua và HCl dư Gọi 2 kim loại là A, B A + 2HCl → ACl2+ H2 B + 2HCl → BCl2+ H2 dung dịch Y chứa các chất tan có nồng độ mol bằng nhau → Số mol của các chất tan này bằng nhau → nAcl2 = nBCl2 = nHCl dư = x mol → nHCl = 2.nAcl2+ 2.nBCl2+ nHCl dư = 2x+ 2x + x = 5x = 0,2.1,25 = 0,25 mol nên x = 0,05 mol → mkim loại = a.x + b.x = 2,45 gam → A+ B = 2,45: 0,05 = 49 →A là Ca (40) và B là Be (9) Đáp án D Câu hỏi 7 : Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước, thu được 1,12 lít khí H2 (đktc) và dung dịch Y chứa 20,52 gam Ba(OH)2. Cho Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M, thu được m gam kết tủa. Giá trị của m là:
Đáp án: B Phương pháp giải: Dùng phương pháp quy đổi để quy hỗn hợp thành Na, Ba và O. Vận dụng định luật bảo toàn e và bảo toàn khối lượng để tìm số mol Na, Ba, O. Từ đó tính được nOH-. Viết các phương trình xảy ra và tính theo phương trình. Lời giải chi tiết: Dùng phương pháp quy đổi để quy hỗn hợp thành Na, Ba và O. Bảo toàn nguyên tố Ba ta có: nBa = nBa(OH)2 = 0,12 mol Áp dụng định luật bảo toàn electron ta có: nNa+ 2.nBa = 2.nO+ 2.nH2 => nNa+ 2. 0,12 = 2.nO+ 2. 0,05 Mặt khác mX = mNa+ mBa+ mO = 23.nNa+ 137. 0,12 + 16.nO = 21,9 gam Giải hệ trên ta có: nNa = 0,14 mol và nO = 0,14 mol Ta có: nOH- = nNa+ 2.nBa = 0,14 + 2. 0,12 = 0,38 mol; nAl2(SO4)3 = 0,05 mol Al3+ + 3OH- → Al(OH)3 0,1 0,3 0,1 Al(OH)3 + OH- → AlO2-+ 2H2O 0,08← 0,08 Vậy nAl(OH)3 còn lại = 0,1 – 0,08 = 0,02 mol Ba2+ + SO42- → BaSO4 0,12 0,15 0,12 mol Vậy sau phản ứng thu được kết tủa gồm 0,02 mol Al(OH)3 và 0,12 mol BaSO4 → m = 0,02.78 + 0,12.233 = 29,52 gam Đáp án B Câu hỏi 8 : Điện phân dung dịch NaCl (điện cực trơ, màng ngăn xốp), thu được dung dịch X. Hấp thụ CO2 dư vào X, thu được dung dịch chất Y. Cho Y tác dụng với Ca(OH)2 theo tỉ lệ mol 1:1, tạo ra chất Z tan trong nước. Chất Z là:
Đáp án: C Phương pháp giải: Viết PTHH của từng phản ứng từ đó xác định được chất Z. Lời giải chi tiết: 2NaCl + 2H2O 2NaOH + Cl2+ H2 Dung dịch X chứa NaOH CO2+ NaOH → NaHCO3 (Y) NaHCO3 + Ca(OH)2 → CaCO3↓ + NaOH+ H2O Chất tan Z tan trong nước là NaOH. Đáp án C Câu hỏi 9 : Cho m gam Ca vào 500 ml dung dịch chứa NaHCO3 1M và CaCl2 0,5M. Sau khi phản ứng xảy ra hoàn toàn thu được 40 gam kết tủa. Giá trị của m là:
Đáp án: D Phương pháp giải: Ta thấy nCaCO3 = 0,4 mol < nHCO3- → Lượng Ca cho vào tạo thành Ca(OH)2 chỉ đủ để phản ứng với 0,4 mol HCO3- → nCa = nCa(OH)2 = nHCO3- : 2 → m Lời giải chi tiết: Ta thấy nCaCO3 = 0,4 mol < nHCO3- → Lượng Ca cho vào tạo thành Ca(OH)2 chỉ đủ để phản ứng với 0,4 mol HCO3- → nCa = nCa(OH)2 = nHCO3- : 2 = 0,4 : 2 = 0,2 mol → m = 0,2.40 = 8,0 gam Đáp án D Câu hỏi 10 : Hấp thụ hết 0,672 lít khí CO2 (đktc) vào bình chứa 2 lít dung dịch Ca(OH)2 0,01M. Thêm tiếp 0,4 gam NaOH vào bình này, sau khi các phản ứng xảy ra hoàn toàn thu được số gam kết tủa là:
Đáp án: B Phương pháp giải: Coi như sục CO2 vào hỗn hợp Ca(OH)2 và NaOH Bài toán CO2 tác dụng với dung dịch kiềm: Tính tỉ lệ: \(\frac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}}(*)\) + (*) ≥ 2 => Chỉ tạo muối CO32- + 1 < (*) < 2 => Tạo muối CO32- và HCO3- + (*) ≤ 1 => Chỉ tạo muối HCO3- Tính được nCO32-. So sánh nCO32- và nCa2+ suy ra số mol CaCO3 Lời giải chi tiết: nOH- = 2nCa(OH)2 + nNaOH = 2.0,02 + 0,01 = 0,05 mol nCO2 = 0,03 mol 1 < nOH- : nCO2 = 0,05 : 0,03 = 1,67 < 2 => Tạo muối CO32- và HCO3- Đặt nCO32- = x và nHCO3- = y (mol) BTNT “C”: nCO2 = nCO32- + nHCO3- => x + 2y = 0,03 (1) BTĐT: 2nCO32- + nHCO3- = 2nCa2+ + nNa+ => 2x + y = 0,02.2 + 0,01 (2) Giải (1) và (2) được x = 0,02 và y = 0,01 nCa2+ = nCO32- = 0,02 mol => nCaCO3 = 0,02 mol => mCaCO3 = 2 gam Đáp án B Câu hỏi 11 : Trên đĩa thăng bằng có hai cốc: - Cho vào cốc bên trái 12 gam Mg. - Cho vào cốc bên phải 26,94 gam MgCO3, cân mất thăng bằng. Muốn cân trở lại thăng bằng phải thêm vào cốc đựng Mgbao nhiêu gam dung dịch HCl 14,6%.
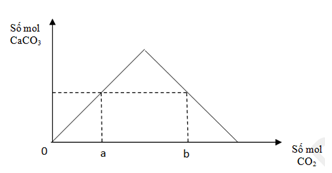
Đáp án: D Phương pháp giải: Để cân thăng bằng thì ta cần thêm dd HCl vào bên trái sao cho m trái = 26,94 gam Đặt nHCl = x mol => nH2 = 0,5x mol => mHCl theo x => m dd HCl theo x m trái = mMg + m dd HCl – mH2 => x => m dd HCl Lời giải chi tiết: Để cân thăng bằng thì ta cần thêm dd HCl vào bên trái sao cho m trái = 26,94 gam Đặt nHCl = x mol => nH2 = 0,5x mol mHCl = 36,5x gam => m dd HCl = 36,5x.(100/14,6) = 250x gam m trái = 12 + m dd HCl – mH2 => 26,94 = 12 + 250x – 2.0,5x => x = 0,06 mol => m dd HCl = 150x = 15 gam Đáp án D Câu hỏi 12 : Từ hai muối X, Y thực hiện các phản ứng sau: X → X1 + CO2; X1 + H2O → X2 X2 + Y → X + Y1 + H2O; X2 + 2Y → X + Y2 + 2H2O Hai muối X, Y tương ứng là
Đáp án: A Phương pháp giải: Suy luận X phải là muối dễ dàng bị nhiệt phân tạo ra CO2 => nghĩ ngay đến muối cacbonat Suy luận X2 phải là dd bazo tan Y phản ứng được với X2 tỉ lệ 1: 1 và tỉ lệ 1:2 => Y là muối axit Lời giải chi tiết: X là CaCO3; Y là NaHCO3 \(\eqalign{ Đáp án A Câu hỏi 13 : Thổi từ từ khí CO2 đến dư vào dung dịch chứa 0,12 mol Ca(OH)2. Sự phụ thuộc của số mol kết tủa thu được vào số mol CO2 phản ứng được biểu diễn theo đồ thị bên.
Mối quan hệ giữa a, b là
Đáp án: A Phương pháp giải: Dựa vào kĩ năng quan sát đồ thị Ta thấy tại nCO2 = a (mol) và nCO2 =b (mol) cùng thu được 1 lượng kết tủa CaCO3 Xét tại nCO2 = b (mol) => xảy ra trường hợp kết tủa tạo cực đại, sau đó tan 1 lượng còn đúng a (mol) PTHH xảy ra: CO2 + Ca(OH)2 → CaCO3↓ + H2O (1) CO2 + CaCO3 → Ca(HCO3)2 (2) Lập phương trình với tổng mol CO2 theo phương trình và theo đề bài cho sẽ ra được mối liên hệ giữa a và b Lời giải chi tiết: Từ đồ thị ta thấy: Tại nCO2 = a(mol), đồ thị đi lên => chỉ xảy ra pư tạo kết tủa CaCO3, lúc này CO2 pư hết, Ca(OH)2 pư dư. Mọi tính tóa theo số mol của CO2. CO2 + Ca(OH)2 → CaCO3↓ + H2O. a → a (mol) Ta thấy tại giá trị nCO2 = b (mol) và nCO2 = a (mol) cùng thu được 1 lượng kết tủa CaCO3 => Tại nCO2 = b(mol) thu được nCaCO3 = a (mol). Vì tại nCO2 = b (mol) ta thấy đồ thị đi lên cực đại rồi lại đi xuống => kết tủa sinh ra cực đại sau đó hòa tan 1 lượng còn a (mol) CO2 + Ca(OH)2 → CaCO3↓ + H2O (1) 0,12← 0,12 → 0,12 (mol) CO2 + CaCO3 → Ca(HCO3)2 (2) 0,12-a← (0,12-a) (mol) Tổng mol CO2 pư ở (1) và (2) là: ∑ nCO2(1+2) = 0,12 + 0,12 –a => b = 0,24 –a Đáp án A Câu hỏi 14 : Cho 3,6 gam Mg tác dụng hết với dung dịch HNO3 (dư), sinh ra V lít khí NO (ở đktc, sản phẩm khử duy nhất của N+5). Giá trị của V là
Đáp án: B Phương pháp giải: Mg0 → Mg+2 + 2e N+5 +3e → N+2 BT electron: n e cho = n e nhận => 2nMg = 3nNO => nNO Lời giải chi tiết: nMg = 3,6 : 24 = 0,15 mol Mg0 → Mg+2 + 2e N+5 +3e → N+2 BT electron: n e cho = n e nhận => 2nMg = 3nNO => nNO = 2.nMg/3 = 2.0,15/3 = 0,1 mol => V = 2,24 lít Đáp án B Câu hỏi 15 : Hòa tan 1,8g muối sunfat khan của một kim loại hóa trị II trong nước, rồi thêm nước cho đủ 50 ml dung dịch. Để phản ứng với 10 ml dung dịch cần vừa đủ 20 ml dung dịch BaCl2 0,15M. Công thức hóa học của muối sunfat là:
Đáp án: C Phương pháp giải: Tính toán theo phương trình phản ứng Chú ý lượng dung dịch phản ứng với BaCl2 và lượng dung dịch ban đầu khác nhau => cần tính toán thể tích dung dịch phản ứng với BaCl2 theo qui tắc tam suất Lời giải chi tiết: Gọi kim loại hóa trị II là M 10 ml dung dịch muối MSO4 phản ứng với 20 ml dung dịch BaCl2 => 50 ml dung dịch muối MSO4 phản ứng với 100 ml dung dịch BaCl2 => nBaCl2 = 0,1.0,15 = 0,015 mol MSO4 + BaCl2 → BaSO4 + MCl2 Mol 0,015 => MMSO4 = 1,8 : 0,015 = 120 g/mol = M + 96 => M = 24 g/mol (Mg) Đáp án C Câu hỏi 16 : Cho 10 ml dung dịch muối Canxi tác dụng với lượng dư dung dịch Na2CO3, lọc lấy kết tủa nung đến khối lượng không đổi thu được 0,28g chất rắn. Nồng độ mol của ion canxi trong dung dịch ban đầu là:
Đáp án: A Phương pháp giải: Tính toán theo phương trình phản ứng Chất rắn cuối cùng khi nhiệt phân là CaO chứ không phải là CaCO3. Lời giải chi tiết: Ca2+ + CO32- → CaCO3↓ CaCO3 \(\buildrel {{t^0}} \over\longrightarrow \) CaO + CO2 ↑ (nCaO = 0,28 : 56 = 0,005 mol) => nCa2+ = nCaCO3 = nCaO = 0,005 mol => CM (Ca2+) = 0,005 : 0,01 = 0,5M Đáp án A Câu hỏi 17 : Cho 34,9 gam hỗn hợp gồm CaCO3, KHCO3 và KCl tác dụng hết với 400 ml dung dịch HCl 1M, thu được dung dịch Y và 4,48 lít khí Z (đktc). Cho Y tác dụng hoàn toàn với lượng dư dung dịch AgNO3, thu được m gam kết tủa. giá trị của m là
Đáp án: D Phương pháp giải: BTNT "C": ∑nCaCO3+ KHCO3 = nCO2 = 0,2 (mol) BTKL ta có: mKCl = 34,9 - mCaCO3+ KHCO3 = ? (g) Khi cho dd Y tác dụng với AgNO3 có pu Cl- + Ag+ → AgCl↓ m↓ = mAgCl =? Lời giải chi tiết: nHCl = 0,4.1 = 0,4 (mol) ; nCO2(đktc) = 4,48 :22,4 = 0,2 (mol) BTNT "C": ∑nCaCO3+ KHCO3 = nCO2 = 0,2 (mol) BTKL ta có: mKCl = 34,9 - mCaCO3+ KHCO3 = 34,9 - 0,2.100 = 14,9 (g) => nKCl = 14,9 : 74,5 = 0,2 (mol) Dung dịch Y chứa Ca2+, K +, Cl-: 0,6 (mol) (Do bảo toàn nguyên tố Cl trong HCl và KCl) Khi cho dd Y tác dụng với AgNO3 có pu Cl- + Ag+ → AgCl↓ 0,6 → 0,6 (mol) => Khối lượng kết tủa là: mAgCl = 0,6.143,5 = 86,1 (g) Đáp án D Câu hỏi 18 : Cho các phát biểu sau: (a) Để loại bỏ lớp cặn CaCO3 trong ấm đun nước, phích đựng nước nóng người ta có thể dùng giấm ăn. (b) Để hàn gắn đường ray bị nứt, gãy người ta dùng hỗn hợp tecmit. (c) Để bảo vệ nồi hơi bằng thép, người ta thường lót dưới đáy nồi hơi những tấm kim loại bằng kẽm. (d) Hơp kim Na - K có nhiệt độ nóng chảy thấp, thường được dùng trong các thiết bị báo cháy. (e) Để bảo quản thực phẩm nhất là rau quả tươi, người ta có thể dùng SO2. Số phát biểu đúng là
Đáp án: C Phương pháp giải: dựa vào kiến thức lí thuyết về vô cơ Lời giải chi tiết: (a) đúng vì giấm ăn là dd CH3COOH từ 2-5% có thể loại bỏ được lớp cặn CaCO3 trong ấm theo PT CaCO3↓ + CH3COOH → (CH3COO)2Ca + H2O (b) đúng, hỗn hợp tecmit là hỗn hợp Al và FeO (c) đúng, vì nồi hơi bằng thép (hợp kim Fe và C) lót dưới đáy nồi miếng kim loại Zn để khi hiện tượng ăn mòn xảy ra thì Zn bị ăn mòn trước, tránh cho thép không bị ăn mòn (d) đúng (e) đúng Khí SO2 là một chất khử với tác dụng chống oxy hóa. Có hai phương pháp bảo quản rau quả sau khi thu hoạch bao gồm: sunfit hóa khí và sunfit hóa ướt + Sunfit hóa khí: SO2 được nạp vào bình chứa và được phun trực tiếp vào sản phẩm rau quả cần bảo quản. Phương pháp này khá tốn sức lao động và cần nhiều thùng chứa nên khá tốn kém. + Sunfit ướt: SO2 sẽ được nạp trực tiếp từ bình thép hoặc được điều chế bằng cách đốt lưu huỳnh trong phòng. Nhờ vậy khí SO2 sẽ chiếm đầy thể tích phòng và thấm vào bề mặt quả để phát huy tác dụng sát trùng. Đáp án C Câu hỏi 19 : Nhúng thanh Mg vào dung dịch chứa 0,1 mol muối sunfat trung hòa của một kim loại M, sau phản ứng hoàn toàn lấy thanh Mg ra thấy khối lượng thanh Mg tăng 4,0 gam. Phần trăm khối lượng của M trong oxit cao nhất là
Đáp án: D Phương pháp giải: Đặt hóa trị của M là n PTHH: nMg + M2(SO4)n → nMgSO4 + 2M↓ Sử dụng phương pháp tăng giảm khối lượng, suy ra được mối quan hệ M và n Lời giải chi tiết: nMg + M2(SO4)n → nMgSO4 + 2M↓ 0,1n ← 0,1 → 0,2 (mol) Khối lượng thanh Mg tăng = mM sinh ra - mM phản ứng => 4 = 0,2M - 0,1n.24 => M = 20 +12n Vì hóa trị của kim loại thường là 1,2, 3 nên chạy ta được n = 3 => M =56 (Fe) thỏa mãn Công thức oxit cao nhất của Fe với O là Fe2O3 \(\% Fe = {{56 \times 2} \over {56 \times 2 + 16 \times 3}}.100\% = 70\% \) Đáp án D Câu hỏi 20 : Cho 6,4 gam hỗn hợp 2 kim loại kế tiếp thuộc nhóm IIA của bảng tuần hoàn tác dụng với dung dịch H2SO4 loãng dư thu được 4,48 lít khí H2 (đktc). Hai kim loại đó là
Đáp án: D Phương pháp giải: Bảo toàn electron ta có: 2nKL = 2nH2 => nKL = nH2 => Mtb = m : nKL Dựa vào dữ kiện 2 kim loại kế tiếp trong nhóm IIA suy ra 2 KL. Lời giải chi tiết: Bảo toàn electron ta có: 2nKL = 2nH2 => nKL = nH2 = 4,48/22,4 = 0,2 mol => Mtb = 6,4 : 0,2 = 32 Mà 2 kim loại kế tiếp trong nhóm IIA nên 2 kim loại đó là Mg (M = 24) và Ca (M = 40) Đáp án D Câu hỏi 21 : Cho 21,6 gam bột Mg tan hết trong dung dịch hỗn hợp gồm NaNO3 và NaHSO4 thu được dung dịch X chỉ chứa m gam hỗn hợp muối trung hòa và 5,6 lít hỗn hợp khí Y gồm N2O và H2( tỉ khối của Y so với H2 là 13,6). Giá trị gần nhất của m là
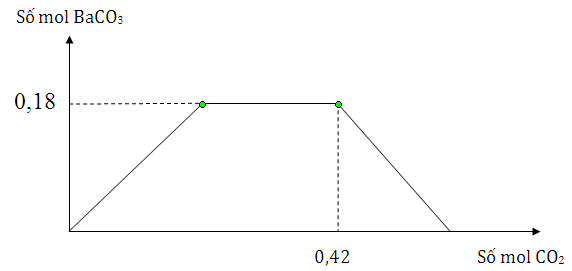
Đáp án: C Phương pháp giải: Xét hỗn hợp khí Y có N2O : x mol và H2 : y mol Có nY = x + y mol và mY = MY . nY = 44a + 2y => giải được x và y Xét phản ứng Mg tác dụng với NaNO3 và NaHSO4 thì 4Mg + 10H+ + 2NO3- → 4Mg+2 + 5H2O + N2O Mg +2H+ → Mg+2 + H2 So sánh 4nN2O + nH2 với nMg nếu nhỏ hơn thì phản ứng có tạo ra NH4+ : 4Mg + 10H+ + NO3- → 4Mg+2 + 3H2O + NH4+ Bảo toàn nguyên tố N có nNaNO3 Bảo toàn nguyên tố H có nNaHSO4 => các ion trong X => mmuối = mion Lời giải chi tiết: Xét hỗn hợp khí Y có N2O : x mol và H2 : y mol Có nY = 0,25 = x + y mol Và mY = MY . nY = 13,6.2.0,25 = 6,8 g = 44x + 2y Nên x = 0,15 mol và y = 0,1 mol Xét phản ứng Mg tác dụng với NaNO3 và NaHSO4 thì 4Mg + 10H+ + 2NO3- → 4Mg+2 + 5H2O + N2O Mg +2H+ → Mg+2 + H2 Ta có 4nN2O + nH2 = 4.0,15 + 0,1 = 0,7 mol < nMg = 0,9 nên phản ứng có tạo ra NH4+ : 4Mg + 10H+ + NO3- → 4Mg+2 + 3H2O + NH4+ nên nNH4+ = (0,9 – 0,7 ) : 4 =0,05 mol Bảo toàn nguyên tố N có nNaNO3 = 2nN2O + nNH4 =2.0,15 + 0,05 = 0,35 mol Bảo toàn nguyên tố H có nNaHSO4 = 10nN2O + 2nH2 + 10nNH4 = 10.0,15 + 0,1.2 + 0,05.10 = 2,2 mol Sau phản ứng dung dịch X thu được có Mg+2 : 0,9 mol; NH4+ : 0,05 mol; Na+ : 2,55 mol và SO42- : 2,2 mol => mmuối = mion = 0,9.24 + 0,05.18 + 2,55.23 + 2,2.96 = 292,35 Đáp án C Câu hỏi 22 : Cho m gam hỗn hợp Na và Ba vào nước dư, thu được dung dịch X và V lít khí H2 đktc. Sục khí CO2 từ từ đến dư vào dung dịch X, lượng kết tủa thể hiện trên đồ thị sau Giá trị của m và V lần lượt là
Đáp án: B Phương pháp giải: PTHH: Na + H2O → NaOH + ½ H2 Ba + 2H2O → Ba(OH)2 + H2 Dd X chứa NaOH và Ba(OH)2 CO2 + OH- → CO32- + H2O CO32- + CO2 +H2O → 2HCO3- Ba2+ + CO32- → BaCO3 Xét đồ thị nBaCO3 max = 0,18 mol → nBa Tại thời điểm CO2 là 0,42 mol thì lượng kết tủa bắt đầu giảm dần → khi đó sản phẩm chỉ có BaCO3 và NaHCO3 → bảo toàn C tính ra NaHCO3 → số mol Na Lời giải chi tiết: PTHH: Na + H2O → NaOH + ½ H2 Ba + 2H2O → Ba(OH)2 + H2 Dd X chứa NaOH và Ba(OH)2. Cho CO2 vào dung dịch X xảy ra pư CO2 + OH- → CO32- + H2O CO32- + CO2 +H2O → 2HCO3- Ba2+ + CO32- → BaCO3 Xét đồ thị nBaCO3 max = 0,18 mol nên nBa = nBaCO3 max = 0,18 mol Tại thời điểm CO2 là 0,42 mol thì lượng kết tủa bắt đầu giảm dần → khi đó sản phẩm chỉ có BaCO3 : 0,18 mol và NaHCO3 : x mol Bảo toàn C có 0,42 = 0,18 + x nên x = 0,24 mol Bảo toàn Na có nNa ban đầu = nNaHCO3 = 0,24 mol → m = mBa + mNa = 0,18.137 + 0,24.23 = 30,18 g Theo PTHH thì nH2 = ½ . nNa + nBa = ½ . 0,24 + 0,18 = 0,3 mol → V =0,3.22,4 =6,72 lít Đáp án B Câu hỏi 23 : Cho 200 ml dung dịch Ba(OH)2 0,1M vào 300 ml dung dịch NaHCO3 0,1M, thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 0,25M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Biết các phản ứng xảy ra hoàn toàn. Giá trị của V là
Đáp án: A Phương pháp giải: OH- + HCO3- → CO32- + H2O Ba2+ + CO32- → BaCO3↓ Khi thêm từ từ HCl vào thì xảy ra pư theo thứ tự: H+ + OH- → H2O H+ + CO3- → HCO3- Khi bắt đầu sinh khí thì nH+ = nOH- + nCO32- Lời giải chi tiết: nBa(OH)2 = 0,02 mol và nNaHCO3 = 0,03 mol OH- + HCO3- → CO32- + H2O Bđ: 0,04 0,03 Pư: 0,03 ← 0,03 → 0,03 Sau: 0,01 0 0,03 Ba2+ + CO32- → BaCO3↓ Bđ: 0,02 0,03 Pư: 0,02 → 0,02 → 0,02 Sau: 0 0,01 0,02 Vậy dung dịch X gồm: Na+ (0,03 mol); OH- (0,01 mol) và CO32- (0,01 mol) Khi thêm từ từ HCl vào thì xảy ra pư theo thứ tự: H+ + OH- → H2O H+ + CO3- → HCO3- Khi bắt đầu sinh khí thì nH+ = nOH- + nCO32- = 0,01 + 0,01 = 0,02 mol V = 0,02 : 0,25 = 0,08 lít = 80 ml Đáp án A Câu hỏi 24 : Hỗn hợp X gồm MgCO3 và CaCO3. Cho m gam X vào 500 ml dung dịch HCl 1,2M. Sau khi phản ứng xảy ra hoàn toàn thu được 4,48 lít CO2 (đktc) và dung dịch Y chứa m1 gam chất tan. Giá trị của m1 nằm trong khoảng nào sau đây ?
Đáp án: C Phương pháp giải: Xét các trường hợp sau và tính chất tan trong dung dịch ở mỗi trường hợp: *Nếu hỗn hợp chỉ chứa MgCO3 *Nếu hỗn hợp chứa CaCO3 Khối lượng chất tan thu được sẽ nằm trong khoảng giá trị chất tan của 2 trường hợp. Chú ý: Chất tan chứa HCl dư. Lời giải chi tiết: nHCl = 1,2.0,5 = 0,6 mol ; nCO2 = 4,48 : 22,4 = 0,2 mol *Nếu hỗn hợp chỉ chứa MgCO3: MgCO3 + 2HCl → MgCl2 + H2O + CO2 0,2 ← 0,4dư 0,2 ← 0,2 ← 0,2 => Dung dịch thu được gồm có: MgCl2 (0,2 mol) và HCl dư (0,2 mol) => m chất tan = 0,2.95 + 0,2.36,5 = 26,3 gam *Nếu hỗn hợp chứa CaCO3: CaCO3 + 2HCl → CaCl2 + H2O + CO2 0,2 ← 0,4dư 0,2 ← 0,2 ← 0,2 => Dung dịch thu được gồm có: CaCl2 (0,2 mol) và HCl dư (0,2 mol) => m chất tan = 0,2.111 + 0,2.36,5 = 29,5 gam Vậy 26,3 < m1 < 29,5 Đáp án C Câu hỏi 25 : Hòa tan hết 30,0 gam hỗn hợp gồm Mg và MgCO3 trong dung dịch HCl dư, sau phản ứng thu được hỗn hợp khí X và dung dịch chứa 47,5 gam muối. Tỉ khối của X so với hidro là
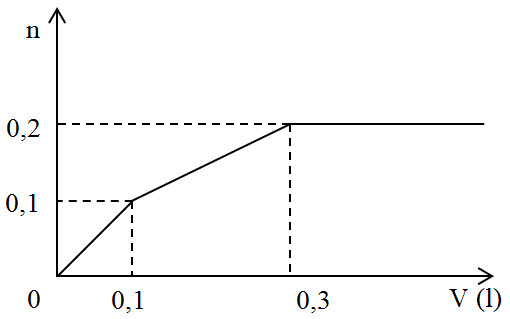
Đáp án: C Phương pháp giải: Đặt số mol của Mg và MgCO3 lần lượt là x và y (mol) Lập hệ 2 ẩn 2 phương trình với khối lượng hỗn hợp và số mol muối giải ra được x, y =? Có x, y dựa vào PTHH tính được khí tương ứng và suy ra được tỉ khối với H2 Lời giải chi tiết: Đặt số mol của Mg và MgCO3 lần lượt là x và y (mol); nMgCl2 = 47,5 : 95 = 0,5 (mol) Mg + 2HCl → MgCl2 + H2↑ x → x → x (mol) MgCO3 + 2HCl → MgCl2 + CO2↑ + H2O y → y → y (mol) Ta có hệ phương trình: \(\eqalign{ Đáp án C Câu hỏi 26 : Nhỏ từ từ V lít dung dịch chứa Ba(OH)2 0,5M vào dung dịch chứa x mol NaHCO3 và y mol BaCl2. Đồ thị sau đây biểu diễn sự phụ thuộc giữa lượng kết tủa và thể tích dung dịch Ba(OH)2 như sau:
Giá trị của x và y tương ứng là:
Đáp án: B Phương pháp giải: Phân tích theo đồ thị: + Tại thời điểm V = 0,1 lít thì nBa(OH)2 = 0,05 mol PTHH : OH- + HCO3- → H2O + CO32- Ba2+ + CO32- → BaCO3 Vì nCO32- = nBaCO3 = 0,1 mol nên nBa2+ phản ứng = 0,1 mol > nBa(OH)2 nên lương Ba2+ trong BaCl2 tham giá phản ứng và phản ứng hết (do đồ thị biến đổi ) → y + Tại thời điểm V = 0,3 lít thì kết tủa thu được lớn nhất thì kết tủa hoàn thành BaCO3: Ba(OH)2 + NaHCO3 → BaCO3 + NaOH + H2O Lời giải chi tiết: + Tại thời điểm V = 0,1 lít thì nBa(OH)2 = 0,05 mol PTHH : OH- + HCO3- → H2O + CO32- 0,1 mol 0,1 mol Ba2+ + CO32- → BaCO3 Vì nCO32- = nBaCO3 = 0,1 mol nên nBa2+ phản ứng = 0,1 mol > nBa(OH)2 nên lương Ba2+ trong BaCl2 tham giá phản ứng và phản ứng hết (do đồ thị biến đổi) → nBaCl2 = 0,1 – 0,05 = 0,05 mol = y + Tại thời điểm V = 0,3 lít → nBa(OH)2 = 0,15 mol thì kết tủa thu được lớn nhất thì kết tủa hoàn thành BaCO3 Ba(OH)2 + NaHCO3 → BaCO3 + NaOH + H2O → nBa(OH)2 thêm = nNaHCO3 còn lại → 0,15 – 0,05 = x – 0,1 → x = 0,2 mol Đáp án B Câu hỏi 27 : Hỗn hợp X gồm: Mg, MgO, Ca và CaO. Hòa tan hoàn toàn 10,72 gam X vào dung dịch HCl vừa đủ thu được 3,248 lít khí (đktc) và dung dịch Y. Trong Y có 12,35 gam MgCl2 và m gam CaCl2. Giá trị của m là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Câu hỏi 28 : Cho sơ đồ các phản ứng sau: (a) X1 + H2O \(\xrightarrow{{dien\,phan\,co\,mang\,ngan}}\) X2 + X3↑ + H2 (b) X2 + X4 → CaCO3 + Na2CO3 + H2O (c) X2 + X3 → X1 + X5 + H2O (d) X4 + X6 → CaSO4 + Na2SO4 + CO2 + H2O Các chất X5, X6 thỏa mãn sơ đồ trên lần lượt là
Đáp án: D Phương pháp giải: Suy luận X1 là NaCl; X2 là NaOH; X3 là Cl2. Từ đó tìm được các chất còn lại. Lời giải chi tiết: (a) X1 + H2O \(\xrightarrow{{dien\,phan\,co\,mang\,ngan}}\) X2 + X3↑ + H2 2NaCl + 2H2O \(\xrightarrow{{dien\,phan\,co\,mang\,ngan}}\) 2NaOH + Cl2 + H2 (b) X2 + X4 → CaCO3 + Na2CO3 + H2O 2NaOH + Ca(HCO3)2 → CaCO3 + Na2CO3 + 2H2O (c) X2 + X3 → X1 + X5 + H2O NaOH + Cl2 → NaCl + NaClO + H2O (d) X4 + X6 → CaSO4 + Na2SO4 + CO2 + H2O Ca(HCO3)2 + NaHSO4 → CaSO4 + Na2SO4 + CO2 + H2O Vậy X5 là NaClO và X6 là NaHSO4 Đáp án D Câu hỏi 29 : Nhiệt phân hoàn toàn 40g một loại quặng đôlômit có lẫn tạp chất trơ, sinh ra 8,96 lít CO2 (đktc). Thành phần % về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên là
Đáp án: B Phương pháp giải: CaCO3.MgCO3 \(\xrightarrow{{{t^0}}}\) CaO + MgO + 2CO2 Từ số mol CO2 tính được số mol CaCO3.MgCO3 và khối lượng của CaCO3.MgCO3. Khi đó tính được thành phần % về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên. Lời giải chi tiết: CaCO3.MgCO3 \(\xrightarrow{{{t^0}}}\) CaO + MgO + 2CO2 Ta có: nCaCO3.MgCO3 = ½ . nCO2 = ½ . 0,4 = 0,2 mol Khối lượng CaCO3.MgCO3 trong loại quặng trên là 0,2.184 = 36,8 (g) Thành phần % về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên là: \(\frac{{36,8}}{{40}} \times 100\% \) = 92% Đáp án B Câu hỏi 30 : Hoà tan 23,9 g hỗn hợp bột BaCO3 và MgCO3 trong nước cần 3,36 lít CO2 (đktc). Khối lượng của BaCO3 và MgCO3 lần lượt là
Đáp án: C Phương pháp giải: - Đặt số mol của BaCO3 và MgCO3 là x và y. - Dựa vào đề bài, lập hệ phương trình và giải phương trình. - Từ đó tính khối lượng mỗi muối. Lời giải chi tiết: \({n_{C{O_2}}} = \frac{{3,36}}{{22,4}} = 0,15(mol)\) Đặt x và y là số mol của BaCO3 và MgCO3. BaCO3 + CO2 + H2O → Ba(HCO3)2 (1) x → x (mol) MgCO3 + CO2 + H2O → Mg(HCO3)2 (2) y → y (mol) Ta có hệ phương trình: \(\left\{ \begin{array}{l}197{\rm{x}} + 84y = 23,9\\x + y = 0,15\end{array} \right. \to \left\{ \begin{array}{l}x = 0,1\\y = 0,05\end{array} \right.\) Vậy khối lượng của mỗi muối trong hỗn hợp: mBaCO3 = 197.0,1 = 19,7 (g) mMgCO3 = 23,9 - 19,7 = 4,2 (g). Đáp án C Quảng cáo
|














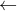 0,015
0,015