30 bài tập tổng hợp về amin có lời giải (phần 1)Làm bàiQuảng cáo
Câu hỏi 1 : Phản ứng nào dưới đây không thể hiện tính bazơ của amin ?
Đáp án: D Phương pháp giải: Amin thể hiện tính bazo khi nó nhận proton (H+). Lời giải chi tiết: Amin thể hiện tính bazo khi nó nhận proton (H+). Trong các đáp án ta thấy phản ứng D không thỏa mãn. Đáp án D Câu hỏi 2 : Công thức chung của amin thơm (chứa 1 vòng benzen) đơn chức bậc nhất là
Đáp án: A Phương pháp giải: Lời giải chi tiết: Amin thơm, chứa 1 vòng benzen, đơn chức, bậc nhất có công thức là CnH2n-7NH2 (n ≥ 6). Đáp án A Câu hỏi 3 : Phát biểu nào sau đây về tính chất vật lí của amin là không đúng?
Đáp án: C Phương pháp giải: Lời giải chi tiết: Anilin là chất lỏng, không màu, rất độc, ít tan trong nước. Đáp án C Câu hỏi 4 : Hợp chất có CTCT: m-CH3-C6H4-NH2 có tên theo danh pháp thông thường là
Đáp án: B Phương pháp giải: Dựa vào cách đọc tên thông thường của amin. Lời giải chi tiết: m-CH3-C6H4-NH2 có tên thông thường là m-toludin. Đáp án B Câu hỏi 5 : Cho các chất có cấu tạo như sau: (1) CH3-CH2-NH2; (2) CH3-NH-CH3; (3) CH3-CO-NH2; (4) NH2-CO-NH2; (5) NH2-CH2-COOH; (6) C6H5-NH2; (7) C6H5NH3Cl; (8) C6H5-NH-CH3; (9) CH2=CH-NH2. Các chất thuộc loại amin là
Đáp án: D Phương pháp giải: Khi thay thế lần lượt các nguyên tử H trong phân tử NH3, ta thu được amin. Lời giải chi tiết: Những amin là: (1) CH3-CH2-NH2; (2) CH3-NH-CH3; (6) C6H5-NH2; (8) C6H5-NH-CH3; (9) CH2=CH-NH2. Đáp án D Câu hỏi 6 : Trong các tên gọi dưới đây, chất nào có lực bazơ yếu nhất?
Đáp án: C Phương pháp giải: Do C6H5- là gốc hút e, làm giảm mật độ e của N nên làm tính bazo của amin yếu đi. Từ đó suy ra amin có tính bazo yếu nhất. Lời giải chi tiết: Do C6H5- là gốc hút e, làm giảm mật độ e của N nên làm tính bazo của amin yếu đi => (C6H5)2NH có tính bazo yếu nhất Đáp án C Câu hỏi 7 : Cho dãy các chất: CH4, C2H2, C2H4, C2H5OH, CH2=CH-COOH, C6H5NH2(anilin), C6H5OH (phenol), C6H6(benzen), CH3CHO. Số chất trong dãy phản ứng được với nước brom ở điều kiện thường là:
Đáp án: A Phương pháp giải: Lời giải chi tiết: Các chất thỏa mãn : C2H2 ; C2H4 ; CH2=CH-COOH ; C6H5NH2 ; C6H5OH ; CH3CHO Đáp án A Câu hỏi 8 : Đũa thủy tinh đã nhúng vào dung dịch axit HCl đậm đặc đặt phía trên miệng lọ đựng dung dịch metylamin đặc, có khói trắng xuất hiện chính là
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án C Câu hỏi 9 : Biết rằng mùi tanh của cá (đặc biệt cá mè) là hỗn hợp các amin (nhiều nhất là trimetylamin) và một số chất khác. Để khử mùi tanh của cá trước khi nấu ta có thể dùng dung dịch nào sau đây?
Đáp án: D Phương pháp giải: Lời giải chi tiết: Amin mang tính bazo => tác dung với axit. Đáp án D. Câu hỏi 10 : Cho dãy các chất: C6H5NH2 (1), C2H5NH2 (2), (C6H5)2NH (3), (C2H5)2NH (4), NH3 (5) (C6H5- là gốc phenyl). Dãy các chất sắp xếp theo thứ tự lực bazơ tăng dần là:
Đáp án: A Phương pháp giải: Nhóm hút e làm giảm tính bazo, nhóm đẩy e làm tăng tính bazo của amin Lời giải chi tiết: C6H5NH2, (C6H5)2NH có nhóm (C6H5) là nhóm hút nên tính bazo có tính bazo yếu hơn NH3 C2H5NH2, (C2H5)2NH có nhóm C2H5 là nhóm đẩy e nên có tính bazo mạnh hơn NH3 Mặt khác càng nhiều nhóm hút e càng có tính bazo yếu, càng có nhiều nhóm đẩy e thì tính bazo càng mạnh. Thứ tự tăng dần tính bazo là 3, 1, 5, 2, 4. Đáp án A Câu hỏi 11 : Hỗn hợp X gồm metylamin, etylamin và propylamin có tổng khối lượng 21,6 gam và tỉ lệ về số mol là 1:2:1. Cho X tác dụng hết với dung dịch HCl thu được m gam muối. Giá trị của m?
Đáp án: B Phương pháp giải: Phương pháp: Định luật bảo toàn khối lượng: mmuối = mX + mHCl Lời giải chi tiết: Hướng dẫn giải Đặt \({n_{C{H_3}N{H_2}}} = x = {n_{{C_3}{H_7}N{H_2}}}\,\,\,\,{n_{{C_2}{H_5}N{H_2}}} = 2{\rm{x}}\) mX = 31x+45.2x+59x=21,6 => x=0,12 mol RNH2 + HCl ->RNH3Cl 0,12.4 0,48 ĐLBTKL =>mmuối = mX + mHCl= 21,6+ 36,5.0,48=39,12 gam Chọn B Câu hỏi 12 : Cho 15 gam hỗn hợp các amin gồm anilin,metylamin, đimetylamin tác dụng vừa đủ với 50 ml dung dịch HCl 1M. Khối lượng sản phẩm thu được có giá trị là:
Đáp án: A Phương pháp giải: Phương pháp: Định luật bảo toàn khối lượng:mhỗn hợp + mHCl = msản phẩm =>msản phẩm Lời giải chi tiết: Hướng dẫn giải Định luật bảo toàn khối lượng mhỗn hợp + mHCl = msản phẩm => msản phẩm = 15+0,05.36,5=16,825 gam Chọn A Câu hỏi 13 : Cho 19,4 gam hỗn hợp hai amin ( no, đơn chức, mạch hở ké tiếp nhau trong dãy đồng đẳng) Tác dụng hết với dung dịch HCl thu được 34 gam muối. Công thức phân tử của 2 amin là
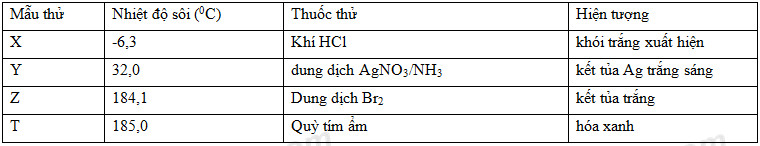
Đáp án: B Phương pháp giải: Phương pháp: + Bảo toàn khối lượng: mamin + mHCl = mmuối + Công thức trung bình nguyên tử C Lời giải chi tiết: Gọi CT 2 amin: BTKL => nHCl = (34- 19,4): 36,5 = 0,4 (mol) = namin \(\begin{gathered} Đáp án B Câu hỏi 14 : X,Y,Z,T là một trong số những chất benzylamin, metylamin, anilin, metyl fomat. Kết quả nghiên cứu một số tính chất đưuọc thể hiên ở bảng dưới đây:
Các chất X, Y, Z, T tương ứng là
Đáp án: A Phương pháp giải: Lời giải chi tiết: X: metyl amin CH3NH2 + HCl → CH3NH3Cl (khói trắng) Y: metyl fomat HCOOCH3 + AgNO3 + NH3 + H2O → NH4OOCOOCH3 + Ag + NH4NO3 Z: anilin C6H5NH2 T: benzylamin: C6H5CH2NH2 Đáp án A Câu hỏi 15 : Cho 4,65 gam metylamin tác dụng vừa đủ với dung dịch AlCl3. Sau phản ứng, lấy kết tủa thu được tác dụng vừa đủ với 300 ml dung dịch HCl xM. Giá trị của x là
Đáp án: A Phương pháp giải: 3CH3NH2 + AlCl3 + 3H2O → 3CH3NH3Cl + Al(OH)3 Al(OH)3 + 3HCl → AlCl3 + 3H2O nHCl = 3nAl(OH)3 = nCH3NH2 → nHCl → CM = n/V Lời giải chi tiết: nCH3NH2 = 0,15 mol. PTHH: 3CH3NH2 + AlCl3 + 3H2O → 3CH3NH3Cl + Al(OH)3 (1) Al(OH)3 + 3HCl → AlCl3 + 3H2O (2) Từ PTHH (1) và (2): nHCl = 3nAl(OH)3 = nCH3NH2 = 0,15 mol → x = CM = n/V = 0,15/0,3 = 0,5M. Đáp án A Câu hỏi 16 : Cho các chất sau: (1) Na2CO3 (2) FeCl3 (3) dung dịch H2SO4 loãng (4) CH3COOH (5) C6H5ONa (6) C6H5NH3Cl (phenylamoni clorua) Dung dịch metylamin có thể tác dụng được với
Đáp án: A Phương pháp giải: Lời giải chi tiết: CH3NH2 có tính bazơ, có thể: làm quỳ tím chuyển xanh, làm hồng phenolphtalein; tác dụng được với axit; có khả năng tác dụng được với một số dung dịch muối như Al3+, Fe3+, Cu2+, … Trong số các chất đã cho, CH3NH2 có thể tác dụng được với: FeCl3 (2), H2SO4 loãng (3), CH3COOH (4), C6H5NH3Cl (6). \(\begin{array}{l} Đáp án A Câu hỏi 17 : Hỗn hợp E gồm 3 amin no, đơn chức. Đốt cháy hoàn toàn m gam E bằng O2, thu được CO2, H2O và 1,008 lít khí N2 (đktc). Mặt khác, để tác dụng với m gam E cần vừa đủ V ml dung dịch HCl 1M. Giá trị của V là
Đáp án: B Phương pháp giải: Ta có: nHCl (phản ứng với E) = nN (trong E) = 2nN2 (sinh ra khi đốt cháy) → nHCl (phản ứng) → V = n/CM. Lời giải chi tiết: \(\begin{array}{l} Đáp án B Câu hỏi 18 : Cho 20 gam hỗn hợp gồm hai amin no, đơn chức, mạch hở tác dụng vừa đủ với V ml dung dịch HCl 1M, thu được dung dịch chứa 31,68 gam hỗn hợp muối. Giá trị của V là
Đáp án: D Phương pháp giải: Amin + HCl → Muối Bảo toàn khối lượng: mHCl = m muối – m amin Lời giải chi tiết: Amin + HCl → Muối Bảo toàn khối lượng: mHCl = m muối – m amin = 31,68 – 20 = 11,68 gam => nHCl = 11,68: 36,5 = 0,32 mol => V = 320 ml Đáp án D Câu hỏi 19 : Ở điều kiện thường, amin X là chất lỏng, dễ bị oxi hóa khi để ngoài không khí. Dung dịch X không làm đổi màu quỳ tím nhưng tác dụng với nước brom tạo kết tủa trắng. Amin X là
Đáp án: C Phương pháp giải: Dựa vào kiến thức được học về amin SGK hóa trang 40 Lời giải chi tiết: Amin X là anilin Đáp án C Câu hỏi 20 : Đốt cháy hoàn toàn 0,1 mol hỗn hợp X gồm metylamin, đimetylamin và trimetylamin cần dùng 0,3 mol O2 thu được CO2, H2O và N2. Nếu lấy 11,4 gam X trên tác dụng với dung dịch HNO3 dư, thu được lượng muối là
Đáp án: D Phương pháp giải: Xét quá trình đốt cháy: Đặt số mol CO2 = a(mol) và H2O = b (mol) Lập hệ với namin = (nH2O – nCO2)/2 và bảo toàn nguyên tố O: 2nO2 = 2nCO2 + nH2O ta tìm được a, b = ? BTKL tìm được mX = mC + mH + mN . Từ đó tìm được: MX = mX : nX = ? Xét quá trình pư với HNO3. Tìm được nHNO3 = nX . Sau đó bảo toàn khối lượng: mmuối = mX + mHNO3 Lời giải chi tiết: Đặt công thức chung của 3 amin có dạng: CnH2n+3N: 0,1 (mol) Xét quá trình cháy PT cháy: CnH2n+3N + (3n+ 1,5)/2O2 \(\xrightarrow{{{t^0}}}\) nCO2 + (n+1,5)H2O + 0,5nN2 (1) Đặt \(\left\{ \begin{array}{l}C{O_2}:a\,(mol)\\{H_2}O:\,b\,(mol)\end{array} \right.\) Đốt cháy amin trên có: namin = (nH2O – nCO2)/1,5 → 0,1 = (b – a)/1,5 hay b – a = 0,15 (I) BTNT “O”: 2nCO2 + nH2O = 2nO2 → 2a + b = 2.0,3 (II) giải hệ (I) và (II) ta được: a = 0,15 và b = 0,3 → \(\left\{ \begin{array}{l}C{O_2}:0,15\,(mol)\\{H_2}O:\,0,3\,(mol)\end{array} \right.\) BTKL ta có: mamin = mC + mH + mN = 0,15.12 + 0,3.2 + 0,1.14 = 3,8 (g) → Phân tử khối trung bình của amin là: Mamin = mamin : namin = 3,8 : 0,1 = 38 (g/mol) Xét quá trình phản ứng với HNO3 namin = mamin : Mamin = 11,4 : 38 = 0,3 (mol) PTHH: CnH2n+1NH2 + HNO3 → CnH2n+1NH3NO3 (2) (mol) 0,3 → 0,3 Theo PTHH (2): nHNO3 = nCnH2n+1NH2 = 0,3 (mol) BTKL ta có: mmuối = mCnH2n+1NH3NO3 = mCnH2n+1NH2+mHNO3 = 11,4 + 0,3.63 = 30,3 (g) Đáp án D Câu hỏi 21 : Hỗn hợp X gồm ba amin: propan-1-amin (propylamin), propan-2-amin (iso-propylamin) và N-metyletanamin (etylmetylamin). Cho 8,85 gam X tác dụng vừa đủ với V ml dung dịch HCl 1M. Giá trị của V là
Đáp án: D Phương pháp giải: Ta thấy tất cả các chất là đồng phân của nhau, có chung CTPT là C3H9N. => nC3H9N => nHCl => VHCl = nHCl : CM Lời giải chi tiết: Ta thấy tất cả các chất đều có CTPT là C3H9N. => nX = 8,85/59 = 0,15 mol PTHH: C3H9N + HCl → C3H10NCl → nHCl = nX = 0,15 mol → VHCl = 150 ml Đáp án D Câu hỏi 22 : Trung hòa hoàn toàn 5,7 gam một amin đơn chức X cần vừa đủ 100 ml dung dịch HCl 1M. Công thức của X là
Đáp án: D Phương pháp giải: Amin đơn chức phản ứng với HCl: namin = nHCl Lời giải chi tiết: Amin đơn chức phản ứng với HCl: namin = nHCl = 0,1 (mol) => Mamin = 5,7 : 0,1 = 57 => CTPT: C3H7N Đáp án D Câu hỏi 23 : Những nhận xét nào trong các nhận xét sau là đúng? (1) Metylamin, đimetylamin, trimetylamin và etylamin là những chất khí mùi khai khó chịu, độc. (2) Các amin đồng đẳng của metylamin có độ tan trong nước giảm dần theo chiều tăng của khối lượng phân tử. (3) Anilin có tính bazơ và làm xanh quỳ tím ẩm. (4) Lực bazơ của các amin luôn lớn hơn lực bazơ của amoniac.
Đáp án: D Phương pháp giải: Lời giải chi tiết: (1) đúng (2) đúng (3) sai vì anilin không làm xanh quỳ tím ẩm. (4) sai vì nếu có nhóm hút e đính vào -NH2 ví dụ như anilin thì lực bazo sẽ yếu hơn. Vậy có 2 phát biểu đúng. Đáp án D Câu hỏi 24 : Điều nào sau đây sai?
Đáp án: B Phương pháp giải: Lời giải chi tiết: Tính bazo mạnh hay yếu của amin được quyết định bởi mức độ hút electron của gốc hiđrocacbon. + Nếu gốc hidrocacbon đẩy e làm cho tính bazo của amin mạnh hơn NH3. + Nếu gốc hidrocacbon hút e làm cho tính bazo của amin yếu hơn NH3. Vậy phát biểu B sai. Đáp án B
Câu hỏi 25 : Ứng với công thức phân tử C4H11N, có x đồng phân amin bậc nhất, y đồng phân amin bậc hai và z đồng phân amin bậc ba. Các giá trị x, y và z lần lượt bằng
Đáp án: A Phương pháp giải: Lời giải chi tiết: - Đồng phân amin bậc nhất: CH3CH2CH2CH2NH2; CH3CH2CH(NH2)CH3; (CH3)2CHCH2NH2; (CH3)3C(NH2). => x = 4 - Đồng phân bậc hai: CH3CH2CH2NHCH3; CH3CH2NHCH2CH3; (CH3)2CHNHCH3. => y = 3 - Đồng phân bậc ba: (CH3)2NCH2CH3 => z = 1 Đáp án A Câu hỏi 26 : Có 7 ống nghiệm đựng 4 dung dịch : C6H5ONa ; (NH4)2CO3 ; BaCl2 ; Na2SO4 và 3 chất lỏng : C2H5OH ; C6H6 ; C6H5NH2. Chỉ dùng dung dịch H2SO4 có thể nhận biết được tối đa bao nhiêu ống nghiệm :
Đáp án: D Phương pháp giải: Lời giải chi tiết: Khi cho H2SO4 vào thì : _Có khí thoát ra : (NH4)2CO3 _Có kết tủa : BaCl2 và C6H5ONa , dùng (NH4)2CO3 thấy có kết tủa là BaCl2 _ Còn lại là Na2SO4 và C2H5OH tan ngay. Dùng BaCl2 thấy có kết tủa là Na2SO4 _ chất lỏng không tan trong H2SO4 mà phân tách 2 lớp : C6H6 _ Chất lỏng ban đầu tách lớp sau đó tan dần : C6H5NH2 Đáp án D Câu hỏi 27 : Có 3 chất lỏng stiren, anilin, bezen đựng trong 3 lọ mất nhãn. Thuốc thử để nhận biết 3 chất trên là
Đáp án: B Phương pháp giải: Chất tạo với 3 chất lỏng trên 3 hiện tượng khác nhau sẽ được dùng làm thuốc thử để phân biệt. Lời giải chi tiết: Thuốc thử để phân biệt 3 chất trên là dung dịch brom. Stiren: làm mất màu dung dịch brom Benzen: không có hiện tượng gì. Anilin: tạo thành kết tủa Đáp án B Câu hỏi 28 : Cho 70,8 gam dung dịch amin X (no, đơn chức, bậc hai) nồng độ 15% tác dụng vừa đủ với dung dịch HCl, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Làm bay hơi dung dịch Y được 17,19 gam muối khan. Tên gọi của X là
Đáp án: D Phương pháp giải: Từ khối lượng dung dịch và C% → khối lượng chất tan X trong dung dịch. 1X + 1HCl → muối BTKL: mX + mHCl = mmuối → mHCl → nHCl → nX → MX → CTPT, tên gọi của X (chú ý: X là amin bậc hai). Lời giải chi tiết: \(\begin{array}{l} Vì X là amin bậc hai nên X là C2H5NHCH3 (etylmetylamin) Đáp án D Câu hỏi 29 : Đốt cháy hoàn toàn m gam hỗn hợp X gồm các amin thuộc dãy đồng đẳng của vinylamin thu được 41,8 gam CO2 và 18,9 gam nước. Giá trị của m là
Đáp án: C Phương pháp giải: X gồm các amin thuộc dãy đồng đẳng của vinylamin → các chất trong X có dạng: CnH2n+1N. Theo đề bài, có: nCO2 = 0,95 mol; nH2O = 1,05 mol. Cách 1: Lập tỉ lệ nH : nC → tìm được n, số mol X → giá trị m. Cách 2: Từ CT của X, ta thấy: nH2O – nCO2 = 0,5nX → nX → nN (X) m = mC (X) + mH (X) + mN (X). Lời giải chi tiết: X gồm các amin thuộc dãy đồng đẳng của vinylamin nên các chất trong X có dạng: CnH2n+1N. Theo đề bài, có: nCO2 = 0,95 mol; nH2O = 1,05 mol. Cách 1: \(\begin{array}{l}\frac{{{n_H}}}{{{n_C}}} = \frac{{1,05.2}}{{0,95}} = \frac{{2n + 1}}{n} \Rightarrow n = 4,75 \Rightarrow X:{C_{4,75}}{H_{10,5}}N\\n.{n_X} = {n_{C{O_2}}} = 0,95 \Rightarrow {n_X} = \frac{{0,95}}{{4,75}} = 0,2\,(mol)\\ \Rightarrow m = 0,2.(12.4,75 + 10,5 + 14) = 16,3\,gam.\end{array}\) Cách 2: \(\begin{array}{l}(X){C_n}{H_{2n + 1}}N \to nC{O_2} + (n + 0,5){H_2}O + 0,5{N_2}\\NX:{n_{{H_2}O}} - {n_{C{O_2}}} = 0,5{n_X} = 0,5{n_{N(X)}} \Rightarrow {n_{N(X)}} = \frac{{1,05 - 0,95}}{{0,5}} = 0,2\,mol.\\m = {m_{C(X)}} + {m_{H(X)}} + {m_{N(X)}} = 0,95.12 + 1,05.2.1 + 0,2.14 = 16,3\,gam.\end{array}\) Đáp án C Câu hỏi 30 : Hỗn hợp T gồm etylmetylamin, trimetylamin và hexametylenđiamin. Để tác dụng hoàn toàn với m gam T cần vừa đủ 100 ml dung dịch HCl 0,5M. Đốt cháy hoàn toàn m gam T bằng oxi rồi dẫn toàn bộ sản phẩm cháy vào bình đựng dung dịch nước vôi trong dư, thu được a gam kết tủa. Giá trị của a là
Đáp án: D Phương pháp giải: T gồm etylmetylamin(C2H5NHCH3 hay C3H9N, trimetylamin (CH3)3N hay C3H9N, hexametylenđiamin NH2(CH2)6NH2 hay C6H16N2. Ta thấy: nCaCO3 = nCO2 = nC (T) = 3nN (T). Mặt khác, từ số mol HCl phản ứng với → nN (T). Lời giải chi tiết: \(\begin{array}{l}T\left\{ \begin{array}{l}{C_3}{H_9}N\\{C_6}{H_{16}}{N_2}\end{array} \right. + HCl:0,05\,mol \to \\ \Rightarrow {n_{N(T)}} = {n_{HCl}} = 0,05\,mol.\\{n_{C(T)}} = 3{n_{N{\kern 1pt} (T)}} = 0,15\,mol \Rightarrow {n_{CaC{O_3}}} = {n_{C{O_2}}} = 0,15\,mol \Rightarrow a = {m_{CaC{O_3}}} = 0,15.100 = 15\,gam.\end{array}\) Đáp án D Quảng cáo
|