10 bài tập về nito có lời giải (phần 1)Làm bàiQuảng cáo
Câu hỏi 1 : Cần lấy bao nhiêu lít N2 và H2 để điều chế được 33,6 lít khí amoniac, biết rằng các khí đo cùng điều kiện và hiệu suất phản ứng là 60%.
Đáp án: C Phương pháp giải: - Tính chất tham gia: Do hiệu suất phản ứng nhỏ hơn 100%, nên lượng chất tham gia thực tế đem vào phản ứng phải lớn hơn để bù vào sự hao hụt. Sau khi tính khối lượng chất tham gia theo phương trình phản ứng (LT), ta có khối lượng chất tham gia khi có hiệu suất (TT) như sau: \({m_{TT}} = {m_{LT}}.\frac{{100}}{H}\) - Tính chất tạo thành: Do hiệu suất phản ứng nhỏ hơn 100%, nên lượng sản phẩm thực tế thu được phải nhỏ hơn do có sự hao hụt. Sau khi khối lượng sản phẩm theo phương trình phản ứng (LT), ta tính khối lượng sản phẩm khi có hiệu suất (TT) như sau: \({m_{TT}} = {m_{LT}}.\frac{H}{{100}}\) Lời giải chi tiết: PTHH: N2 + 3H2 ⇄ 2NH3 Cùng điều kiện về t, p nên tỉ lệ thể tích bằng tỉ lệ mol Theo PTHH → VN2(pư) = 1/2.VNH3 = 1/2.33,6 = 16,8 lít VH2(pư) = 3/2.VNH3 = 3/2.33,6 = 50,4 lít Do H = 60% nên ta có: VN2(bđ) = VN2(pư).(100/H) = 16,8.(100/60) = 28 lít VH2(bđ) = VH2(pư).(100/H) = 50,4.(100/60) = 84 lít Đáp án C Câu hỏi 2 : Cho 10 lít khí N2 tác dụng với H2 dư với hiệu suất 60% (biết các khí đo cùng điều kiện). Thể tích khí NH3 thu được là
Đáp án: D Phương pháp giải: Công thức hiệu suất: \(H = \frac{{luong\,phan\,ung}}{{luong\,ban\,dau}}.100\% \) Lời giải chi tiết: Ta có: VN2(pư) = VN2(bđ).(H/100) = 10.(60/100) = 6 lít PTHH: N2 + 3H2 ⇄ 2NH3 Theo PTHH → VNH3 = 2.VN2 = 12 lít Đáp án D Câu hỏi 3 : Cho 2,5 lít khí N2 tác dụng với 7 lít khí H2 sau một thời gian thu được hỗn hợp A. Hiệu suất phản ứng là 60%. Phần trăm các khí trong hỗn hợp A là
Đáp án: C Phương pháp giải: Cách xác định hiệu suất tính theo chất nào? Tương tự như cách xác định chất phản ứng hết. PTHH: aA + bB → cC + dD Đề bài cho biết nA và nB. Để biết được hiệu suất tính theo chất nào ta so sánh tỉ số \(\frac{{{n_A}}}{a}\) và \(\frac{{{n_B}}}{b}\). Tỉ số nào nhỏ hơn thì hiệu suất tính theo chất đó. Lưu ý: Làm tương tự nếu đề bài cho thể tích các khí (đo ở cùng điều kiện). Lời giải chi tiết: PTHH: N2 + 3H2 ⇄ 2NH3 Bđ: 2,5 7 (lít) (So sánh thấy: \(\frac{{2,5}}{1} > \frac{7}{3}\) → hiệu suất tính theo H2) → VH2(pư) = VH2(bđ).60/100 = 7.60% = 4,2 lít PTHH: N2 + 3H2 ⇄ 2NH3 Bđ: 2,5 7 (lít) Pư: 1,4 ← 4,2 → 2,8 (lít) Sau: 1,1 2,8 2,8 (lít) Phần trăm về thể tích các khí trong hh sau phản ứng là: \(\begin{array}{l}\% {V_{{N_2}}} = \frac{{1,1}}{{1,1 + 2,8 + 2,8}}.100\% = 16,42\% \\\% {V_{{H_2}}} = \% {V_{N{H_3}}} = \frac{{2,8}}{{1,1 + 2,8 + 2,8}}.100\% = 41,79\% \end{array}\) Đáp án C Câu hỏi 4 : Thể tích N2 ( đktc ) thu được khi nhiệt phân 40g NH4NO2 là :
Đáp án: C Phương pháp giải: Lời giải chi tiết: NH4NO2 -> N2 + 2H2O 0,625 -> 0,625 mol => VN2 = 14 lit Đáp án C Câu hỏi 5 : Khối lượng NaNO2 cần dùng trong phòng thí nghiệm để thu được 6,72 lít N2 (đktc) là
Đáp án: D Phương pháp giải: Trong phòng thí nghiệm người ta điều chế N2 bằng phản ứng: NH4Cl + NaNO2 \(\xrightarrow{{{t}^{o}}}\) N2 + NaCl + 2H2O Lời giải chi tiết: NH4Cl + NaNO2 \(\xrightarrow{{{t}^{o}}}\) N2 + NaCl + 2H2O Theo PTHH: nNaNO2 = nN2 = 6,72:22,4 = 0,3 mol => mNaNO2 = 0,3.69 = 20,7 gam Đáp án D Câu hỏi 6 : Cho 10 lít N2 tác dụng với lượng dư khí hiđro, đun nóng hỗn hợp với xúc tác thích hợp thu được V lít NH3 với hiệu suất phản ứng là 75%. Biết các thể tích đo trong cùng điều kiện nhiệt độ và áp suất. Giá trị của V là
Đáp án: A Phương pháp giải: Tính theo PTHH: N2 + 3H2 2NH3 → Tỉ lệ về thể tích tương tự về số mol → VNH3 lý thuyết H = Vtt : Vtt . 100% → Vtt Lời giải chi tiết: PTHH: N2 + 3H2 \(\overset{t^o,xt,p}{\rightarrow}\) 2NH3 Lý thuyết 10 → 20 lít Thể tích NH3 thực tế thu được là: VNH3 = 20.(75/100) = 15 lít Đáp án A Câu hỏi 7 : Cho 2,24 lít khí N2 tác dụng với 8,96 lít khí H2 tạo ra V lít khí NH3 (điều kiện tiêu chuẩn). Biết hiệu suất phản ứng là 25%. Tính giá trị của V?
Đáp án: D Phương pháp giải: Cách xác định hiệu suất tính theo chất nào? Tương tự như cách xác định chất phản ứng hết. PTHH: aA + bB → cC + dD Đề bài cho biết nA và nB. Để biết được hiệu suất tính theo chất nào ta so sánh tỉ số \(\frac{n_{A}}{a}\) và \(\frac{n_{B}}{b}\). Tỉ số nào nhỏ hơn thì hiệu suất tính theo chất đó. Lời giải chi tiết: PTHH: N2 + 3H2 Ban đầu: 0,1 0,4 mol (So sánh thấy: \(\frac{0,1}{1}<\frac{0,4}{3}\) nên hiệu suất tính theo N2 => nN2 pư = 0,1.25% = 0,025 mol) Pư: 0,025 → 0,075 → 0,05 → V = 0,05.22,4 = 1,12 lít Đáp án D Câu hỏi 8 : Thực hiện phản ứng giữa N2 và H2 (tỉ lệ mol 2 : 5) trong bình kín có xúc tác, thu được hỗn hợp có áp suất giảm 10% so với ban đầu (trong cùng điều kiện). Hiệu suất phản ứng tổng hợp NH3 là
Đáp án: A Phương pháp giải: Giả sử ban đầu nN2 = 2 mol và nH2 = 5 mol PTHH : N2 + 3H2 2NH3 Bđ: 2 5 (Ta thấy: 2/1 > 5/3 nên hiệu suất tính theo H2) Pư: a → 3a → 2a mol Sau: 2-a 5-3a 2a mol → nkhí sau pư = 7 - 2a (mol) Vì trong bình kín nhiệt độ không đổi thì \(\frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{{p_2}}}\) → a → \(H = \frac{{{n_{{H_2}pu}}}}{{{n_{{H_2}b{\rm{d}}}}}}.100\% \) Lời giải chi tiết: Giả sử ban đầu nN2 = 2 mol và nH2 = 5 mol PTHH : N2 + 3H2 2NH3 Bđ: 2 5 (Ta thấy: 2/1 > 5/3 nên hiệu suất tính theo H2) Pư: a → 3a → 2a mol Sau: 2-a 5-3a 2a mol → nkhí sau pư = 7 - 2a (mol) Vì trong bình kín nhiệt độ không đổi thì \(\frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{{p_2}}}\) nên \(\frac{7}{{7 - 2{\rm{a}}}} = \frac{p}{{0,9p}}\) → a = 0,35 mol → \(H = \frac{{{n_{{H_2}pu}}}}{{{n_{{H_2}b{\rm{d}}}}}}.100\% = \frac{{3.0,35}}{5}.100\% = 21\% \) Đáp án A Câu hỏi 9 : Hợp chất của Mg với phi kim X có dạng Mg3X2. Biết phần trăm khối lượng của Mg trong hợp chất chiếm 72%. X là
Đáp án: B Phương pháp giải: Lời giải chi tiết: Phương pháp:
Hướng dẫn giải:
$\begin{gathered} Đáp án B. Câu hỏi 10 : Cho hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X môt thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là bao nhiêu? Phương pháp giải: - Định luật bảo toàn khối lượng. - Phương pháp đường chéo, phương pháp tăng giảm số mol. Lời giải chi tiết: Áp dụng phương pháp đường chéo cho hỗn hợp khí X:
Giả sử hỗn hợp khí X gồm 1 mol N2 và 4 mol H2. Theo định luật bảo toàn khối lượng ta có: mX = mY => nX.MX = nY.MY =>\({n_Y} = {n_X}\frac{{{M_X}}}{{{M_Y}}} = (1 + 4).\frac{{1,8}}{2} = 4,5(mol)\) => n giảm = nX – nY = 5 – 4,5 = 0,5 mol
Hiệu suất của phản ứng (tính theo N2) là: \(H\% = \frac{{0,25}}{1}.100\% = 25\% \) Quảng cáo
|














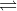 2NH3
2NH3