10 bài tập vận dụng về phương pháp qui đổi có lời giảiLàm bàiQuảng cáo
Câu hỏi 1 : Hỗn hợp X gồm Mg, MgS và S. Hoà tan hoàn toàn m gam X trong HNO3 đặc, nóng thu được 2,912 lít khí N2 duy nhất (đktc) và dung dịch Y. Thêm Ba(OH)2 dư vào Y được 46,55 gam kết tủa. Giá trị của m là
Đáp án: C Phương pháp giải: Kết tủa Y : BaSO4, Mg(OH)2 Coi hỗn hợp X gồm Mg, S Gọi nMg = x ; nS = y (mol) nN2 = V/22,4 = ? mol Mg →Mg+2 +2e \(\begin{gathered} Kết tủa Y : BaSO4, Mg(OH)2 Bảo toàn nguyên tố S, Mg => nBaSO4 = y, nMg(OH)2 = x \(\left\{ \begin{gathered} => m= mMg + mS Lời giải chi tiết: Kết tủa Y : BaSO4, Mg(OH)2 Coi hỗn hợp X gồm Mg, S nN2 = V/22,4 =0,13 mol Mg →Mg+2 +2e x 2x \(\begin{gathered} Kết tủa Y : BaSO4, Mg(OH)2 Bảo toàn nguyên tố S, Mg => nBaSO4 = y, nMg(OH)2 = x \(\left\{ \begin{gathered} => m= mMg + mS = 0,2.24+ 0,15.32= 9,6 gam Đáp án C Câu hỏi 2 : Hoà tan hoàn toàn 25,6 gam chất rắn X gồm Fe , FeS, FeS2 và S bằng dung dịch HNO3 dư, đktc ra V lít khí NO duy nhất (đktc) và dung dịch Y . Thêm Ba(OH)2 dư vào Y thu được 126,25 gam kết tủa. Giá trị của V là
Đáp án: C Phương pháp giải: Kết tủa Y : BaSO4, Fe(OH)3 Coi hỗn hợp X gồm Fe : x mol , S: mol => 56x + 32y = 25,6 (1) Bảo toàn nguyên tố Fe,S Fe →Fe(OH)3 x x S →BaSO4 y y mkết tủa = 107x+233y =126,25 (2) (1)(2) => x= ? y =? Fe →Fe +3 +3e S0 →S+6 + 6e N+5 +3e→N+2 Bảo toàn e => nNO = ? Lời giải chi tiết: Kết tủa Y : BaSO4, Fe(OH)3 Coi hỗn hợp X gồm Fe : x mol , S: mol => 56x + 32y= 25,6 (1) Bảo toàn nguyên tố Fe,S Fe →Fe(OH)3 x x S →BaSO4 y y mkết tủa = 107x+233y=126,25 (2) (1)(2) => x=0,2 y=0,45 Fe →Fe +3 +3e 0,2 0,6 S0 →S+6 + 6e 0,45 2,7 N+5 +3e→N+2 3a a Bảo toàn e => 0,6 + 2,7 = 3a => a= 1,1 => VNO= n.22,4=1,1.22,4=24,64 lít Đáp án C Câu hỏi 3 : Cho 13,92 gam hỗn hợp X gồm Cu và một oxit sắt vào dung dịch HNO3 loãng dư thu được 2,688 lít khí NO (sản phẩm khử duy nhất, đo ở đktc). Cô cạn dung dịch sau phản ứng thu được 42,72 gam muối khan. Công thức của oxit sắt là
Đáp án: A Phương pháp giải: Coi hỗn hợp X gồm Cu (x mol), Fe( y mol), O (z mol) => mX = 64x+56y+16z = 13,92 (1) nNO =V/22,4 = 0,12 mol Cu0 →Cu+2 + 2e x 2x Fe0 →Fe+3 + 3e y 3y O0 + 2e →O-2 z 2z N+5 + 3e →N+2 0,36 0,12 Bảo toàn e => 2x + 3y =2z +0,36 (2) Bảo toàn nguyên tố Cu, Fe nCu(NO3)2 = nCu2+= x mol nFe(NO3)3 = nFe3+ = y mol mmuối khan = mCu(NO3)2 + mFe(NO3)3 = 188x +242y =42,72 (3) (1)(2)(3) =>x,y,z Lời giải chi tiết: Coi hỗn hợp X gồm Cu (x mol), Fe( y mol), O (z mol) => mX = 64x+56y+16z = 13,92 (1) nNO =V/22,4 = 0,12 mol Cu0 →Cu+2 + 2e x 2x Fe0 →Fe+3 + 3e y 3y O0 + 2e →O-2 z 2z N+5 + 3e →N+2 0,36 0,12 Bảo toàn e => 2x + 3y =2z +0,36 (2) Bảo toàn nguyên tố Cu, Fe nCu(NO3)2 = nCu2+= x mol nFe(NO3)3 = nFe3+ = y mol mmuối khan = mCu(NO3)2 + mFe(NO3)3 = 188x +242y =42,72 (3) (1)(2)(3) => x= 0,15, y=0,06, z = 0,06 Fe :O= 0,06:0,06 =1:1 => FeO Đáp án A Câu hỏi 4 : Cho m gam Mg, Zn, Al, Cu tác dụng hết với HNO3 thu được 11,2 lít hỗn hợp khí Z: N2, N2O, NO, NO2 (không tạo muối amoni). Số mol NO và N2O bằng nhau. Tỉ khối của Z so với He là 9,25. Số mol HNO3 phản ứng
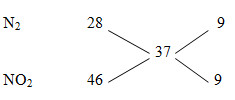
Đáp án: A Phương pháp giải: NO và N2O có số mol bằng nhau => quy đổi 2 khí này thành : NO2, N2 Hỗn hợp khí Z coi như gồm N2 (x mol), NO2 (y mol) MZ = 9,25.4= 37 nZ = V/22,4= 0,5 mol
=> \(\frac{{{n_{{N_2}}}}}{{{n_{N{O_2}}}}} = \frac{9}{9} = \frac{1}{1}\) => nN2 = nNO2 = 0,5/2 =0,25 mol Gọi công thức chung của hỗn hợp kim loại là M, hóa trị n M0 → +ne a na 2N+5 + 10e→N20 0,5 2,5 0,25 N+5 +1e →N+4 0,25 0,25 0,25 Bảo toàn e : => na =? nHNO3 = n. nFe(NO3)n + nNO2 + 2nN2 Lời giải chi tiết: NO và N2O có số mol bằng nhau => quy đổi 2 khí này thành : NO2, N2 Hỗn hợp khí Z coi như gồm N2 (x mol), NO2 (y mol) MZ = 9,25.4= 37 nZ = V/22,4= 0,5 mol
=> \(\frac{{{n_{{N_2}}}}}{{{n_{N{O_2}}}}} = \frac{9}{9} = \frac{1}{1}\) => nN2 = nNO2 = 0,5/2 =0,25 mol Gọi công thức chung của hỗn hợp kim loại là M, hóa trị n M0 → +ne a na 2N+5 + 10e→N20 0,5 2,5 0,25 N+5 +1e →N+4 0,25 0,25 0,25 Bảo toàn e : na = 2,5 + 0,25= 2,75 => na = 2,75 nHNO3 = n. nFe(NO3)n + nNO2 + 2nN2 = 2,75 + 0,25 +2.0,25= 3,5 mol Đáp án A Câu hỏi 5 : Nung 8,4 gam Fe trong không khí, sau một thời gian thu được m gam hỗn hợp chất rắn X gồm Fe, FeO, Fe3O4, Fe2O3. Hòa tan m gam hỗn hợp X vào dung dịch HNO3 đặc nóng dư thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là
Đáp án: A Phương pháp giải: Coi hỗn hợp X gồm Fe và O nFe = mFe/56= ? mol nO= x nNO2= V/22,4= ? mol Fe →Fe+3 +3e O0 +2e →O-2 N+5 + 1e→N+4 Bảo toàn e: ne Fe nhường = ne (N+5 nhận) Lời giải chi tiết: Coi hỗn hợp X gồm Fe và O nFe = 8,4/56= 0,15 mol nO= x nNO2= V/22,4=0,1 mol Fe →Fe+3 +3e 0,15 0,45 O0 +2e →O-2 x 2x N+5 + 1e→N+4 0,1 0,1 Bảo toàn e: 0,45 = 2x+0,1 => x= 0,175 => m = mFe + mO = 8,4 + 0,175.16=11,2 gam Đáp án A Câu hỏi 6 : Hòa tan hoàn toàn 15,2 gam chất rắn X gồm Cu, CuS, Cu2S và S bằng HNO3 dư thấy thoát ra 30,24 lít khí NO2 là sản phẩm khử duy nhất (đktc) v à dung dịch Y. Thêm dung dịch Ba(OH)2 dư vào dung dịch Y được m gam kết tủa. tính giá trị của m
Đáp án: B Phương pháp giải: Coi hỗn hợp gồm Cu và S x y => mhh = 64x+32y (1) nNO2= V/22,4= ? mol Cu0 →Cu+2 + 2e x 2x S0 →S+6 +6e y 6y N+5 +1e →N+4 Bảo toàn ne nhường = ne nhận => có phương trình (2) Từ (1) và (2) => x, y = ? Kết tủa : Cu(OH)2 , BaSO4 Bảo toàn nguyên tố Cu và S nCu(OH)2 = nCu = ? mol nBaSO4= nS = ? mol => mkết tủa Lời giải chi tiết: Coi hỗn hợp gồm Cu và S x y => 64x+32y= 15,2 (1) nNO2= V/22,4= 1,35 mol Cu0 →Cu+2 + 2e x 2x S0 →S+6 +6e y 6y N+5 +1e →N+4 1,35 1,35 2x+6y= 1,35(2) => x= 0,15 , y=0,175 dung dịch Y: Cu2+ : 0,15 mol, SO4 2- : 0,175 mol Kết tủa : Cu(OH)2 , BaSO4 Bảo toàn nguyên tố Cu và S nCu(OH)2 = nCu = 0,15 mol nBaSO4= nS = 0,175 mol => mkết tủa = 0,15.98 + 0,175.233= 55,475 gam Đáp án B Câu hỏi 7 : Hoà tan hoàn toàn 34,8 gam một oxit sắt dạng FexOy trong dung dịch H2SO4 đặc nóng. Sau phản ứng thu được 1,68 lít khí SO2 (sản phẩm khử duy nhất đo ở đktc). Oxit FexOy là
Đáp án: B Phương pháp giải: Coi oxit sắt gồm Fe, O Fe0 →Fe+3 + 3e x 3x O0 +2e→O-2 y 2y S+6 +2e→S+4 0,15 0,075 \(\left\{ \begin{gathered}
Lời giải chi tiết: Coi oxit sắt gồm Fe, O Fe0 →Fe+3 + 3e x 3x O0 +2e→O-2 y 2y S+6 +2e→S+4 0,15 0,075 \(\left\{ \begin{gathered} \(\frac{{F{\text{e}}}}{O} = \frac{{0,45}}{{0,6}} = \frac{3}{4}\) => Fe3O4 Đáp án B Câu hỏi 8 : Hòa tan hoàn toàn 3,76 gam hỗn hợp X ở dạng bột gồm S, FeS và FeS2 trong dung dịch HNO3 đặc nóng dư thu được 0,48 mol NO2 (là sản phẩm khử duy nhất) và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 dư, lọc và nung kết tủa đến khối lượng không đổi, được m gam hỗn hợp rắn Z. Giá trị của m là
Đáp án: C Phương pháp giải: coi hỗn hợp X gồm Fe và S x y => mX = 56x + 32y = 3,76 (1) Fe →Fe+3 +3e x 3x \(\begin{gathered} 0,48 0,48 Bảo toàn e => 3x +6y = 0,48 (2) (1), (2) => x= ? ; y = ? Y ( Fe3+, SO42- ) + Ba(OH)2 → Fe(OH)3, BaSO4 \(\xrightarrow{{nung}}\) Fe2O3, BaSO4 (Z) nFe2O3 = nFe3+ /2 = ? mol nBaSO4 = nSO4 = ? mol mZ = mFe2O3 + mBaSO4 Lời giải chi tiết: coi hỗn hợp X gồm Fe và S x y => mX = 56x + 32y = 3,76 (1) Fe →Fe+3 +3e x 3x \(\begin{gathered} 0,48 0,48 Bảo toàn e => 3x +6y = 0,48 (2) (1), (2) => x= 0,03, y=0,065 Y ( Fe3+, SO42- ) + Ba(OH)2 → Fe(OH)3, BaSO4 \(\xrightarrow{{nung}}\) Fe2O3, BaSO4 (Z) nFe2O3 = nFe3+ /2 = 0,015 mol nBaSO4 = nSO4 = 0,065 mol mZ = mFe2O3 + mBaSO4 = 160.0,015 + 233.0,065= 17,545 gam Đáp án C Câu hỏi 9 : Chia hỗn hợp X gồm Fe, Fe3O4, Fe(OH)3 và FeCO3 thành hai phần bằng nhau. Hòa tan hết phần 1 trong dung dịch HCl dư, thu được 1,568 lít (đktc) hỗn hợp khí có tỉ khối so với H2 bằng 10 và dung dịch chứa m gam muối. Hòa tan hoàn toàn phần 2 trong dung dịch chứa 0,345 mol H2SO4, thu được dung dịch chỉ chứa 34,56 gam hỗn hợp muối sunfat và 2,688 lít (đktc) hỗn hợp gồm hau khí (trong đó có khí SO2). Tính m. Phương pháp giải: Bảo toàn nguyên tố S Vì 2Fe(OH)3 ⇔Fe2O3.3H2O và FeCO3 ⇔ FeO.CO2 nên lược bỏ lượng CO2 (trong FeCO3) và lượng H2O (trong Fe(OH)3). Viết sơ đồ bài toán, áp dụng bảo toàn H, O Lời giải chi tiết: Phần 1 + dd HCl nhh khí(đktc) = 1,568/22,4 = 0,07 (mol); Mhh = 10×MH2 = 10.2 = 20 (g/mol) ⟹ mhh khí = n×M= 0,07.20 = 1,4 (g) Fe(OH)3 + 3HCl → FeCl3 + 3H2O (1) Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O (2) Fe + 2HCl → FeCl2 + H2↑ (3) FeCO3 + 2HCl → FeCl2 + CO2↑+ H2O (4) Hỗn hợp khí thu được gồm H2 và CO2. Đặt \(\left\{ \begin{array}{l}{n_{{H_2}}} = a(mol)\\{n_{C{O_2}}} = b(mol)\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{n_{hh}} = a + b = 0,07\\{m_{hh}} = 2a + 44b = 1,4\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,04 = {n_{{H_2}}}\\b = 0,03 = {n_{C{O_2}}}\end{array} \right.\) Theo PTHH (3): nFe = nH2 = 0,04 (mol) Theo PTHH (4): nFeCO3 = nCO2 = 0,03 (mol) Phần 2: Hỗn hợp 2 khí trong đó có SO2 ⟹ khí còn lại là CO2 nhh khí(đktc) = 2,688/22,4 = 0,12 (mol) ⟹ nSO2 = nhh - nCO2 = 0,12 – 0,03 = 0,09 (mol) 2Fe + 6H2SO4 (đặc) \(\xrightarrow{{{t^0}}}\)Fe2(SO4)3 + 3SO2 + 6H2O (5) 2FeCO3 + 4H2SO4 (đặc) \(\xrightarrow{{{t^0}}}\)Fe2(SO4)3 + SO2 + 2CO2 + 4H2O (6) 2Fe3O4 + 10H2SO4 (đặc) \(\xrightarrow{{{t^0}}}\)3Fe2(SO4)3 + SO2 + 10H2O (7) 2Fe(OH)3 + 3H2SO4 (đặc) \(\xrightarrow{{{t^0}}}\)Fe2(SO4)3 + 6H2O (8) Vì thu được hỗn hợp muối sunfat nên có thể xảy ra phản ứng sau: Fe + Fe2(SO4)3 → 3FeSO4 (9) Ta có sơ đồ: X + H2SO4 (0,345 mol) → \(34,56(g)\left\{ \begin{array}{l}FeS{O_4}\\F{e_2}{(S{O_4})_3}\end{array} \right. + \left\{ \begin{array}{l}S{O_2}:0,09\,mol\\C{O_2}:0,03\,mol\end{array} \right. + {H_2}O\) Bảo toàn nguyên tố S: nSO4(muối) = nH2SO4 – nSO2 = 0,345 – 0,09 = 0,225 (mol) ⟹ mFe(X) = mmuối sunfat – mSO4(muối) = 34,56 – 96.0,225 = 10,08 (g) Vì 2Fe(OH)3 ⇔Fe2O3.3H2O và FeCO3 ⇔ FeO.CO2 nên nếu lược bỏ lượng CO2 (trong FeCO3) và lượng H2O (trong Fe(OH)3) ta sẽ có 2 sơ dồ như sau: \(\left\{ \begin{array}{l}Fe:10,08\,(g)\\O:\,x(mol)\end{array} \right. + HCl \to m(g)\left\{ \begin{array}{l}FeC{l_2}\\FeC{l_3}\end{array} \right. + 0,04\,mol\,{H_2} + {H_2}O\,(1)\) \(\left\{ \begin{array}{l}Fe:10,08\,(g)\\O:\,x(mol)\end{array} \right. + 0,345\,mol\,{H_2}S{O_4} \to \left\{ \begin{array}{l}FeS{O_4}\\F{e_2}{(S{O_4})_3}\end{array} \right.(0,255\,mol\,S{O_4}) + 0,09\,mol\,S{O_2} + {H_2}O\,(2)\) BTNT “H”: nH2O(2) = nH2SO4 = 0,345 (mol BTNT “O”: x + 0,345.4 = 0,255.4 + 0,09.2 + 0,345 ⟹ x = 0,165 (mol) ⟹ nH2O(1) = 0,165 (mol) BTNT “H”: nHCl = 0,04.2 + 0,165.2 = 0,41 (mol) ⟹ nCl(muối) = 0,41 (mol) ⟹ m = 10,08 + 35,5.0,41 = 24,635 (g) Lưu ý: Bài toán không cho dữ liệu “sản phẩm không có muối amoni” như các đề thường thấy, nhưng theo tính chất cơ bản của sắt và hợp chất của sắt trong giới hạn chương trình xem như không tạo muối amoni” Câu hỏi 10 : Hòa tan hỗn hợp gồm FeO, Fe2O3 và F3O4 (có số mol bằng nhau) bằng dd H2SO4 20% (lượng axit lấy dư 50% so với lượng phản ứng vừa đủ), thu được dd A. Chia A thành bốn phần bằng nhau, mỗi phần có khối lượng 79,3 gam. Phần I tác dụng vừa đủ với V1 ml dung dịch KMnO4 0,05M. Phần II tác dụng vừa đủ với V2 ml dd brom 0,05M. Phần III tác dụng vừa đủ với V3 ml dd HI 0,05M. Cho Na2CO3 từ từ đến dư vào phần IV được V4 lít khí và m gam kết tủa. Giả thiết các phản ứng xảy ra hoàn toàn. Các thể tích khí đo ở đktc. Xác định các giá trị V1, V2, V3, V4. Phương pháp giải: Qui đổi hỗn hợp Lời giải chi tiết: m dd A = 4 . 79,3 = 317,2g Qui đổi hỗn hợp FeO, Fe2O3, Fe3O4về Fe3O4 có số mol là a Ta có 232a + (a . 4 . 1,5 . 98) : 0,2 = 317,2 => a = 0,1 mol Dd ban đầu \(\left\{ \matrix{F{e^{3 + }}:\,0,2 \hfill \cr F{e^{2 + }}:\,0,1 \hfill \cr} \right.\buildrel {1/4\,{\rm{dd}}} \over\longrightarrow \left\{ \matrix{F{e^{2 + }}:\,0,025 \hfill \cr F{e^{3 + }}:\,0,05 \hfill \cr H{}_2S{O_4}\,du:\,0,05 \hfill \cr} \right.\) Phần 1: 8H2SO4 + 2KMnO4 + 10FeSO4 → 5Fe2(SO4)3 + 8H2O + 2MnSO4 + K2SO4 0,05 0,025 => FeSO4 phản ứng hết => nKMnO4 = 0,005mol => V1= 0,1 lít = 100ml Phần 2: 2Fe2+ + Br2 → 2Fe3+ + 2Br- 0,025 0,0125 => V2 = 0,25 lít = 250ml Phần 3: 2Fe3+ + 2I- → 2Fe2+ + I2 0,05 0,05 => V3 = 1 lít = 1000ml Phần 4: Fe2+ + CO32- → FeCO3↓ 0,025 0,025 0,025 2Fe3+ + 3CO32- + 3H2O → 2Fe(OH)3 + 3CO2 0,05 0,075 0,05 0,075 2H+ + CO32- →CO2 + H2O 0,1 0,05 0,05 => nCO2 = 0,125 => V4 = 2,8 lít m kết tủa = mFeCO3 + mFe(OH)3 = 8,25g Quảng cáo
|