Câu hỏi:
Cho 3,72 gam hỗn hợp gồm Mg và Al vào V ml dung dịch chứa AgNO3 x (mol/l) và Cu(NO3)2 y (mol/l). Sau khi kết thúc phản ứng, thu được dung dịch X và 20 gam chất rắn Y. Cho dung dịch NaOH dư vào X, thấy lượng NaOH phản ứng là 18,4 gam. Lọc lấy kết tủa, nung ngoài không khí đến khối lượng không đổi, thu được 7,6 gam hỗn hợp gồm hai oxit. Tỉ lệ x : y là
- A 4 : 5
- B 2 : 3
- C 1 : 1
- D 1 : 3
Phương pháp giải:
Do cho X tác dụng với NaOH dư sau đó nung kết tủa thu được 2 oxit nên 2 oxit là MgO và CuO
=> Trong phản ứng đầu Mg, Al hết, Cu(NO3)2 dư
Sơ đồ:
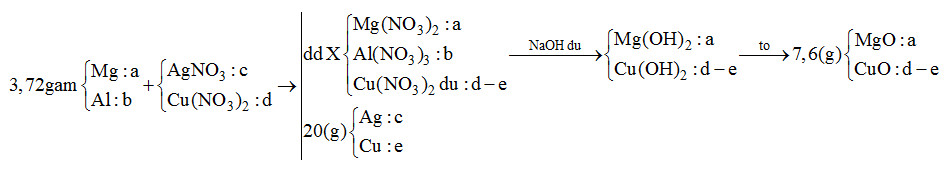
mMg + mAl = 24a + 27b = 3,72 (1)
mAg + mCu = 108c + 64e = 20 (2)
nNaOH = 2nMg2+ + 4nAl3+ + 2nCu2+ => 2a + 4b + 2(d-e) = 0,46 (3)
mMgO + mCuO = 40a + 80 (d-e) = 7,6 (4)
BTe: 2nMg + 3nAl = nAg + 2nCu => 2a + 3b = c + 2e (5)
Giải hệ thu được a, b, c, d, e
=> x : y = c : d
Lời giải chi tiết:
Do cho X tác dụng với NaOH dư sau đó nung kết tủa thu được 2 oxit nên 2 oxit là MgO và CuO
=> Trong phản ứng đầu Mg, Al hết, Cu(NO3)2 dư
Sơ đồ:
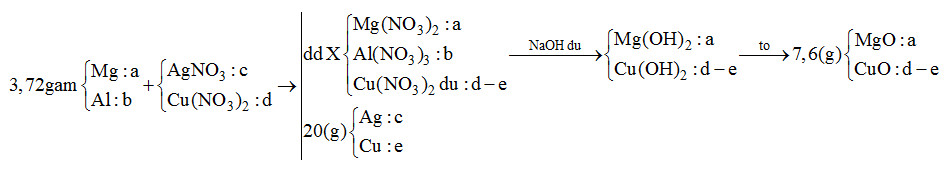
mMg + mAl = 24a + 27b = 3,72 (1)
mAg + mCu = 108c + 64e = 20 (2)
nNaOH = 2nMg2+ + 4nAl3+ + 2nCu2+ => 2a + 4b + 2(d-e) = 0,46 (3)
mMgO + mCuO = 40a + 80 (d-e) = 7,6 (4)
BTe: 2nMg + 3nAl = nAg + 2nCu => 2a + 3b = c + 2e (5)
Giải 5 phương trình trên thu được a = 0,11; b = 0,04; c = 0,12; d = 0,15; e = 0,11
=> x : y = c : d = 0,12 : 0,15 = 4 : 5
Đáp án A


















