Câu hỏi:
Cho 40 ml dung dịch HCl 0,75 M vào 160 ml dung dịch chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M. pH của dung dịch thu được là:
- A 10
- B 12
- C 3
- D 2
Phương pháp giải:
Lời giải chi tiết:
Đáp án: B
$${n_{HCl}} = 0,03{\rm{ ( mol ) ; }}{{\rm{n}}_{Ba{{(OH)}_2}}} = {\rm{ }}0,0128{\rm{ (mol) ; }}{{\rm{n}}_{KOH}}{\rm{ = 0,0064 ( mol )}}$$
$$\sum {{n_{O{H^ - }}}} {\rm{ = 2}}{\rm{.0,0128 + 0,0064 = 0,032 ( mol )}}$$
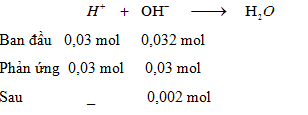
$${n_{O{H^ - }d}}{\rm{ }} = {\rm{ }}0,002{\rm{ (mol) = > }}{{\rm{C}}_M}{\rm{ = }}{{0,002} \over {(40 + 160){{.10}^{ - 3}}}}{\rm{ }} = {\rm{ }}0,01{\rm{ }}(M)$$
=> pH = 14 - log([OH−) = 14 - 2 = 12
Quảng cáo


















