Câu hỏi:
Hòa tan hoàn toàn m gam hỗn hợp gồm Al và Al2O3 trong 200 ml dung dịch HCl 2M, thu được 1,68 lít khí H2 và dung dịch X. Cho từ từ dung dịch NaOH 1M vào X, kết quả thí nghiệm được ghi ở bảng sau:
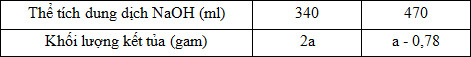
Giá trị của m là
- A 3,30.
- B 3,90.
- C 1,65.
- D 4,50.
Phương pháp giải:
Bảo toàn electron, bảo toàn nguyên tố.
Sử dụng công thức tính nhanh của bài toán cho từ từ OH- vào dung dịch chứa {H+, Al3+}:
+ Khi kết tủa chưa bị hòa tan: nOH- = nH+ + 3nAl(OH)3
+ Khi kết tủa bị hòa tan một phần: nOH- = nH+ + 4nAl3+ - nAl(OH)3
Lời giải chi tiết:
BTe => nAl = 2/3.nH2 = 2/3.0,075 = 0,05 mol. Đặt nAl2O3 = x mol
Do hỗn hợp bị hòa tan hết => 3nAl3+ ≤ nCl- => nAl3+ ≤ 0,4/3 => mAl(OH)3 ≤ 10,4 gam
Mặt khác, ta thấy mAl(OH)3 tại V = 470ml < mAl(OH)3 tại V = 340 ml nên suy ra tại V = 470 ml thì Al(OH)3 đã bị hòa tan 1 phần.
Xét 2 trường hợp sau:
+ TH1: Tại V = 340 ml, Al(OH)3 bị hòa tan một phần
=> nNaOH (2) - nNaOH (1) = nAl(OH) (1) - nAl(OH)3 (2)
=> \(0,47 - 0,34 = \frac{{2a}}{{78}} - \frac{{a - 0,78}}{{78}}\) => a = 9,36 => 2a = 18,72 gam không thỏa mãn mAl(OH)3 < 10,4 gam (loại)
+ TH2: Tại V = 340 ml, Al(OH)3 chưa bị hòa tan
\(\left\{ \matrix{
{n_{Al}}:0,05 \hfill \cr
{{\rm{n}}_{A{l_2}{O_3}}}:x \hfill \cr} \right.\buildrel { + {{\rm{H}}^ + }:0,4} \over
\longrightarrow {\rm{dd X }}\left\{ \matrix{
\buildrel {BT:Al} \over
\longrightarrow A{l^{3 + }}:0,05 + 2x \hfill \cr
{H^ + }du:0,25 - 6x( = 0,4 - 2{n_{{H_2}}} - 6{n_{A{l_2}{O_3}}}) \hfill \cr} \right.\)
\(\left\{ \matrix{
{n_{O{H^ - }}} = {n_{{H^ + }}} + 3{n_ \downarrow } \hfill \cr
{n_{O{H^ - }}} = {n_{{H^ + }}} + 4{n_{A{l^{3 + }}}} - {n_ \downarrow } \hfill \cr} \right. \to \left\{ \matrix{
0,34 = 0,25 - 6x + 3.{{2a} \over {78}} \hfill \cr
0,47 = 0,25 - 6x + 4.(0,05 + 2x) - {{a - 0,78} \over {78}} \hfill \cr} \right.\)
\) \to \left\{ \matrix{
a = 3,12 \hfill \cr
x = 0,025 \hfill \cr} \right. \to m = 0,05.27 + 0,025.102 = 3,9\,gam\)
Đáp án B


















