Dựa vào giá trị độ âm điện của S là 2,58 và O là 3,44. Loại liên kết trong các phân tử SO3 là
-
A.
liên kết cộng hoá trị không phân cực.
-
B.
liên kết hydrogen.
-
C.
liên kết cộng hoá trị phân cực.
-
D.
liên kết ion.
Dựa vào hiệu độ âm điện.
Liên kết trong phân tử SO3 là liên kết cộng hóa trị không phân cực.
Đáp án A
Đáp án : A

Các bài tập cùng chuyên đề
Bài 1 :
Nguyên tử hydrogen và chlorine dễ dàng kết hợp để tạo thành phân tử hydrogen chloride (HCl), liên kết trong trường hợp này có gì khác so với liên kết ion trong phân tử sodium chloride (NaCl)?Bài 2 :
Viết công thức electron, công thức cấu tạo và công thức Lewis của các phân tử:
a) Bromine (Br2). b) Hydrogen sulfide (H2S).
c) Methane (CH4). d) Ammonia (NH3).
e) Ethene ( C2H4). g) Ethyne (C2H2).
Bài 3 :
Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hóa trị không phân cực?
A. N2, CO2, Cl2, H2.
B. N2, Cl2, H2, HCl.
C. N2, HI, Cl2, CH4
D. Cl2, O2, N2, F2.
Bài 4 :
Dựa vào giá trị độ âm điện của các nguyên tử trong bảng 6.2, xác định loại liên kết trong phân tử các chất: CH4, CaCl2, HBr, NH3.
Bài 5 :
Công thức của CH2O có thể biểu diễn ở dạng công thức (1) hoặc ở dạng công thức (2). Hãy viết công thức của N2 theo cách (2) và cho biết công thức này có thể hiện được quy tắc octet hay không?
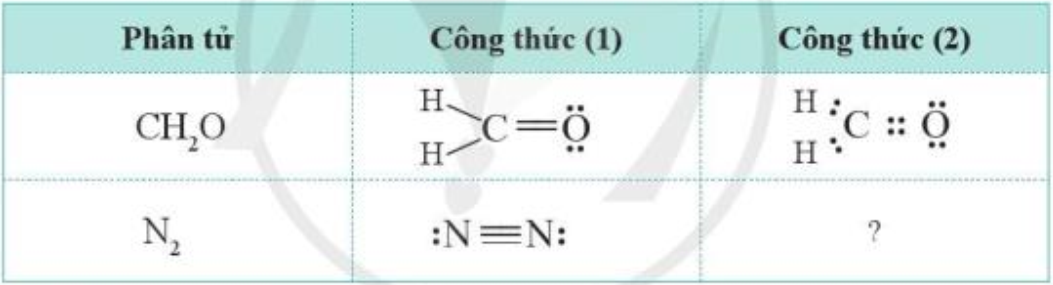
Bài 6 :
Mỗi nguyên tử trong phân tử HF (Hình 11.1) có bao nhiêu electron chung, bao nhiêu electron hóa trị riêng (electron thuộc về một nguyên tử).
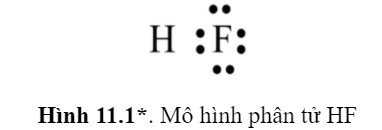
Bài 7 :
Trong phân tử HCl, lớp electron ngoài cùng của Cl và H lần lượt có bao nhiêu electron?
Bài 8 :
Nguyên tử fluorine (F) có cấu hình electron là [He]2s22p5. Khi các nguyên tử F liên kết với nhau, để thỏa mãn quy tắc octet, một bạn học sinh đề xuất như sau: Một nguyên tử F nhường 7 electron, tạo ion F7+ có cấu hình là [He]; 7 nguyên tử F khác, mỗi nguyên tử nhận 1 electron tạo 7 ion F- có cấu hình [Ne]. Sau đó 8 ion này hút nhau tạo thành chất có công thức (F7+)(F-)7. Vì sao đề xuất này không hợp lí trong thực tế? Hãy mô tả sự hình thành liên kết trong phân tử F2.
Bài 9 :
Hãy biểu diễn sự hình thành các cặp electron chung cho phân tử NH3. Từ đó, viết công thức Lewis của phân tử này.
Bài 10 :
Viết công thức Lewis của CO2. Giữa nguyên tử carbon và mỗi nguyên tử oxygen có bao nhiêu cặp electron chung?
Bài 11 :
Mô tả sự hình thành phân tử N2 từ hai nguyên tử N. Phân tử N2 có bao nhiêu cặp electron dùng chung? Viết công thức Lewis của N2.
Bài 12 :
Những nguyên tử nào trong cation ammonium thỏa mãn quy tắc octet?
Bài 13 :
Liên kết giữa nguyên tử N trong NH3 với H+ có phải là liên kết ion hay không? Vì sao?
Bài 14 :
Trình bày sự hình thành ion hydronium (H3O+) từ H2O và H+
Bài 15 :
Bài 1: Những phát biểu nào sau đây đúng?
(a) Nếu cặp electron chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị không cực.
(b) Nếu cặp electron chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị có cực.
(c) Cặp electron chung luôn được tạo nên từ 2 electron của cùng một nguyên tử.
(d) Cặp electron chung được tạo nên từ 2 electron hóa trị.
Bài 16 :
Trong việc hình thành liên kết hóa học, không phải lúc nào các nguyên tử cũng cho, nhận electron hóa trị với nhau như trong liên kết ion. Thay vào đó, chúng có thể cùng nhau sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet. Trong trường hợp này, một loại liên kết hóa học mới được hình thành. Đó là loại liên kết gì?

Bài 17 :
Quan sát các Hình 10.1 đến 10.3, cho biết quy tắc octet đã được áp dụng ra sao khi các nguyên tử tham gia hình thành liên kết.
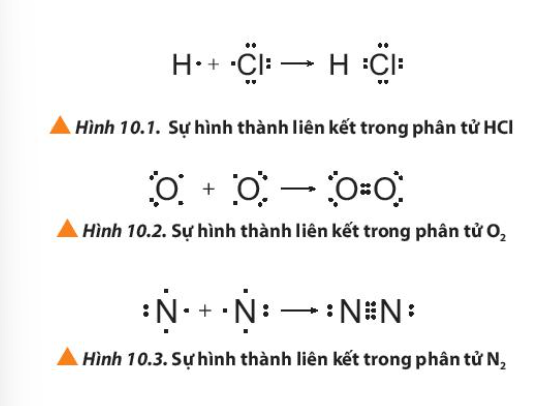
Bài 18 :
Giải thích sự hình thành liên kết trong các phân tử HCl, O2 và N2
Bài 19 :
Trình bày sự hình thành liên kết cộng hóa trị trong phân tử Cl2Bài 20 :
Trình bày sự hình thành liên kết cộng hóa trị trong phân tử NH3Bài 21 :
Biết phân tử CO cũng có liên kết cho – nhận. Viết công thức electron và công thức cấu tạo của CO
Bài 22 :
Cho biết đặc điểm của nguyên tử “cho” và nguyên tử “nhận” trong phân tử có liên kết cho – nhận.
Bài 23 :
Trình bày liên kết cho – nhận trong ion NH4+Bài 24 :
Liên kết cộng hóa trị trong phân tử dạng A2 luôn là liên kết cộng hóa trị phân cực hay không phân cực? Giải thích.
Bài 25 :
Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe
B. Ne
C. Ar
D. Kr
Bài 26 :
Hydrogen sulfide (H2S) và phosphine (PH3) đều là những chất có mùi khó ngửi và rất độc. Trình bày sự tạo thành liên kết cộng hóa trị trong phân tử các chất trên.
Bài 27 :
Trình bày sự hình thành liên kết cho – nhận trong phân tử sulfur dioxide (SO2)
Bài 28 :
Mô tả sự tạo thành liên kết trong phân tử chlorine bằng sự xen phủ của các AO
Bài 29 :
Trong việc hình thành liên kết hóa học, không phải lúc nào các nguyên tử cũng cho, nhận electron hóa trị với nhau như trong liên kết ion. Thay vào đó, chúng có thể cùng nhau sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet. Trong trường hợp này, một loại liên kết hóa học mới được hình thành. Đó là loại liên kết gì?
Bài 30 :
Giải thích vì sao ở điều kiện thường không tồn tại phân tử NaCl riêng biệt mà là tinh thể NaCl.


















Danh sách bình luận