Hòa tan hoàn toàn 7,98g hỗn hợp gồm Mg và Al trong dung dịch chứa a mol H2SO4, sau khi kết thúc phản ứng thu được 8,96 lit khí H2 và dung dịch X. Cho từ từ dung dịch NaOH 1M vào X, sự phụ thuộc số mol kết tủa và thể tích dung dịch NaOH 1M được cho như trong đồ thị sau :
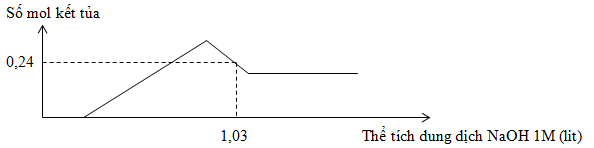
Giá trị của a là
-
A.
0,42
-
B.
0,44
-
C.
0,48
-
D.
0,45
+) Bảo toàn e : 2nMg + 3nAl = 2nH2 và : mMg + mAl => khối lượng Mg và Al
Tại nkết tủa = 0,24 mol => nkết tủa = nMg(OH)2 + [4nAl3+ - (nOH - nH+ - 2nMg(OH)2)]
=> nH+ => a
Sau 1 thời gian thêm NaOH thì mới có kết tủa => H+ dư
Bảo toàn e : 2nMg + 3nAl = 2nH2 = 0,8 mol
Và : mMg + mAl = 7,98g
=> nMg = 0,13 ; nAl = 0,18 mol
Tại thời điểm nkết tủa = 0,24 mol thì kết tủa đang tan dần
=> nkết tủa = nMg(OH)2 + [4nAl3+ - (nOH - nH+ - 2nMg(OH)2) ]
=> 0,24 = 0,13 + [4.0,18 – (1,03 – nH+ - 2.0,13)]
=> nH+ = 0,16 mol
=> a = ½ . 0,16 + nH2 = 0,48
Đáp án : C

Các bài tập cùng chuyên đề

















