Trong phòng thí nghiệm người ta điều chế NO2 bằng cách cho Cu tác dụng với HNO3 đặc, đun nóng. NO2 có thể chuyển thành N2O4 theo cân bằng: 2NO2(g) N2O4(g)
Cho biết NO2 là khí có màu nâu và N2O4 là khí không màu. Khi ngâm bình chứa NO2 vào chậu nước đá thấy màu trong bình khí nhạt dần. Hỏi phản ứng thuận trong cân bằng trên là:
-
A.
Tỏa nhiệt
-
B.
Thu nhiệt
-
C.
Không tỏa hay thu nhiệt
-
D.
Một phương án khác
Dựa vào nguyên lí chuyển dịch cân bằng Le – Chatelier.
Phản ứng trên là phản ứng tỏa nhiệt vì phản ứng tỏa nhiệt vì NO2 (nâu đỏ) chuyển dần sang N2O4 (không màu) nên thấy màu trong bình khí nhạt dần.
Đáp án A
Đáp án : A

Các bài tập cùng chuyên đề
Bài 1 :
Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
CH3COONa + H2O ⇌CH3COOH + NaOH \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ > 0}}\)
Bài 2 :
Nghiên cứu ảnh hưởng của nồng độ đến sự chuyển dịch cân bằng:
CH3COOH + NaOH ⇌ CH3COONa + H2O
Thí nghiệm nghiên cứu ảnh hưởng của nồng độ đến sự chuyển dịch cân bằng trên được thực hiện như sau:
Bài 3 :
Cho các cân bằng sau:
a) 2SO2(g) + O2(g) ⇌ 2SO3(g)
b) CO(g) + H2O(g) ⇌ H2(g) + CO2(g)
c) PCl5(g) ⇌ Cl2(g) + PCl3(g)
d) H2(g) + I2(g) ⇌ 2HI(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích.
Bài 4 :
Trong cơ thể người, hemoglobin (Hb) kết hợp với oxygen theo phản ứng thuận nghịch được biểu diễn đơn giản như sau:
Hb + O2 ⇌ HbO2
Ở phổi, nồng độ oxygen lớn nhất nên cân bằng trên chuyển dịch sang phải, hemoglobin kết hợp với oxygen. Khi đến các mô, nồng độ oxygen thấp, cân bằng trên chuyển dịch sang trái, giải phóng oxygen. Nếu thiếu oxygen ở não, con người có thể bị đau đầu, chóng mặt.
a) Vận dụng nguyên lí chuyển dịch cân bằng Le Chatelie, em hãy đề xuất biện pháp để oxygen lên não được nhiều hơn?
b) Khi lên núi cao, một số người cũng gặp hiện tượng bị đau đầu, chóng mặt. Dựa vào cân bằng trên, em hãy giải thích hiện tượng này.
Bài 5 :
Cho các cân bằng sau:
CaCO3(s) ⇌ CaO(s) + CO2(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = {\rm{176 kJ}}\)
2SO2(g) + O2(g) ⇌ 2SO3(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = - 198{\rm{ kJ}}\)
Nếu tăng nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích.
Bài 6 :
Hằng số K C của một phản ứng phụ thuộc vào yếu tố nào sau đây?
A. Không có tốc độ. B. Nhiệt độ. C. Áp dụng. D. Căng thẳng.
Bài 7 :
Vận dụng kiến thức về cân bằng hoá học, tốc độ phản ứng, biến thiên enthalpy để giải thích các điều kiện của phản ứng sản xuất ammonia, cụ thể:
1. Nếu tăng hoặc giảm nhiệt độ sẽ ảnh hưởng đến sự chuyển dịch cân bằng và tốc độ phản ứng như thế nào?
2. Nếu giảm áp suất, cân bằng chuyển dịch theo chiều nào? Tại sao không thực hiện ở áp suất cao hơn?
3. Vai trò của chất xúc tác trong phản ứng là gì?
Bài 8 :
Nhận xét hiện tượng xảy ra trong thí nghiệm 2.
Bài 9 :
Cho biết chiều nào của phản ứng (1) là chiều thu nhiệt và chiều nào là chiều tỏa nhiệt.
Bài 10 :
Hãy cho biết cân bằng chuyển dịch theo chiều nào khi thêm một lượng khí CO vào hệ cân bằng:
C(s) + CO2(g) ⇌ 2CO(g)
Bài 11 :
Dựa vào nguyên lí chuyển dịch cân bằng Le Chatelier, hãy cho biết để tăng hiệu suất phản ứng tổng hợp NH3 cần điều chỉnh nhiệt độ và áp suất như thế nào. Điều đó có gây trở ngại gì cho phản ứng tổng hợp NH3 trên thực tế hay không? Vì sao?
Bài 12 :
Cho cân bằng hoá học:
Cân bằng chuyển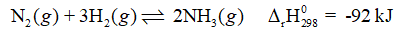 dịch theo chiều nào (có giải thích) khi:
dịch theo chiều nào (có giải thích) khi:
a) tăng nhiệt độ.
b) tách ammonia ra khỏi hỗn hợp phản ứng.
c) giảm thể tích của hệ phản ứng.
Bài 13 :
Hãy giải thích vì sao ở giai đoạn tạo ra SO2 người ta chọn điều kiện phản ứng ở nhiệt độ cao (450 °C - 500 °C).
Bài 14 :
Methanol (CH3OH) là nguyên liệu quan trọng trong công nghiệp hoá học. Dựa vào hằng số cân bằng của các phản ứng ở 25 °C, hãy lựa chọn phản ứng thích hợp để điều chế CH3OH. Giải thích.
Bài 15 :
Dựa vào thí nghiệm 2, cho biết khi tăng nhiệt độ thì cân bằng (9) chuyển dịch theo chiều thuận hay chiều nghịch?
Bài 16 :
Quá trình tổng hợp NH3 trong công nghiệp từ N2, và H2 nên thực hiện ở áp suất cao hay áp suất thấp? Giải thích. Tìm hiểu thông tin, cho biết phản ứng tổng hợp NH3 ở các nhà máy thường được thực hiện ở áp suất nào.
Bài 17 :
Phát biểu nào sau đây về một phản ứng thuận nghịch tại trạng thái cân bằng là sai?
A. Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
B. Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
C. Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm phản ứng.
D. Phản ứng thuận và phản ứng nghịch vẫn diễn ra.
Bài 18 :
“Nhờ có chất xúc tác nên phản ứng giữa SO2 và O2 ưu tiên diễn ra theo chiều thuận". Phát biểu trên là đúng hay sai? Giải thích.
Bài 19 :
Yếu tố nào sau đây luôn luôn khônglàm dịch chuyển cân bằng của hệ phản ứng?
A. Nhiệt độ. B. Áp suất. C. Nồng độ. D. Chất xúc tác.
Bài 20 :
Xét các hệ cân bằng sau trong một bình kín:
a) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\)= 131 kJ
b) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\)= -41 kJ
Các cân bằng trên dịch chuyển theo chiều nào khi thay đổi một trong các điều kiện sau?
(1) Tăng nhiệt độ.
(2) Thêm lượng hơi nước vào hệ.
(3) Thêm khí H2, vào hệ.
(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống.
(5) Dùng chất xúc tác.
Bài 21 :
Từ hiện tượng ở thí nghiệm 1, cho biết khi làm lạnh bình (2) và làm nóng bình (3) thì cân bằng trong mỗi bình chuyển dịch theo chiều tỏa nhiệt hay thu nhiệt.
Bài 22 :
Khi đẩy hoặc kéo pít-tông thì số mol khí của hệ (2) thay đổi như thế nào?
Bài 23 :
Người ta thường sản xuất vôi bằng phản ứng nhiệt phân calcium carbonate theo phương trình nhiệt hóa học sau:
CaCO3 ⇌ CaO + CO2
Để nâng cao hiệu suất phản ứng sản xuất vôi, cần điều chỉnh nhiệt độ như thế nào? Giải thích.
Bài 24 :
Phản ứng tổng hợp ammonia:
N2 + 3H2 ⇌ 2NH3
Để thu được NH3 với hiệu suất cao, cần điều chỉnh áp suất như thế nào?
Bài 25 :
Thành phần chính của tinh dầu chuối là ester CH3COOCH2CH2CH(CH3)2. Để thu được hỗn hợp chất chứa nhiều ester này thì cần thay đổi nồng độ các chất như thế nào trong cân bằng:
CH3COOOH (aq) + ROH (aq) ⇌ CH3COOR (aq) + H2O (l)
Với R là (CH3)2 CH CH2CH2-
Bài 26 :
Cân bằng sau chuyển dịch theo chiều nào khi tăng nhiệt độ?
2SO2 (g) + O2 (g) ⇌ 2SO3 (g) \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{ = - 197}}{\rm{,8 kJ}}\]
Bài 27 :
Cân bằng 2NO2 (g) ⇌ N2O4 (g) chuyển dịch theo chiều nào khi tăng áp suất của hỗn hợp (bằng cách nén hỗn hợp) ở điều kiện nhiệt độ không đổi. Biết rằng áp suất tỉ lệ với số mol chất khí.
Bài 28 :
Từ Thí nghiệm 1, hãy cho biết:
a) Dựa vào dấu hiệu nào để biết trạng thái cân bằng của phản ứng (8) bị chuyển dịch khi thay đổi nhiệt độ.
b*) Khi tăng nhiệt độ hoặc giảm nhiệt độ, cân bằng chuyển dịch theo chiều thu nhiệt hay toả nhiệt?
Bài 29 :
Đốt phản ứng xảy ra trong lò luyện gang:
Fe 2 O 3 ( s ) + 3CO( g ) ⇌ 2Fe(s) + 3CO 2 ( g ) ∆ r H o < 0
nhẹ các yếu tố (nồng độ, nhiệt độ, áp suất) cần tác động vào cân bằng để cân bằng chuyển dịch về bên phải (làm tăng hiệu suất của phản ứng)
Bài 30 :
Trong công nghiệp, khí hydrogen được điều chế như sau:
Cho hơi nước đi qua than nung nóng, thu được hỗn hợp khí CO và H2 (gọi là khí than ướt):
C(s) + H2O(g) ⇌ CO(g) + H2
Trộn khí than ướt với hơi nước, cho hỗn hợp đi qua chất xúc tác Fe2O3:
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
a) Vận dụng nguyên lí Le Chatelier, hãy cho biết cần tác động yếu tố nhiệt độ như thế nào để các cân bằng (1), (2) chuyển dịch theo chiều thuận.
b)Trong thực tế, ở phản ứng (2), lượng hơi nước được lấy dư nhiều (4 – 5 lần) so với khí carbon monoxide. Giải thích.
c) Nếu tăng áp suất, cân bằng (1), (2) chuyển dịch theo chiều nào? Giải thích.


















Danh sách bình luận