Phát biểu nào sau đây không đúng?
-
A.
phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau trong cùng một điều kiện.
-
B.
khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, lượng các chất sẽ không đổi.
-
C.
sự chuyển dịch cân bằng của phản ứng: 2NO2(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)N2O4(g) phụ thuộc sự thay đổi áp suất.
-
D.
cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoàn toàn.
Dựa vào cân bằng hóa học.
D sai, vì cân bằng hóa học là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch và tại đó phản ứng vẫn tiếp tục xảy ra.
Đáp án D
Đáp án : D

Các bài tập cùng chuyên đề
Bài 1 :
Cho cân bằng \(C{H_4}(g) + {H_2}O(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CO(g) + 3{H_2}(g)\). Khi giảm nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này là:
-
A.
Phản ứng thuận tỏa nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ
-
B.
Phản ứng nghịch tỏa nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ
-
C.
Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ
-
D.
Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi giảm nhiệt độ
Bài 2 :
Phản ứng hóa học là quá trình biến đổi các chất đầu thành sản phẩm. Tuy nhiên có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng với nhau tạo thành chất đầu. Đối với những phản ứng này, làm thế nào để thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng?
Bài 3 :
Quá trình hình thành hang động, thạch nhũ là một ví dụ điển hình về phản ứng thuận nghịch trong tự nhiên.
Nước có chức CO2 chảy qua đá vôi, bào mòn đá tạo thành Ca(HCO3)2 (phản ứng thuận) góp phần hình thành các hang động. Hợp chất Ca(HCO3)2 trong nước lại bị phân hủy tạo ra CO2 và CaCO3 (phản ứng nghịch), hình thành các thạch nhũ, măng đá, cột đá.
Bài 4 :
Bài 5 :
Câu hỏi mở đầu: Trong các phản ứng hoá học, có một loại phản ứng trong đó các chất sản phẩm có khả năng phản ứng để tạo thành các chất đầu. Do vậy, phản ứng xảy ra không hoàn toàn và thường có hiệu suất không cao. Phản ứng tổng hợp ammonia từ nitrogen và hydrogen thuộc loại phản ứng này. Các phản ứng này được gọi là phản ứng gì? Để tăng hiệu suất của chúng, cần điều chỉnh những điều kiện phản ứng như nhiệt độ, áp suất, nồng độ,... như thế nào?
Bài 6 :
Phản ứng Cl2 tác dụng với H2O có đặc điểm gì khác với phản ứng nhiệt phân thuốc tím?
Bài 7 :
Khí NO2 (màu nâu đỏ) liên tục chuyển hoá thành khí N2O4 (không màu) và ngược lại, tại một điều kiện xác định. Tại điều kiện này, khí NO2 cũng như khí N2O4 trong các bình riêng biệt (Hình 1.1), sau một thời gian đều chuyển thành hỗn hợp khí có thành phần như nhau và không đổi theo thời gian.
Tại thời điểm hỗn hợp khí trong hai bình có thành phần như nhau, có phản ứng diễn ra trong hai bình này hay không?
Bài 8 :
Hãy nêu một số ví dụ về phản ứng thuận nghịch mà em biết.
Bài 9 :
Trong các hang động đá vôi thường xảy ra hiện tượng hình thành thạch nhũ và xâm thực của nước mưa vào đá vôi theo phương trình hóa học sau:
CaCO3 + CO2 + H2O ⇌ Ca(HCO3)2
Hãy giải thích quá trình này.
Bài 10 :
Khi đun nóng, phản ứng trong bình (1) chuyển dịch theo chiều nào?
Bài 11 :
Quan sát Hình 1.2, nhận xét về tốc độ của phản ứng thuận và tốc độ của phản ứng nghịch theo thời gian trong điều kiện nhiệt độ không đổi. Nồng độ các chất trong phản ứng thay đổi như thế nào?
Bài 12 :
Dựa vào phương trình hóa học của phản ứng điều chế khí oxygen từ KMnO4, em hãy cho biết phản ứng có xảy ra theo chiều ngược lại được không?
Bài 13 :
Viết phương trình hóa học của phản ứng một chiều mà em biết.
Bài 14 :
Phản ứng thuận nghịch có xảy ra hoàn toàn được không? Vì sao?
Bài 15 :
Xét Ví dụ 2:
a) Giải thích vì sao màu tím của hỗn hợp khí lại nhạt dần so với lúc mới bắt đầu trộn hai khí H2 và I2, với nhau.
b) Sau một khoảng thời gian, màu tím của hỗn hợp không thay đổi, chứng tỏ nồng độ của chất nào không thay đổi?
Bài 16 :
Nhận xét nào sau đây không đúng?
A. Trong phản ứng một chiều, chất sản phẩm không phản ứng được với nhau tạo thành chất đầu.
B. Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau để tạo thành chất đầu.
C. Phản ứng một chiều là phản ứng luôn xảy ra không hoàn toàn.
D. Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau trong cùng điều kiện.
Bài 17 :
Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g).
Số liệu về sự thay đổi số mol các chất trong bình phản ứng ở thí nghiệm 1 được trình bày trong Bảng 1.1 dưới đây:
a) Vẽ đồ thị biểu diễn sự thay đổi số mol các chất theo thời gian.
b) Từ đồ thị, nhận xét về sự thay đổi số mol của các chất theo thời gian.
c) Viết biểu thức định luật tác dụng khối lượng đối với phản ứng thuận và phản ứng nghịch, từ đó dự đoán sự thay đổi tốc độ của mỗi phản ứng theo thời gian (biết các phản ứng này đều là phản ứng đơn giản).
d) Bắt đầu từ thời điểm nào thì số mol các chất trong hệ phản ứng không thay đổi nữa?
Bài 18 :
Hai thí nghiệm sau đều được thực hiện ở cùng một điều kiện (bình kín dung tích 10 L, nhiệt độ 445 oC):
Thực hiện yêu cầu sau:
a) Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm 1 và thí nghiệm 2.
b) Trong cả hai thí nghiệm trên, dù thời gian phản ứng kéo dài bao lâu thì các chất đầu đều còn lại sau phản ứng. Giải thích.
Bài 19 :
Cho các nhận xét sau:
a) ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
b) ở trạng thái cân bằng, các chất không phản ứng với nhau.
c) ở trạng thái cân bằng, nồng độ các chất sản phẩm luôn lớn hơn nồng độ các chất đầu.
d) ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Các nhận xét đúng là:
A. (a ) và (b ). B .(b ) và (c ). C . (a ) và (c). D. (a ) và (d ).
Bài 20 :
Cho 5 mol H2 và 5 mol I2 vào bình kín dung tích 1 lít và nung nóng đến 227 °C . Đồ thị biểu diễn sự thay đổi nồng độ các chất theo thời gian được cho trong hình sau:
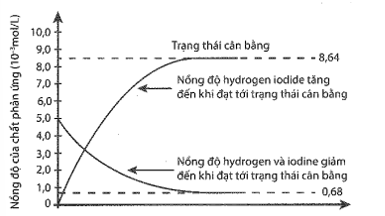
Nồng độ của HI ở trạng thái cân bằng là
A. 0,68 M. B. 5,00 M. C.3,38 M. D. 8,64 M.
Bài 21 :
Phản ứng nào sau đây là phản ứng thuận nghịch?
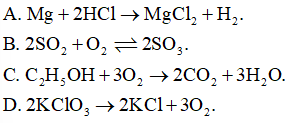
Bài 22 :
Lượng đường glucose trong máu người thường ổn định ở nồng độ khoảng 0,1%. Khi ta ăn tinh bột, glucose sẽ được sinh ra trong cơ thể; còn khi cơ thể vận động và hoạt động trí não, glucose bị tiêu thụ.
a) Em hãy tìm hiểu để giải thích vì sao lượng glucose trong máu luôn ổn định ở mức khoảng 0,1%.
b) Theo em, khi cơ thể hoạt động thể thao hay khi ăn uống sẽ xảy ra đồng thời hai quá trình sinh ra và mất đi glucose? Giải thích. Sự ổn định của glucose trong máu có thể được coi là trạng thái cân bằng hoá học không? Nếu có, hãy đề xuất cân bằng đó.
Bài 23 :
Quan sát Hình 1.2 và chọn phát biểu đúng.
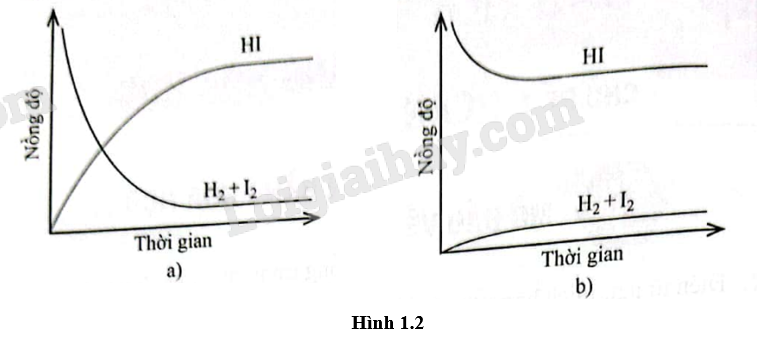
A. Cả hai đồ thị đều mô tả phản ứng đã đạt đến trạng thái cân bằng.
B. Cả hai đồ thị đều không mô tả phản ứng đã đạt đến trạng thái cân bằng.
C. Chỉ đồ thị (a) mô tả phản ứng đã đạt đến trạng thái cân bằng.
D. Chỉ đồ thị (b) mô tả phản ứng đã đạt đến trạng thái cân bằng.
Bài 24 :
Quan sát Hình 1.1 và ghép mỗi đối tượng ở cột A với một mô tả thích hợp ở
cột B.
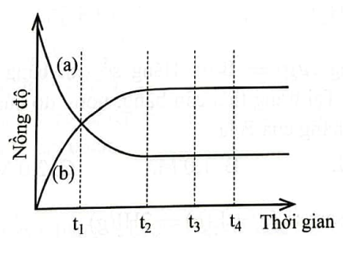
Hình 1.1. Biến thiên nồng độ chất phản ứng và chất sản phẩm theo thời gian
|
Cột A |
Cột B |
|
a) Đường a |
1. không phải là thời điểm bắt đầu trạng thái cân bằng |
|
b) t1 |
2. mô tả biến thiên nồng độ chất sản phẩm theo thời gian. |
|
c) Đường b |
3. là thời điểm phản ứng đạt trạng thái cân bằng. |
|
d) t2 |
4. mô tả biến thiên nồng độ chất phản ứng theo thời gian. |
Bài 25 :
Điền từ ngữ thích hợp vào các chỗ trống trong mỗi phát biểu sau:
a) Phản ứng thuận nghịch là phản ứng hoá học trong đó ở cùng điều kiện, xảy ra ...(1)... sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển ...(2)... thành ...(3)....
b) Trạng thái cân bằng của mọi phản ứng thuận nghịch luôn có tốc độ phản ứng thuận ...(1)... tốc độ phản ứng nghịch, các phản ứng thuận và nghịch luôn diễn ra. Như vậy, cân bằng hoá học là ...(2)....
c) Với một phản ứng hoá học, khi hằng số cân bằng rất lớn so với 1 thì ở trạng thái cân bằng, nồng độ các chất sản phẩm ...(1)... nồng độ ...(2)...
Bài 26 :
Dựa vào giá trị hằng số cân bằng của các phản ứng dưới đây, hãy cho biết phản ứng nào có hiệu suất cao nhất và phản ứng nào có hiệu suất thấp nhất.
\(\begin{array}{l}(a){N_2}{O_4}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{O_2}(g){K_C} = 0,2\\(b){H_2}(g) + {I_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HI(g){K_C} = 50\\(c)C{O_2}(g) + {H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CO(g) + {H_2}O(g){K_C} = 0,659\end{array}\).
Bài 27 :
Cho phản ứng hoá học sau: \[2{\rm{NO}}\left( g \right){\rm{ }} + {\rm{ }}{{\mathop{\rm O}\nolimits} _2}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{N}}{{\rm{O}}_2}\left( g \right){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 115{\rm{ kJ}}\]
Nhận xét nào sau đây không đúng?
A. Nếu tăng nhiệt độ thì cân bằng trên chuyển dịch theo chiều nghịch.
B. Nếu tăng áp suất thì cân bằng trên chuyển dịch theo chiều nghịch.
C. Hằng số cân bằng của phản ứng trên chỉ phụ thuộc vào nhiệt độ.
D. Phản ứng thuận là phản ứng toả nhiệt.
Bài 28 :
Điều nào sau đây là đúng khi nói về nồng độ của các sản phẩm, đối với một phản ứng hóa học đã ở trạng thái cân bằng, giả sử không có sự phá vỡ trạng thái cân bằng?A. Nồng độ của các sản phẩm sẽ không thay đổi vì không còn chất phản ứng
B. Nồng độ của sản phẩm sẽ không thay đổi vì chất tham gia phản ứng đã hết
C. Nồng độ của các sản phẩm sẽ không thay đổi vì tốc độ phản ứng thuận và nghịch bằng nhau
D. Nồng độ của các sản phẩm sẽ thay đổi liên tục do tính thuận nghịch
Bài 29 :
Phản ứng thuận nghịch là:A. Phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
B. Phản ứng trong đó ở điều kiện khắc nghiệt, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
C. Phản ứng trong đó ở cùng điều kiện, xảy ra lần lượt sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
D. Phản ứng trong đó ở điều kiện khắc nghiệt, xảy ra lần lượt sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
Bài 30 :
Sự chuyển dịch cân bằng làA. phản ứng trực tiếp theo chiều nghịch.
B. phản ứng trực tiếp theo chiều thuận.
C. chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác.
D. phản ứng tiếp tục xảy ra cả chiều thuận và chiều nghịch


















Danh sách bình luận