Những oxide nào sau đây tạo ra môi trường acid khi cho vào nước?
A. CO2. B. SO3. C. Na2O. D. CaO. E. BaO.
- Đáp án: A và B
- Giải thích:
CO2 + H2O ⇌ H2CO3
SO3 + H2O → H2SO4

Các bài tập cùng chuyên đề
Bài 1 :
So sánh tính kim loại của sodium và magnesium
Chuẩn bị: kim loại Na; Mg dung dịch phenolphthalein; nước; cốc thủy tinh.
Tiến hành:
- Lấy hai cốc thủy tinh, mỗi cốc có chứa khoảng 200 ml nước, nhỏ tiếp vài giọt dung dịch phenolphtalein.
- Cho một mẩu nhỏ Na vào cốc (1), một dây Mg và cốc (2).
Lưu ý:Hầu hết các kim loại kiềm phản ứng với nước mãnh liệt, chỉ sử dụng các kim loại kiềm với lượng nhỏ; cần làm sạch bề mặt dây Mg trước khi cho vào cốc (2).
Quan sát hiện tượng và trả lời câu hỏi:
1. Viết phương trình hóa học của các phản ứng.
2. So sánh mức độ phản ứng của sodium và magnesium với nước.
2. So sánh tính phi kim của chlorine và iodine
Chuẩn bị: Hình ảnh hoặc video phản ứng của nước chlorine với dung dịch potassium iodide.
Tiến hành: Quan sát hình ảnh hoặc xem video phản ứng của nước chlorine với dung dịch potassium iodide.
Câu hỏi: So sánh tính phi kim của chlorine và iodine.

Bài 2 :
Trong một chu kì của bảng tuần hoàn, tính chất của các oxide và hydroxide biến đổi theo xu hướng nào?Bài 3 :
Nguyên tố gallium thuộc nhóm IIIA và nguyên tố selenium thuộc nhóm VIA của bảng tuần hoàn. Viết công thức hóa học của oxide, hydroxide (ứng với hóa trị cao nhất) của hai nguyên tố trên.Bài 4 :
Phản ứng của oxide với nước
Trong một thí nghiệm, cho lần lượt các oxide Na2O, MgO, P2O5 vào nước, nhúng giấy quỳ tím vào dung dịch sau phản ứng, hiện tượng phản ứng được trình bày trong bảng sau:
|
Tan hoàn toàn trong nước Quỳ tím chuyển màu đỏ |
Trả lời câu hỏi:
1. Viết phương trình hóa học của các phản ứng xảy ra trong thí nghiệm trên.
2. So sánh tính acid - base của các oxide và hydroxide tương ứngTrả lời câu hỏi:
1. Viết phương trình hóa học của các phản ứng xảy ra trong thí nghiệm trên.
2. So sánh tính acid - base của các oxide và hydroxide tương ứng
Bài 5 :
Phản ứng của muối với dung dịch acid
Chuẩn bị: dung dịch Na2CO3; dung dịch HNO3 loãng; ống nghiệm.
Tiến hành:
Thêm từng giọt dung dịch Na2CO3 vào ống nghiệm chứa dung dịch HNO3.
Quan sát hiện tượng và trả lời câu hỏi:
a) Viết phương trình hóa học của phản ứng
b) Hãy so sánh độ mạnh yếu giữa axit HNO3 và H2CO3
Bài 6 :
Trong các chất dưới đây, chất nào có tính acid yếu nhất
A. H2SO4
B. HClO4
C. H3PO4
D. H2SiO3
Bài 7 :
Dãy gồm các chất có tính base tăng dần là
A. Al(OH)3, Mg(OH)2, NaOH
B. NaOH, Mg(OH)2, Al(OH)3
C. Mg(OH)2, Al(OH)3, NaOH
D. Al(OH)3, NaOH, Mg(OH)2
Bài 8 :
Những đại lượng và tính chất nào của nguyên tố hóa học cho dưới dây không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
A. Tính kim loại và phi kim
B. Tính acid – base của các hydroxide
C. Khối lượng nguyên tử.
D. Cấu hình electron lớp ngoài cùng của nguyên tử.
Bài 9 :
Sulfur (S) là nguyên tố thuộc nhóm VIA, chu kì 3 của bảng tuần hoàn. Trong các biểu thức sau:
(1) Nguyên tử S có 3 lớp electron và có 10 electron p.
(2) Nguyên tử S có 5 electron hóa trị và 6 electron s.
(3) Công thức oxide cao nhất của S có dạng SO3 và là acidic oxide.
(4) Nguyên tố S có tính phi kim mạnh hơn so với nguyên tố có số hiệu nguyên tử là 8.
(5) Hydroxide cao nhất của S có dạng H2SO4 và có tính acid.
Số phát biểu đúng là
A. 2.
B. 3.
C. 4.
D. 5.
Bài 10 :
X và Y là hai nguyên tố thuộc nhóm A, trong cùng một chu kì của bảng tuần hoàn. Oxide cao nhất của X và Y có dạng XO và YO3. Trong các phát biểu sau:
(1) X và Y thuộc 2 nhóm A kế tiếp nhau.
(2) X là kim loại, Y là phi kim
(3) XO là basic oxide và YO3 là acidic oxid.
(4) Hydroxide cao nhất của Y có dạng Y(OH)6 và có tính base.
Số phát biểu đúng là:
A. 2.
B. 3.
C. 4.
D. 1.
Bài 11 :
Viết công thức oxide cao nhất của các nguyên tố chu kì 2, từ Li đến N.
Bài 12 :
Giải thích vì sao không dùng chậu nhôm để đựng nước vôi tôi.Bài 13 :
6. Al(OH)3 thể hiện tính acid, tính base trong phản ứng nào trong ví dụ trên?Bài 14 :
Xác định nguyên tố có tính kim loại mạnh nhất, nguyên tố có tính phi kim mạnh nhất. Giải thích.
Viết công thức các hydroxide (nếu có) của những nguyên tố chu kì 2. So sánh tính acid, tính base của chúng.
Bài 15 :
Hoàn thành chỗ trống trong các câu sau:
a) Trong một chu kì, theo chiểu ... (1)... điện tích hạt nhân, độ âm điện của các nguyên tố có xu hướng tăng dần, tính base của các hydroxide ... (2)... dần.
b) Trong một nhóm, theo chiều ... (3)... điện tích hạt nhân, bán kính các nguyên tử có xu hướng giảm dần, tính acid của các oxide cao nhất ... (4)... dần.
c) Nhóm ...(5)... là nhóm chứa các nguyên tố đứmg đầu mỗi chu kì trong bảng tuần hoàn. Trong nhóm này, nguyên tử nguyên tố ...(6)... có bán kính lớn nhất. Số lượng các nguyên tố là kim loại của nhóm này là ...(7)...
Bài 16 :
Những đặc trưng nào sau đây thuộc về kim loại nhóm A, những đặc trưng nào thuộc về phi kim?
(1) Dễ nhường electron
(2) Dễ nhận electron
(3) Oxide cao nhất có tính base
(4) Oxide cao nhất có tính acid
Bài 17 :
Trong hai phản ứng sau, phản ứng nào xảy ra, phản ứng nào không xảy ra? Giải thích.
a) H3PO4 + Na2SO4 → ?
b) HNO3 + Na2CO3 → ?
Bài 18 :
Cấu hình electron lớp ngoài cùng của các nguyên tố chu kì 2 và 3 như sau:
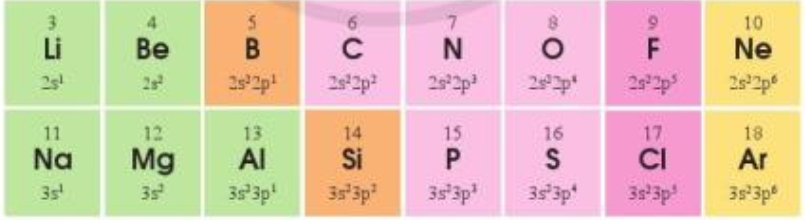
a) Sự lặp lại tuần hoàn về cấu hình electron lớp ngoài cùng của các nguyên tố ở chu kì 2 và 3 thể hiện như thế nào?
b*) Giải thích vì sao sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng là nguyên nhân quyết định đến sự biến đổi tuần hoàn về tính chất hóa học của các đơn chất và hợp chất các nguyên tố chu kì 2 và 3. Lấy một số ví dụ để minh họa sự biến đổi tính chất hóa học của đơn chất và hợp chất.
Bài 19 :
Vì sao khí thải chứa SO2, SO3, NO2,… cũng như nước thải chứa ion kim loại nặng như Fe3+, Cu2+,… ở một số nhà máy thường được xử lí bằng cách cho qua sữa vôi Ca(OH)2?Bài 20 :
Kim loại kiềm là các kim loại nhóm IA, bao gồm: lithium (Li), sodium (Na), potassium (K), rubidium (Rb), caesium (Cs), francium (Fr). Chúng phản ứng được với nước và giải phóng khí hydrogen. Vậy khả năng phản ứng với nước của các kim loại trên có giống nhau hay không? Dựa vào bảng tuần hoàn các nguyên tố hóa học, chúng ta có thể giải thích được xu hướng biến đổi tính chất hóa học cơ bản của nguyên tử các nguyên tố không?
Bài 21 :
Từ các phản ứng của các oxide và hydroxide: Na2O, NaOH, Al2O3, Al(OH)3, SO3, H2SO4 với các dung dịch HCl, KOH, hãy nhận xét tính acid, base của các oxide và hydroxide trên
Bài 22 :
8. Quan sát Bảng 6.2, hãy liên hệ xu hướng biến đổi tính acid, tính base của oxide và hydroxide tương ứng với tính kim loại, phi kim của các nguyên tố trong chu kì
Bài 23 :
Dựa vào xu hướng biến đổi tính acid - base của oxide và hydroxide tương ứng của các nguyên tố trong bảng tuần hoàn, hãy sắp xếp các hợp chất sau đây theo chiều giảm dần tính acid của chúng: H2SiO3, HClO4, H2SO4, H3PO4
Bài 24 :
Xét ba nguyên tố có cấu hình electron lần lượt:
X: 1s22s22p63s1
Y: 1s22s22p63s2
Z: 1s22s22p63s23p1
Tính tăng dần của hydroxide là
A. XOH < Q(OH)2 < Z(OH)3
B. Z(OH)3 < XOH < Q(OH)2
C. Z(OH)3 < Q(OH)2 < XOH
D. XOH < Z(OH)3 < Q(OH)2
Bài 25 :
Một kim loại M phản ứng mãnh liệt với nước tạo thành dung dịch MOH. Nếu M là nguyên tố chu kì 4, hãy viết cấu hình electron của M.
Bài 26 :
Xét hai nguyên tố X và Y. Nguyên tố X có độ âm điện lớn hơn nguyên tố Y.
a) Nếu giữa X và Y hình thành liên kết thì cặp electron liên kết sẽ bị lệch về phía nguyên tử nào?
b) Giả sử X và Y ở cùng một chu kì của bảng tuần hoàn, em hãy dự đoán nguyên tố nào có bán kính nguyên tử lớn hơn. Vì sao?
c) Nếu X và Y ở cùng một chu kì của bảng tuần hoàn, oxide cao nhất của X sẽ có tính acid mạnh hơn hay yếu hơn oxide cao nhất của Y?
Bài 27 :
Khi phát minh ra bảng tuần hoàn, ngoài việc sắp xếp các nguyên tố đã biết, Mendeleev còn dự đoán sự tồn tại của một số nguyên tố chưa được biết tới thời đó. Chẳng hạn, nguyên tố nhóm III (nhóm IIIA trong bảng tuần hoàn hiện đại) ngay liền dưới nhôm được Mendeleev gọi là eka-nhôm (eka - aluminium), với kí hiệu là Ea (eka là từ tiếng Phạn có nghĩa là “đầu tiên”; do đó eka-nhôm là nguyên tố đầu tiên dưới nhôm). Dựa trên những tính chất của nhôm, em hãy dự đoán một số thông tin của nguyên tố eka-nhôm: số electron lớp ngoài cùng, công thức oxide cao nhất, công thức hydroxide và tính acid – base của chúng.
Bài 28 :
Phân loại các oxide sau đây dựa trên tính acid – base: Na2O, MgO, Al2O3, P2O5, SO3, Cl2O7.
|
Basic oxide |
Acidic oxide |
Oxide lưỡng tính |
|
... |
... |
... |
Bài 29 :
Viết phương trình phản ứng của các chất sau với nước (nếu có): Na2O, SO3, Cl2O7, CO2, CaO, N2O5. Nhận xét về tính base, tính acid của các sản phẩm tạo thành.
Bài 30 :
Hydroxide nào có tính acid mạnh nhất trong các hydroxide sau đây? Cho biết hợp chất này được dùng để phân huỷ các quặng phức tạp; phân tích khoáng vật hoặc làm chất xúc tác.
A. Silicic acid.
B. Sulfuric acid.
C. Phosphoric acid.
D. Perchloric acid.


















Danh sách bình luận