X và Y là hai nguyên tố thuộc chu kì nhỏ, thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn. Ở trạng thái đơn chất, X và Y phản ứng được với nhau. Tổng số proton trong hạt nhân nguyên tử của X và Y là 23. Biết rằng X đứng sau Y trong bảng tuần hoàn. Xác định tên nguyên tố X, Y.
Dựa vào
- Các chu kì nhỏ là chu kì 1, 2 và 3
- Hai nguyên tố thuộc chu kì nhỏ và thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn => ta có các trường hợp sau:
+ TH1: Hai nguyên tố cùng chu kì => p1 - p2 = 1
+ TH2: Hai nguyên tố cách nhau 1 chu kì (chu kì 1 và 2 hoặc chu kì 2 và 3)
· Chu kì 1 và 2 => Chỉ có thể là 1H và 4Be
· Chu kì 2 và 3 => p1 - p2 = 9 hoặc p1 - p2 = 7
+ TH3: Hai nguyên tố cách nhau 2 chu kì (chu kì 1 và 3)
=> Chỉ có thể là 1H và 12Mg
- Gọi số hạt proton trong nguyên tử X lần lượt là p1
- Gọi số hạt proton trong nguyên tử Y lần lượt là p2
- Hai nguyên tố thuộc chu kì nhỏ và thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn => ta có các trường hợp sau:
*Xét TH1: Hai nguyên tố cùng chu kì => p1 - p2 = 1 (1)
- Tổng số proton trong hạt nhân nguyên tử của X và Y là 23 => p1 + p2 = 23 (2)
=> Từ (1) và (2) giải hệ 2 phương trình 2 ẩn ta có p1 = 12, p2 = 11
=> Vậy nguyên tố X là Magnesium (Mg) và nguyên tố Y là Sodium (Na)
- Tuy nhiên ở trạng thái đơn chất, Mg không phản ứng với Na ð Loại
*Xét TH2: Hai nguyên tố cách nhau 1 chu kì (chu kì 1 và 2 hoặc chu kì 2 và 3)
+ Chu kì 1 và 2 => Chỉ có thể là 1H và 4Be => Loại vì tổng số proton trong hạt nhân nguyên tử của X và Y là 23
+ Chu kì 2 và 3 => · p1 - p2 = 9 (1)
- Tổng số proton trong hạt nhân nguyên tử của X và Y là 23 => p1 + p2 = 23 (2)
=> Từ (1) và (2) giải hệ 2 phương trình 2 ẩn ta có p1 = 16, p2 = 7
=> Vậy nguyên tố X là Sulfur (S) và nguyên tố Y là Nitrogen (N)
- Tuy nhiên ở trạng thái đơn chất, S không phản ứng với N2 ð Loại
+ Chu kì 2 và 3 => · p1 - p2 = 7 (1’)
- Tổng số proton trong hạt nhân nguyên tử của X và Y là 23 => p1 + p2 = 23 (2)
=> Từ (1’) và (2) giải hệ 2 phương trình 2 ẩn ta có p1 = 15, p2 = 8
=> Vậy nguyên tố X là Phosphorus (P) và nguyên tố Y là Oxygen (O)
=> Thỏa mãn vì ở trạng thái đơn chất ta có: 4P + 5O2 2P2O5
* Xét TH3: Hai nguyên tố cách nhau 2 chu kì (chu kì 1 và 3)
=> chỉ có thể là 1H và 12Mg => Loại vì tổng số proton trong hạt nhân nguyên tử của X và Y là 23
=> Vậy nguyên tố X là Phosphorus (P) và nguyên tố Y là Oxygen (O)

Các bài tập cùng chuyên đề
Bài 1 :
Dựa vào Bảng 6.1, cho biết số electron lớp ngoài cùng của nguyên tử các nguyên tố: Li, Al, Ar, Ca, Si, Se, P, Br

Bài 2 :
Nguyên tố phosphorus có Z = 15, có trong thành phần của một loại phân bón , diêm, pháo hoa; nguyên tố calcium có Z = 20, đóng vai trò rất quan trọng đối với cơ thể, đặc biệt là xương và răng. Xác định vị trí của 2 nguyên tố trên trong bảng tuần hoàn và cho biết chúng thuộc loại nguyên tố s, p hay d; là kim loại, phi kim hay khí hiếm.Bài 3 :
Sulfur (S) là chất rắn, xốp, màu vàng nhạt ở điều kiện thường. Sulfur và hợp chất của nó được sử dụng trong acquy, bột giặt, thuốc diệt nấm; do dễ cháy nên S còn được dùng để sản xuất các loại diêm, thuốc sung, pháo hoa,…Trong bảng tuần hoàn, nguyên tố S nằm ở chu kì 3, nhóm VIA.
a) Nguyên tử của nguyên tố S có bao nhiêu electron thuộc lớp ngoài cùng?
b) Các electron lớp ngoài cùng thuộc những phân lớp nào
c) Cấu hình electron nguyên tử S
d) S là nguyên tố kim loại hay phi kim?
Bài 4 :
Bằng cách viết cấu hình electron, hãy xác định những nguyên tố nào thuộc khối s, những nguyên tố nào thuộc khối p ở chu kì 2 trong bảng tuần hoàn.
Bài 5 :
Nguyên tố X và Y có số liệu nguyên tử lần lượt là 21 và 35. Viết cấu hình electron, từ dó xác định vị trí của X, Y (số thứ tự của ô nguyên tố, chu kì và nhóm) trong bảng tuần hoàn.
Bài 6 :
Hãy cho biết những thông tin thu được từ ô nguyên tố Vanadium

Bài 7 :
Nguyên tố phổ biến nhất Trái Đất nằm ở ô số bao nhiêu trong bảng tuần hoàn?
Nguyên tố được bổ sung vào muối ăn để giảm nguy cơ bướu cổ thuộc chu kì nào trong bảng tuần hoàn?
Bài 8 :
Quan sát bảng tuần hoàn (Phụ lục 1) và cho biết các nguyên tố nhóm IA có đặc điểm về cấu hình electron tương tự nhau như thế nào?
Bài 9 :
Viết cấu hình electron nguyên tử Na. Cho biết trong bảng tuần hoàn, Na nằm ở ô số 11, chu kì 3, nhóm IA. Nêu mối liên hệ giữa số hiệu nguyên tử, số lớp electron, số electron lớp ngoài cùng và vị trí của Na trong bảng tuần hoàn.
Bài 10 :
Từ cấu hình electron của Fe là 1s22s22p63s23p63d64s2, hãy xác định vị trí của Fe trong bảng tuần hoàn.
Bài 11 :
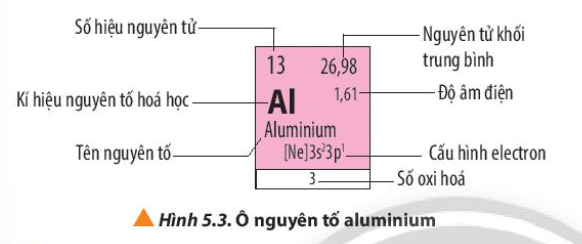
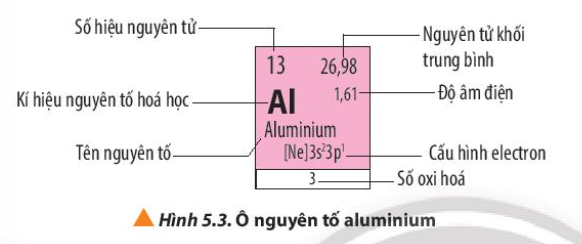
Quan sát Hình 5.3, em hãy nêu các thông tin có trong ô nguyên tố aluminium
Bài 12 :
Quan sát Hình 5.3, cho biết số electron lớp ngoài cùng, số proton của nguyên tử aluminium
Bài 13 :
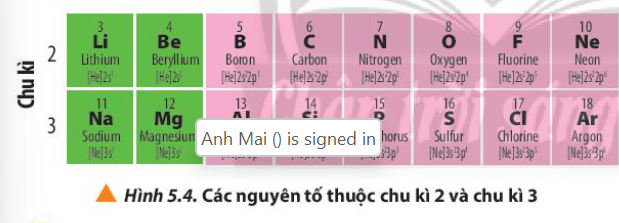
Quan sát Hình 5.4, hãy nhận xét về số lớp electron trong nguyên tử của các nguyên tố cùng chu kì.
Bài 14 :
Dựa vào cấu hình electron, em hãy cho biết nguyên tố có số hiệu nguyên tử là 20 thuộc chu kì nào trong bảng tuần hoànBài 15 :
Quan sát Hình 5.2, nhận xét đặc điểm cấu hình electron nguyên tử của các nguyên tố trong cùng một nhóm A
Bài 16 :
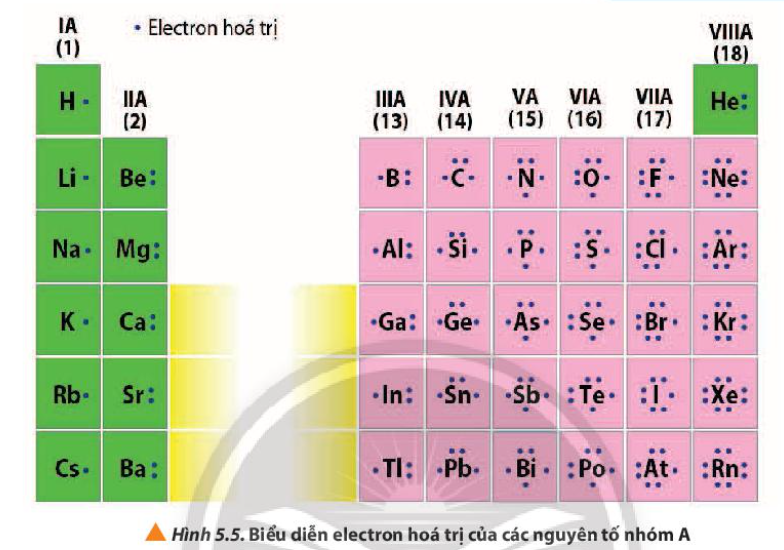
Quan sát Hình 5.5, nhận xét mối quan hệ giữa số electron hóa trị của nguyên tử với số thứ tự nhóm của nguyên tố nhóm A
Bài 17 :
Quan sát Hình 5.2, dựa vào cấu hình electron nguyên tử, hãy nhận xét mối quan hệ giữa số electron hóa trị của nguyên tử các nguyên tố với số thứ tự nhóm của nguyên tố nhóm B. Nêu rõ các trường hợp đặc biệt.
Bài 18 :
Dựa vào cấu hình electron, cho biết nguyên tố có số hiệu nguyên tử là 6, 8, 18, 20 thuộc khối nguyên tố nào trong bảng tuần hoàn. Chúng là kim loại, phi kim hay khí hiếm?
Bài 19 :
Nitrogen là thành phần dinh dưỡng cần thiết cho sự sinh trưởng, phát triển và sinh sản của thực vật. Biết nitrogen có số hiệu nguyên tử là 7.
a) Viết cấu hình electron của nitrogen
b) Nitrogen là nguyên tố s, p, d hay f?
c) Nitrogen là kim loại, phi kim hay khí hiếm?
Bài 20 :
Viết cấu hình electron nguyên tử của các nguyên tố sau:
a) Nguyên tố thuộc chu kì 4, nhóm IIA
b) Nguyên tố khí hiếm thuộc chu kì 3
Bài 21 :
Calcium (Ca) là nguyên tố kim loại chiếm khối lượng nhiều nhất trong cơ thể con người. Răng và xương là các bộ phận chứa nhiều calcium nhất. Số hiệu nguyên tử của Ca là 20. Hãy xác định vị trí của calcium trong bảng tuần hoàn.
Bài 22 :
Hãy ghép mỗi cấu hình electron ở cột A với mô tả thích hợp về vị trí nguyên tố trong bảng tuần hoàn ở cột B.
|
Cột A |
Cột B |
|
a) 1s22s22p6 |
1. Nguyên tố nhóm IIIA |
|
b) [Ar] 3d54s1 |
2. Nguyên tố ở ô thứ 11 |
|
c) [He] 2s22p1 |
3. Nguyên tố ở nhóm VIIIA |
|
d) 1s22s22p63s1 |
4. Nguyên tố ở chu kì 4 |
Bài 23 :
Cấu hình electron của nguyên tử sắt là 1s22s22p63s23p63d64s2. Vị trí của sắt trong bảng tuần hoàn là:
A. ô số 26, chu kì 3, nhóm VIIIB.
B. ô số 26, chu kì 3, nhóm VIIIA.
C. ô số 26, chu kì 4, nhóm VIIIA.
D. ô số 26, chu kì 4, nhóm VIIIB
Bài 24 :
Cấu hình electron của nguyên tử oxygen là 1s22s22p4. Vị trí của oxygen trong bảng tuần hoàn là:
A. ô số 6, chu kì 2, nhóm VIA.
B. ô số 6, chu kì 3, nhóm VIB.
C. ô số 8, chu kì 2, nhóm VIA.
D. ô số 8, chu kì 2, nhóm VIB.
Bài 25 :
Hình bên mô tả ô nguyên tố của vàng trong bảng tuần hoàn các nguyên tố hóa học.
Những thông tin thu được từ ô nguyên tố này là:
A. Vàng có kí hiệu là Au, nguyên tử có 79 proton, nguyên tử khối trung bình là 196,97.
B. Vàng và các hợp chất của vàng có kí hiệu là Au, có số hiệu nguyên tử là 79, nguyên tử khối trung bình là 196,97.
C. Vàng và các hợp chất của vàng có kí hiệu là Au, có số hiệu nguyên tử là 79, vàng có hai đồng vị với số khối là 196 và 197.
D. Vàng có kí hiệu là Au, số hiệu nguyên tử là 79, có hai đồng vị với số khối là 196 và 197.
Bài 26 :
X, Y là hai nguyên tố thuộc cùng nhóm A ở hai chu kì liên tiếp trong bảng tuần hoàn, có tổng số proton trong hai hạt nhân là 32. Viết cấu hình electron của nguyên tử X và Y. Xác định tên X, Y
Bài 27 :
Hai nguyên tố X và Y đứng kế tiếp nhau trong cùng một chu kì, có tổng số điện tích hạt nhân bằng 25.
a) Hãy viết cấu hình electron của nguyên tử X, Y.
b) Xác định vị trí của X, Y trong bảng tuần hoàn và tên nguyên tố X, Y.
Bài 28 :
Viết cấu hình electron nguyên tử của các nguyên tố và xác định tên nguyên tố:
a) Chu kì 3, nhóm IIIA, được dùng trong ngành công nghiệp chế tạo, cụ thể là tạo ra các chi tiết cho xe ô tô, xe tải, tàu hoả, tàu biển và cả máy bay.
b) Chu kì 4, nhóm IB, được sử dụng rất nhiều trong sản xuất các nguyên liệu như dây điện, que hàn, tay cầm, các đồ dùng nội thất trong nhà, các tượng đúc, nam châm điện từ, các động cơ máy móc,…
Bài 29 :
Xác định vị trí của nguyên tố (ô, chu kì và nhóm) của nguyên tố có
a) số hiệu nguyên tử là 20, là nguyên tố giúp xương chắc khoẻ, phòng ngừa những bệnh loãng xương, giảm tinh trạng đau nhức và khó khăn trong vận động, làm nhanh lành các vết nứt gãy trên xương.
b) 9 electron, được sử dụng để điều chế một số dẫn xuất hydrocarbon, làm sản phẩm trung gian để sản xuất ra chất dẻo.
c) 28 proton, được dùng trong việc chế tạo hợp kim chống ăn mòn.
d) số khối là 52 và 28 neutron, dùng chế tạo thép không gì.
Bài 30 :
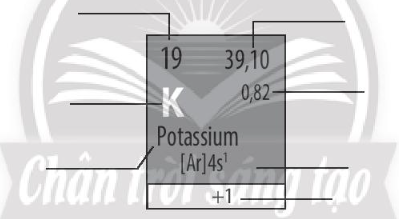
Hãy cho biết ý nghĩa của các thông tin có trong ô nguyên tố sau:



















Danh sách bình luận