Viết các công thức Lewis cho mỗi phân tử sau:
a) Cl2, N2
b) SO2, SO3
c) H2O, H2S, HOCl
Bước 1: Xác định tổng electron hóa trị trong phân tử
Bước 2: Vẽ khung phân tử
Bước 3: Điền các electron hóa trị chưa tham gia liên kết vào các nguyên tử xung quanh
Bước 4: Tính số electron hóa trị còn lại
a) Cl2
Bước 1: Cl có 7 electron hóa trị
=> Tổng electron hóa trị Cl2 = 7.2 = 14 electron
Bước 2: Vẽ khung phân tử với các liên kết đơn
Cl - Cl
Bước 3: Mỗi nguyên tử Cl cần 6 electron hóa trị để đạt octet
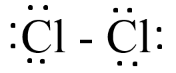
Bước 4:
- Số electron hóa trị còn lại = 14 – 2.6 – 1.2 = 0
=> Công thức Lewis của Cl2
N2
Bước 1: N có 5 electron hóa trị
=> Tổng electron hóa trị N2 = 5.2 = 10 electron
Bước 2: Vẽ khung phân tử với các liên kết đơn
N - N
Bước 3: Hoàn thiện octet cho nguyên tử N
Bước 4:
- Số electron hóa trị còn lại là: 10 – 6.2 – 2.1 = - 4
- Số electron hóa trị của nguyên tử N là 5, nên để đạt octet mỗi nguyên tử N sẽ góp chung 3 electron hóa trị để tạo liên kết với nhau.
Công thức Lewis của phân tử N2 là
b) SO2
Bước 1: S có 6 electron hóa trị, O có 6 electron hóa trị
=> Tổng electron hóa trị SO2 = 6 + 6.2 = 18 electron
Bước 2: Vẽ khung phân tử với các liên kết đơn
O – S - O
Bước 3: Hoàn thiện octet cho nguyên tử O
Bước 4:
- Số electron hóa trị còn lại là: 18 – 6.2 – 2.2 = 2
- Nguyên tử S có 4 electron hóa trị nên 1 nguyên tử O sẽ dùng 1 cặp electron để tạo liên kết với S và nguyên tử S còn 1 đôi electron chưa tham gia liên kết.
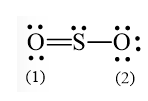
SO3
Bước 1: S có 6 electron hóa trị, O có 6 electron hóa trị. Trong phân tử SO3, có 1 nguyên tử S và 3 nguyên tử O
⇒ Tổng số electron hóa trị = 1.6 + 3.6 = 24 electron
Bước 3: Mỗi nguyên tử O cần 6 electron để đạt octet.
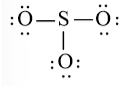
Bước 4: Số electron hóa trị còn lại là: 24 – 2.3 – 6.3 = 0
Tuy nhiên S chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O tạo thành cặp electron dùng chung.
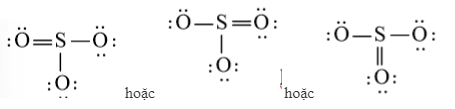
c) H2O
Bước 1. Tổng số electron hóa trị là 1.2 + 1.6 = 8
Bước 2. Trong phân tử H2O, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron hóa trị để đạt octet. Vì vậy, O là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh.
H – O – H.
Bước 3. Nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại là: 8 – 2.2 = 4
Nguyên tử O có 4 electron hóa trị nên sẽ chuyển 4 electron còn lại cho O để nguyên tử O đạt octet.
Công thức Lewis của H2O là:
H2S
Bước 1. Tổng số electron hóa trị của phân tử = 1.2 + 1.6 = 8 electron
Bước 2. Trong phân tử H2S, nguyên tử S cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, nguyên tử S là nguyên tử trung tâm, còn 2 nguyên tử H được xếp xung quanh:
H – S – H
Bước 3. 2 nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại = 8 – 2.2 = 4
Nguyên tử S có 4 electron hóa trị nên để đạt octet thì chuyển 4 electron còn lại cho nguyên tử S.
Công thức Lewis của H2S là:
HOCl
Bước 1. Tổng số electron hóa trị của phân tử = 1.1 + 1.6 + 1.7 = 14 electron.
Bước 2. Trong phân tử HOCl, nguyên tử Cl cần 1 electron để đạt octet, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, O là nguyên tử trung tâm, nguyên tử H và Cl được xếp xung quanh:
H – O – Cl
Bước 3. Nguyên tử H đã đạt octet, nguyên tử Cl cần 6 electron hóa trị để đạt octet:
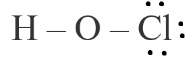
Bước 4. Số electron hóa trị còn lại = 14 – 2.2 – 3.2 = 4
Nguyên tử O có 4 electron hóa trị nên sẽ chuyển 4 electron còn lại cho O để nguyên tử O đạt octet.

Các bài tập cùng chuyên đề
Bài 1 :
Để hình thành phân tử phosphorus trichloride (PCl3) thì mỗi nguyên tử chlorine và phosphorus đã góp chung bao nhiêu electron hóa trị? Viết công thức Lewis của phân tử
Bài 2 :
Theo độ âm điện, boron trifluoride là hợp chất ion, thực tế nó là hợp chất cộng hóa trị, với công thức Lewis như sau:
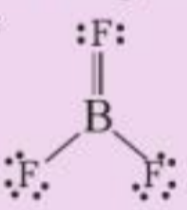
a) Viết phương trình hóa học tạo chất trên từ các đơn chất
b) Phân tử BF3 có bao nhiêu liên kết σ và bao nhiêu liên kết п?
Bài 3 :
Viết công thức electron, công thức Lewis và công thức cấu tạo của Cl2, H2O, CH4
Bài 4 :
Viết công thức Lewis của các phân tử CS2, SCl2 và CCl4
Bài 5 :
Viết công thức Lewis của PCl5 và SF6
Bài 6 :
Viết công thức Lewis và xác định dạng hình học của CS2. Xác định dạng lai hóa của nguyên tử trung tâm C trong phân tử này.
Bài 7 :
Xác định công thức Lewis của nitric acid HNO3. Cho biết nguyên tử H liên kết với O mà không phải với N.
Bài 8 :
Viết công thức Lewis của CF4, C2H6, C2H4 và C2H2
Bài 9 :
Các điện tích cùng dấu thì đẩy nhau hay hút nhau?
Bài 10 :
Viết công thức Lewis của CH4, BF3, SO3, F2O
Bài 11 :
Viết công thức cấu tạo của CO2 và H2O
Bài 12 :
Những electron như thế nào được gọi là:
a) Electron hóa trị
b) Electron chung
c) Electron hóa trị riêng
Bài 13 :
Mở đầu: Theo em, dạng hình học nào sau đây của hai phân tử carbon dioxide và nước là đúng?
Bài 14 :
Trình bày sự tạo thành liên kết hóa học trong các phân tử sau dựa vào sự lai hóa của các nguyên tử trung tâm:
a) C2H2
b) C2H4
c) NH3
Bài 15 :
Viết công thức VSEPR và dự đoán hình học của các phân tử sau:
a) HCN
b) SO3
c) PH3
Bài 16 :
Viết công thức Lewis của các phân tử sau:
a) HCN
b) SO3
Bài 17 :
Viết công thức VSEPR của H2O, NH3 và SO2
Bài 18 :
Theo công thức Lewis của nước, phân tử nước có bao nhiêu cặp electron chung và bao nhiêu cặp electron riêng ở nguyên tử trung tâm?
Bài 19 :
Viết công thức Lewis của phân tử CCl4
Bài 20 :
Hãy tính tổng số electron hóa trị của phân tử BF3
Bài 21 :
Khi dùng chlorine để khử trùng hồ bơi, chlorine sẽ phản ứng với urea trong nước tiểu và mồ hôi người tắm, tạo hợp chất nitrogen trichloride (NCl3), gây ra nhiều tác động xấu đến sức khỏe như đỏ mắt, hen suyễn,…
Viết công thức Lewis của nitrogen trichloride
Bài 22 :
Viết công thức electron của phân tử methane (CH4)
Bài 23 :
Viết công thức Lewis của nguyên tử oxygen và nguyên tử magnesium.
Bài 24 :
Cho các phân tử NCl3, SO3, CO2
a) Nguyên tử trung tâm trong các phân tử trên ở trạng thái lai hóa nào?
b) Phân tử nào không phân cực, phân tử nào phân cực? Vì sao?
Bài 25 :
Viết công thức của một số phân tử sau theo mô hình VSEPR: CCl4, H2S, CO2, SO3 và PH3. Nêu số cặp electron hóa trị liên kết và chưa liên kết trong mỗi phân tử
Bài 26 :
Công thức Lewis của NO2 là

Bài 27 :
Trình bày các bước để viết công thức Lewis của phân tử NH3
Công thức cấu tạo của CO2 là O = C = O
Công thức cấu tạo của H2O là H – O – H
Bài 28 :
Công thức Lewis của CS2 là
Bài 29 :
Dạng hình học phân tử ảnh hưởng đến khả năng phản ứng, hoạt tính sinh học, tính phân cực,… của phân tử. Dựa trên cơ sở nào để dự đoán dạng hình học của một phân tử
Bài 30 :
Thiết lập công thức Lewis cho các phân tử H2O, NH3 và CH4. Mỗi phân tử này có bao nhiêu cặp electron hóa trị riêng?













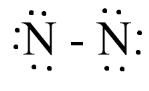
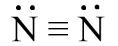
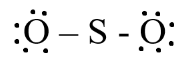
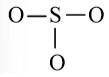
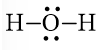
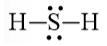







Danh sách bình luận