Giả thiết trong không khí sắt tác dụng với oxygen tạo thành gỉ sắt (Fe2O3). Từ 5,6 gam sắt có thể tạo ra tối đa bao nhiêu gam gỉ sắt.
Dựa vào công thức tính số mol của nguyên tử/ phân tử, các bước lập phương trình hoá học và cân bằng phương trình hoá học
Phương trình:
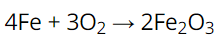
Ta có tỉ lệ:
Số mol Fe : số mol O2 : số mol Fe2O3 = 4 : 3 : 2
Từ tỉ lệ số mol ta xác định được tỉ lệ khối lượng các chất:
Khối lượng Fe : khối lượng O2 : khối lượng Fe2O3 = (56 x 4) : (32 x 3) : (160 x 2) = 7 : 3 : 10
Vậy cứ 7 gam Fe phản ứng hết với 3 gam O2 tạo ra 10 gam Fe2O3
Do đó, từ 5,6 gam Fe có thể tạo ra tối đa (5,6 x 10) : 7 = 8 gam gỉ sắt

Các bài tập cùng chuyên đề
Bài 1 :
Lập phương trình hoá học của phản ứng magnesium (Mg) tác dụng với oxygen (O2) tạo thành magnesium oxide (MgO).
Bài 2 :
Lập phương trình hoá học của phản ứng khi cho dung dịch sodium carbonate (Na2CO3) tác dụng với dung dịch calcium hydroxide (Ca(OH)2) tạo thành calcium carbonate (CaCO3) không tan (kết tủa) và sodium hydroxide (NaOH).
Bài 3 :
Xét phương trình hoá học của phản ứng sau: 4Al + 3O2 → 2Al2O3
a) Cho biết số nguyên tử, số phân tử của các chất tham gia phản ứng và các chất sản phẩm.
b) Cho biết tỉ lệ hệ số của các chất trong phương trình hoá học.
Bài 4 :
Trong dạ dày người có một lượng hydrochloric acid (HCl) tương đối ổn định, có tác dụng trong tiêu hoá thức ăn. Nếu lượng acid này tăng lên quá mức cần thiết có thể gây ra đau dạ dày. Thuốc muối có thành phần chính là sodium hydrogencarbonate (NaHCO3) giúp giảm bớt lượng acid dư thừa trong dạ dày theo phương trình hoá học:
NaHCO3 + HCl → NaCl + H2O + CO2↑
Tìm hiểu và cho biết các thực phẩm có thể gây tăng lượng acid có trong dạ dày.
Bài 5 :
Cho các sơ đồ phản ứng sau
a) Na + O2 → Na2O
b) P2O5 + H2O → H3PO4
c) Fe(OH)3 → Fe2O3 + H2O
d) Na2CO3 + CaCl2 → CaCO3↓ + NaCl
Lập phương trình hoá học và cho biết tỉ lệ số nguyên tử/ số phân tử của các chất trong mỗi phản ứng.
Bài 6 :
Lập phương trình hoá học
a, Fe + O2 → Fe3O4
b, Al + HCl → AlCl3 + H2
c, Al2(SO4)3 + NaOH → Al(OH)3 + Na2SO4
d, CaCO3 + HCl → CaCl2 + CO2 + H2O
Bài 7 :
Sơ đồ của phản ứng hoá học khác với phương trình hoá học ở điểm nào?
Nêu ý nghĩa của phương trình hoá học.
Bài 8 :
Lập phương trình hoá học và xác định tỉ lệ số phân tử của các chất trong sơ đồ phản ứng hoá học sau: Na2CO3 + Ba(OH)2 →BaCO3 + NaOH
Bài 9 :
Đốt cháy hoàn toàn 1,24 gam phosphorus trong bình chứa 1,92 gam khí oxygen (ở dktc) tạo thành phosphorus pentoxide ( P2O5). Khối lượng chất còn dư sau phản ứng là
A. 0,68gam.
B. 0,64 gam.
C. 0,16 gam.
D. 0,32 gam.
Bài 10 :
Điền vào chỗ trống: .......Al + .......O2 → .......Al2O3
-
A.
2, 3, 1.
-
B.
4, 3, 2.
-
C.
4, 2, 3.
-
D.
2, 3, 2.
Bài 11 :
Lập phương trình hóa học của kim loại iron tác dụng với dung dịch sulfuric acid biết sản phẩm là iron (II) sulfate và có khí hydrogen bay lên
-
A.
Fe + H2SO4 → FeSO4 + H2
-
B.
Fe + H2SO4 → Fe2SO4 + H2
-
C.
Fe + H2SO4 → FeSO4 + S2
-
D.
Fe + H2SO4 → FeSO4 + H2S
Bài 12 :
Cho sơ đồ phản ứng: Al + H2O + NaOH \( \to \) NaAlO2 + H2
Sau khi cân bằng với các hệ số nguyên tố tối giản thì hệ số của các chất lần lượt là
-
A.
2, 3, 1, 1, 3
-
B.
2, 3, 2, 2, 3
-
C.
1, 1, 1, 1, 1
-
D.
2, 2, 2, 2, 3


















Danh sách bình luận