Để đạt quy tắc octet, nguyên tử của nguyên tố potassium (Z = 19) phải nhường đi
A. 2 electron
B. 3 electron
C. 1 electron
D. 4 electron
- Viết cấu hình electron của nguyên tử potassium
=> Xu hướng nhường bao nhiêu electron
- Nguyên tử potassium có Z = 19
=> Cấu hình electron: 1s22s22p63s23p64s1
=> Có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm Argon: 1s22s22p63s23p6
Đáp án C

Các bài tập cùng chuyên đề
Bài 1 :
Khi các nguyên tử kết hợp với nhau tạo thành phân tử theo một tỉ lệ xác định, yếu tố nào quyết định tỉ lệ số nguyên tử của mỗi nguyên tố trong phân tử đó?Bài 2 :
Khi nguyên tử fluorine nhận thêm 1 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố nào?Bài 3 :
Để giảm năng lượng, các nguyên tử kết hợp lại thành phân tử theo xu hướng nào?Bài 4 :
Quan sát hiện tượng tự nhiên sau:
Viên bi rơi từ trên cao (vị trí có năng lượng cao hơn) xuống dưới đất (vị trí có năng lượng thấp hơn) mà không tự lăn theo chiều ngược lại.
Hãy cho biết quá trình trên diễn ra theo xu hướng tạo nên hệ bền hơn (năng lượng thấp hơn) hay kém bền hơn (năng lượng cao hơn)

Bài 5 :
Cho nguyên tử các nguyên tố sau: Na (Z = 11), Cl (Z = 17), Ne (Z = 10), Ar (Z = 18)
Những nguyên tử nào trong các nguyên tử trên có lớp electron ngoài cùng bền vững
Bài 6 :
Oxygen có Z = 8, cho biết xu hướng cơ bản của nguyên tử oxygen khi hình thành liên kết hóa học. Hãy vẽ sơ đồ minh họa quá trình đó
Bài 7 :
Tính phi kim được đặc trưng bằng khả năng nhận electron. Xu hướng cơ bản của nguyên tử O và F trong các phản ứng hóa học là nhường hay nhận bao nhiêu electron
Bài 8 :
Cho một số hydrocarbon sau: \(H - C \equiv C - H,{H_2}C = C{H_2},{H_3}C - C{H_3}\)
a) Những nguyên tử H và C nào trong các hydrocarbon trên thỏa mãn quy tắc octet? Biết rằng mỗi gạch (-) trong các công thức biểu diễn hai electron hóa trị chung
b) Một phân tử hydrocarbon có ba nguyên tử C và x nguyên tử H. Giá trị x lớn nhất có thể là bao nhiêu?
Bài 9 :
Khi liên kết với nhau, nguyên tử của các nguyên tố dường như đã cố gắng “bắt chước” cấu hình electron nguyên tử của các nguyên tố khí hiếm để bền vững hơn. Điều này đã được nhà hóa học người Mỹ Lewis (Li-uýt, 1875 – 1946) đề nghị khi nghiên cứu về sự hình thành phân tử từ các nguyên tử. Ông gọi đó là quy tắc octet. Quy tắc octet là gì?

Bài 10 :
Hình 8.1 giải thích sự hình thành phân tử hydrogen (H2) và fluorine (F2) từ các nguyên tử. Theo em, các nguyên tử hydrogen và fluorine đã “bắt chước” cấu hình electron của các nguyên tử khí hiếm nào khi tham gia liên kết?

Bài 11 :
Sử dụng sơ đồ tương tự như Hình 8.1, hãy giải thích sự tạo thành phân tử chlorine (Cl2) và oxygen (O2) từ các nguyên tử tương ứng
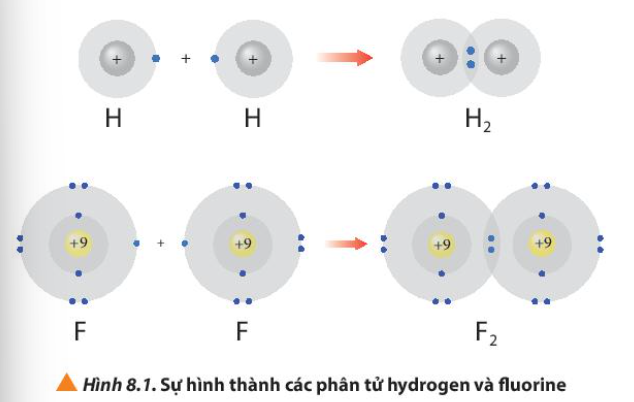
Bài 12 :
Từ Hình 8.2, cho biết mỗi nguyên tử nitrogen đã đạt được cấu hình electron bền vững của nguyên tử khí hiếm nào
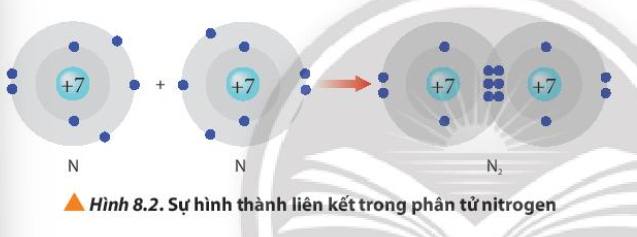
Bài 13 :
Nguyên tử nào sau đây có thể nhường hoặc nhận bốn electron để đạt cấu hình electron bền vững?
A. Silicon.
B. Beryllium.
C. Nitrogen.
D. Selenium.
Bài 14 :
Nguyên tử lithium (Z = 3) có xu hướng nhường hay nhận bao nhiêu electron để lớp vỏ thoả mãn quy tắc octet? Chọn phương án đúng.
A. Nhường 1 electron.
B. Nhận 7 electron.
C. Nhường 11 electron.
D. Nhận 1 electron.
Bài 15 :
Nguyên tử oxygen (Z = 8) có xu hướng nhường hay nhận bao nhiêu electron để đạt lớp vỏ thoả mãn quy tắc octet? Chọn phương án đúng.
A. Nhường 6 electron.
B. Nhận 2 electron.
C. Nhường 8 electron.
D. Nhận 6 electron.
Bài 16 :
Vì sao các nguyên tử lại liên kết với nhau thành phân tử?
A. Để mỗi nguyên tử trong phân tử đạt được cơ cấu electron ổn định, bền vững.
B. Để mỗi nguyên tử trong phân tử đều đạt 8 electron ở lớp ngoài cùng.
C. Để tổng số electron ngoài cùng của các nguyên tử trong phân tử là 8.
D. Để lớp ngoài cùng của mỗi nguyên tử trong phân tử có nhiều electron độc thân nhất.
Bài 17 :
Cấu hình electron lớp ngoài cùng của nguyên tử potassium (kali) là 4s1, cấu hình electron lớp ngoài cùng của nguyên tử bromine là 4s24p5. Làm thể nào các nguyên tử potassium và bromine có được cấu hình electron của nguyên tử khí hiếm theo quy tắc octet.
Bài 18 :
Liên kết hoá học là
A. sự kết hợp của các hạt cơ bản hình thành nguyên tử bền vững.
B. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
C. sự kết hợp của các phân tử hình thành các chất bền vững.
D. sự kết hợp của chất tạo thành vật thể bền vững.
Bài 19 :
Hợp chất X được sử dụng làm thuốc pháo, ngòi nổ, thuốc đầu diêm, thuốc giúp nhãn ra hoa,... X có khối lượng mol bằng 122,5 g/mol, chứa ba nguyên tố, trong đó nguyên tố s có 7 electron s, nguyên tố p có 11 electron p và nguyên tố p có 4 electron p. Thành phần phần trăm khối lượng nguyên tố có 4 electron p trong X bằng 39,19%.
a) Xác định công thức phân tử của X.
b) Viết công thức cấu tạo Lewis, chỉ rõ loại liên kết có trong X.
Bài 20 :
Cho biết tổng số electron trong anion AB32- là 42. Trong các hạt nhân A cũng như B có số proton bằng số neutron.
a) Tính số khối của A, B.
b) Đề xuất cấu tạo Lewis cho anion AB32- sao cho phù hợp với quy tắc octet.
Bài 21 :
Hợp chất NaClO là thành phần của chất tẩy rửa, sát trùng có tên gọi là “Nước Javen”. Áp dụng quy tắc octet để giải thích sự hình thành các liên kết trong hợp chất đó.
Bài 22 :
Dùng công thức Lewis để biểu diễn phân tử SO3 sao cho phù hợp với quy tắc octet. Chỉ rõ các liên kết trong phân tử thuộc loại liên kết nào.
Bài 23 :
Quy tắc octet không đúng với trường hợp phân tử chất nào sau đây?
A. H2S. B. PCl5. C. SiO2. D. Br2.
Bài 24 :
-
A.
nhường 6 electron
-
B.
nhận 2 electron
-
C.
nhường 8 electron
-
D.
nhận 6 electron
Bài 25 :
-
A.
X (Z = 12).
-
B.
Y (Z = 9).
-
C.
Q (Z = 11).
-
D.
T (Z = 10).
Bài 26 :
-
A.
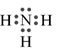
-
B.
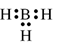
-
C.

-
D.
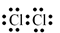
Bài 27 :
Trong phân tử nitrogen (N2), mỗi nguyên tử nitrogen đã góp ba electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử nitrogen đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
-
A.
Xe.
-
B.
Ne.
-
C.
Ar.
-
D.
Kr.
Bài 28 :
Trong các hợp chất, nguyên tử magnesium đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách
-
A.
cho đi 2 electron
-
B.
nhận vào 1 electron
-
C.
cho đi 3 electron.
-
D.
nhận vào 2 electron.
Bài 29 :
Công thức electron nào sau đây không đủ electron theo quy tắc octet?
-
A.
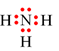
-
B.
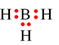
-
C.
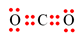
-
D.

Bài 30 :
Khi nguyên tử nhường hoặc nhận electron sẽ tạo thành
-
A.
phân tử.
-
B.
ion.
-
C.
cation.
-
D.
anion.


















Danh sách bình luận