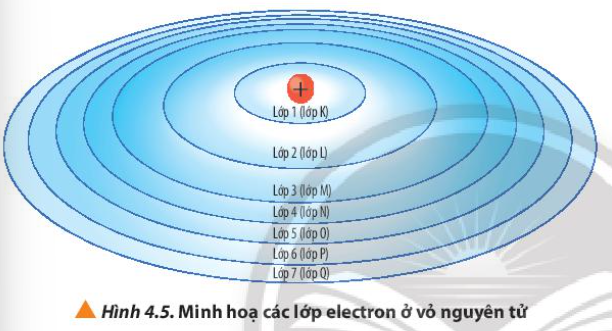
Từ Hình 4.5, cho biết lực hút của hạt nhân với electron ở lớp nào là lớn nhất và lớp nào là nhỏ nhất
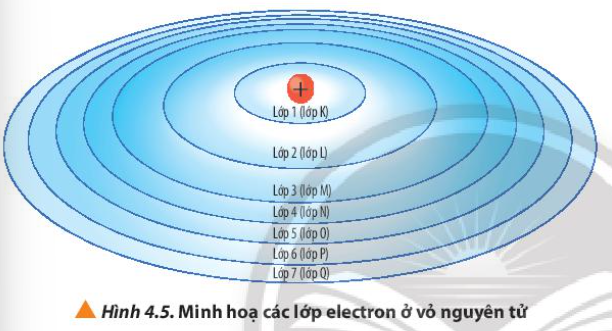
Các lớp càng gần hạt nhân thì lực hút càng lớn
- Lớp K gần hạt nhân nhất => Lực hút của hạt nhân với electron ở lớp K là lớn nhất
- Lớp Q nằm xa hạt nhân nhất => Lực hút của hạt nhân với electron ở lớp Q là nhỏ nhất

Các bài tập cùng chuyên đề
Bài 1 :
Hãy cho biết tổng số electron tối đa chứa trong
a) Phân lớp p
b) Phân lớp d
Bài 2 :
Lớp electron có số electron tối đa gọi là lớp electron bão hòa. Tổng số electron tối đa có trong các lớp L và M là
A. 2 và 8
B. 8 và 10
C. 8 và 18
D. 18 và 32
Bài 3 :
Nguyên tố chlorine có Z = 17. Hãy cho biết số lớp electron, số electron thuộc lớp ngoài cùng, số electron độc thân của nguyên tử chlorineBài 4 :
Cho biết sự phân bố electron theo lớp của các nguyên tử H, He, Li như sau:
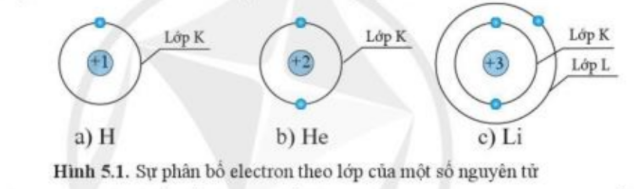
Dựa vào hình 5.1, hãy cho biết số electron tối đa ở lớp K của các nguyên tử có số hiệu nguyên tử Z $ \geqslant $ 2 là bao nhiêu. Theo em, thứ tự phân bố electron vào lớp vỏ nguyên tử như thế nào?
Bài 5 :
Vì sao số AO trong một lớp luôn bằng một nửa số electron tối đa thuộc lớp đó?
Bài 6 :
Các ô (1), (2), (3), (4) trong hình dưới đây liên hệ với nội dung nào về cấu tạo lớp vỏ nguyên tử?
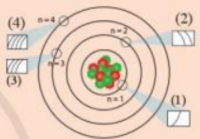
Bài 7 :
Lớp electron thứ tư (n = 4) có bao nhiêu phân lớp và kí hiệu các phân lớp này là gì?
Bài 8 :
Tính số electron tối đa (bão hòa) trên mỗi phân lớp ns, np, nd, nf.
Bài 9 :
Quan sát Hình 4.5, nhận xét cách gọi tên các lớp electron bằng các chữ cái tương ứng với các lớp từ 1 đến 7
Bài 10 :
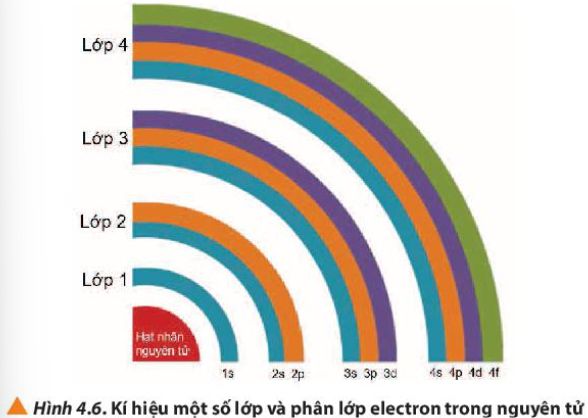
Quan sát Hình 4.6, nhận xét về số lượng phân lớp trong các các lớp từ 1 đến 4
Bài 11 :
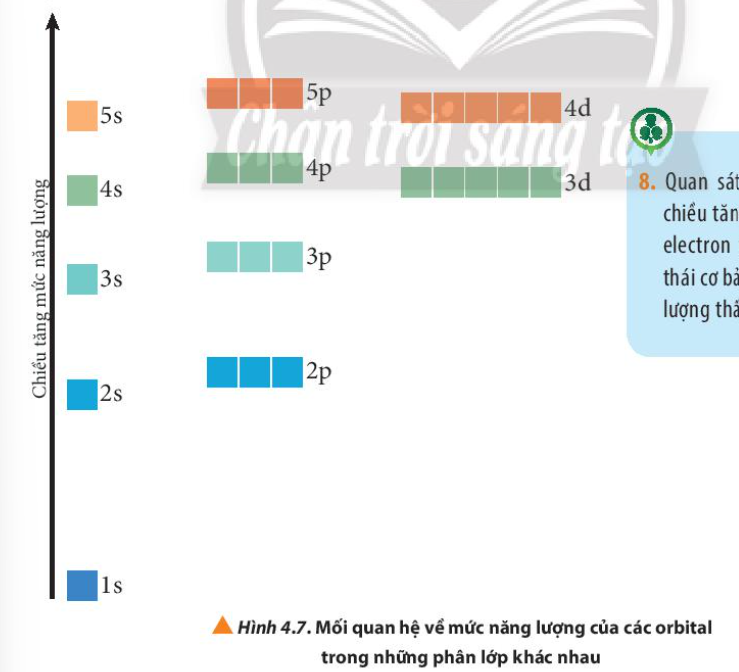
Quan sát Hình 4.7, nhận xét chiều tăng năng lượng của các electron trên các AO ở trạng thái cơ bản (trạng thái có năng lượng thấp nhất)
Bài 12 :
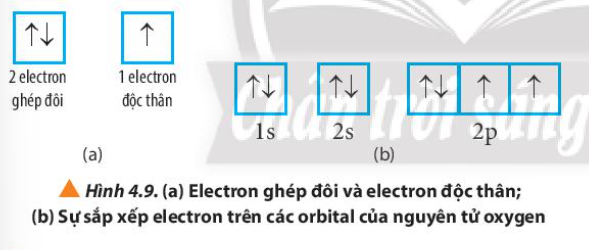
Quan sát Hình 4.9, hãy cho biết nguyên tử oxygen có bao nhiêu electron ghép đôi và bao nhiêu electron độc thân
Bài 13 :
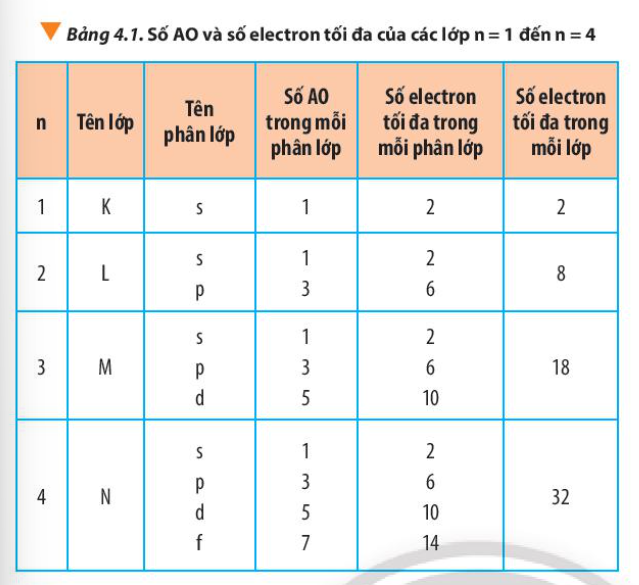
Từ Bảng 4.1, hãy chỉ ra mối quan hệ giữa số thứ tự lớp và số electron tối đa trong mỗi lớp
Bài 14 :
Nguyên tử nitrogen có 2 lớp electron trong đó có 2 phân lớp s và 1 phân lớp p. Các phân lớp s đều chứa số electron tối đa, còn phân lớp p chỉ chứa một nửa số electron tối đa. Nguyên tử nitrogen có bao nhiêu electron?Bài 15 :
Quan sát Hình 4.10, hãy nhận xét số lượng electron độc thân ở mỗi trường hợp

Bài 16 :
Trong các trường hợp (a) và (b) dưới đây, trường hợp nào có sự phân bố electron vào các orbital tuân theo và không tuân theo quy tắc Hund
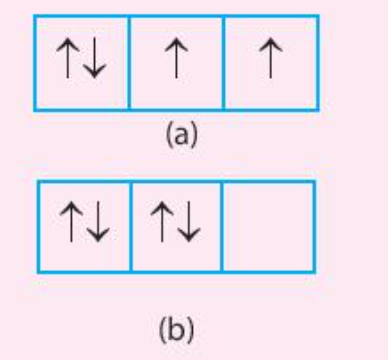
Bài 17 :
Trong các cách biểu diễn electron và các orbital của phân lớp 2p ở trạng thái cơ bản, hãy chọn cách phân bố đúng:

Bài 18 :
Ở trạng thái cơ bản, nguyên tử của những nguyên tố nào dưới đây có electron độc thân?
a) Boron
b) Oxygen
c) Phosphorus
d) Chlorine
Bài 19 :
Cho biết tổng số electron tối đa chứa trong:
a) Phân lớp p;
b) Phân lớp d;
c) Lớp K;
d) Lớp M.
Bài 20 :
Nêu mối quan hệ về năng lượng của electron trên các orbital, các phân lớp, các lớp electron.
Bài 21 :
Trường hợp trong orbital p có chứa hai electron thì có những cách nào biểu diễn electron trong orbital đó? Cách nào tuân theo quy tắc Hund?
Bài 22 :
Dùng ô orbital để mô tả cách sắp xếp electron trong orbital s.
Bài 23 :

Bài 24 :
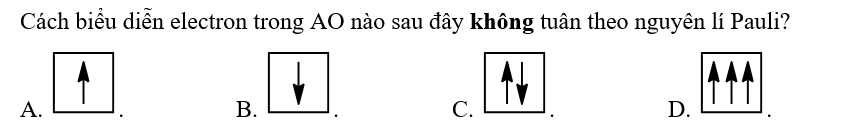
Bài 25 :
Nguyên tố X có Z = 17. Electron lớp ngoài cùng của nguyên tử nguyên tố X thuộc lớp
A. K.
B. L.
C. M.
D. N.
Bài 26 :
Các electron của nguyên tử nguyên tố X được phân bố trên ba lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
A. 6.
B. 8.
C. 14.
D. 16.
Bài 27 :
Lớp M có số electron tối đa bằng
A. 3.
B. 4.
C. 9.
D. 18.
Bài 28 :
Lớp M có số orbital tối đa bằng
A. 3.
B. 4.
C. 9.
D. 18.
Bài 29 :
Lớp L có số phân lớp electron bằng
A. 1.
B. 2.
C. 3.
D. 4.
Bài 30 :
Phân lớp 3d có số electron tối đa là
A. 6.
B. 18.
C. 14.
D. 10.


















Danh sách bình luận